补骨脂乙素治疗溃疡性结肠炎的分子作用机制
2023-06-11邓生琼
杨 提, 李 珊, 邓生琼
(上海市浦东新区公利医院, 上海 200135)
溃疡性结肠炎(ulcerative colitis, UC) 是一种由免疫调节功能紊乱引发的慢性非特异性肠道炎症性疾病, 可导致肠道炎症或溃疡, 增加结直肠癌风险[1-2]. 目前, 临床上治疗UC 的药物主要是氨基水杨酸类、糖皮质激素等药物通过阻碍引起肠道炎症的免疫炎症途径发挥作用,但复发率高、副作用明显. 随着临床上关于中药治疗UC 的研究增多, 中药治疗UC 的优势逐渐凸显. 四神丸、宁肠汤和理脾愈疡汤在治疗UC 有一定的疗效[3-5], 而补骨脂是上述3 种方剂的君药, 具有纳气、止泻、收敛、温肾、助阳等功效. 补骨脂乙素是一种从补骨脂中提取获得的天然査尔酮类小分子化合物, 具有抗菌、抗氧化和抗肿瘤等多种生物活性药理作用[6]. 研究表明, 补骨脂乙素能够有效降低UC 小鼠结肠炎症因子水平, 起到抗UC 的作用[7]. 因此, 明确补骨脂乙素抗UC 的确切作用机制是有必要的. 本工作旨在利用网络药理学方法结合UC 患者结肠黏膜活检样本高通量测序结果以及分子对接技术探索补骨脂乙素干预UC 的潜在靶点,为补骨脂乙素抗UC 的作用机制研究提供新的思路.
1 方 法
1.1 补骨脂乙素靶点获取
首先, 以“isobavachalcone” 为检索词, 通过PubChem 数据库[8]检索补骨脂乙素的SMILES (simplified molecular input entry system) 结构; 其次, 根据其SMILES 结构依次导入SwissTargetPrediction 数据库[9]、PharmMapper 数据库[10]预测补骨脂乙素的结果作用靶点; 然后, 以isobavachalcone 作为检索词于CTD 数据库[11]获取补骨脂乙素作用靶点; 最后,将三者结果取并集去重后得到补骨脂乙素所有可能的作用靶点.
1.2 UC 靶点获取
以“ulcerative colitis”为检索词,通过GeneCards 数据库[12]、DisGeNET 数据库[13]、OMIM数据库、DrugBank 数据库[14]、CTD 数据库、TTD 数据库[15]检索UC 相关治疗靶点.
1.3 基于GEO 数据库的UC 差异表达基因
GSE87466 数据集包含了87 例UC 和21 例健康成人结肠黏膜活检样本的转录组高通量测序数据, 用4.1.2 版本R 软件中的limma 包对UC 组和健康对照组进行基因表达差异分析,其差异标准为|log2FC|≥1.5 且P <0.05, 结果以火山图和热图呈现.
1.4 补骨脂乙素干预UC 靶点预测
将获得的UC 治疗靶点与GSE87466 数据集差异基因合并后去重, 得到的UC 治疗靶点, 并与补骨脂乙素治疗靶点取交集, 绘制交集韦恩图(https://bioinfogp.cnb.csic.es/tools/venny/, venn2.1.0), 交集即为补骨脂乙素可能的抗UC 作用靶点.
1.5 靶点的网络构建和富集分析
将补骨脂乙素-UC 的共同靶点导入STRING 数据库(https://string-db.org/, version 11.0), 物种选择“Homo Sapiens”, 阈值选择“Medium Confidence”, 进行蛋白质-蛋白质相互作用(protein-protein interaction, PPI) 的网络构建. 将得到的结果导入Cytoscape 3.7.2 软件中可视化, 根据经验, 以一级网络特征参数包含节点的中介中心性(betweenness centrality,BC)、接近中心性(closeness centrality, CC)、连接度(degree) 的中位数为筛选条件, 筛选出二级网络图. 同样, 以二级网络特征参数的中位数为筛选条件, 得到三级网络, 最终筛选出核心靶点. R4.1.2 软件中clusterProfiler 包对预测靶点进行基因本体(gene ontology, GO) 和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG) 富集分析, 结果以条形图和气泡图可视化.
1.6 分子对接
在Pubchem 数据库获取的补骨脂乙素SDF 文件,从PDB 数据库(https://www.rcsb.org/)获取核心靶点对应的3D 结构, 利用AutoDockTools 1.5.6 软件对蛋白加氢、计算电荷等处理后与补骨脂乙素分别进行模拟对接, 记录对接分数最低构象的结合能, 对接结果利用PyMOL软件可视化. 对接结果根据自由能判断结合强度, 小于−5.0 kcal/mol 表示具有较好的结合活性, 小于−7.0 kcal/mol 表示具有强烈的结合活性.
2 结 果
2.1 补骨脂乙素靶点筛选
图1 为PubChem 中获取的补骨脂乙素结构. 从SwissTargetPrediction、PharmMapper、CTD数据库分别获取了103、291、4 个补骨脂乙素作用靶点, 取并集后去重共得到366 个靶点.

图1 补骨脂乙素结构Fig.1 Chemical structure of isobavachalcone
2.2 UC 靶点数据库筛选
从CTD 数据库中筛选“Inference Score ≥30” 的147 个靶点, 从GeneCards 数据库获筛选“Relevance.score ≥5” 的545 个靶点, 从OMIM、TTD、DrugBank 和DisGeNET 数据库分别获得2、30、56、308 个靶点, 取并集后共得到1 088 个UC 治疗靶点.
2.3 UC 组和健康对照组基因表达差异分析
以P < 0.05 和|lgFC|≥1.5 为临界值, 从GSE87466 数据集中共筛选出315 个UC 差异基因, 其中196 个为上调基因, 115 个为下调基因. 图2 为差异基因表达谱的火山图. 对差异表达处于前25 位的基因绘制热图以可视化, 结果如图3 所示.
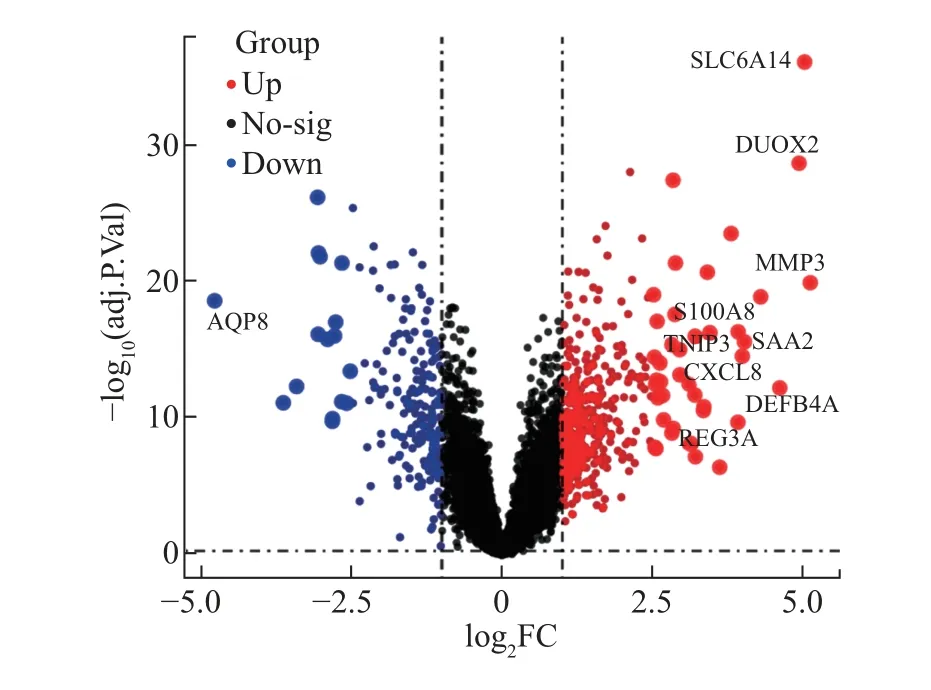
图2 UC 患者和正常结肠组织转录组数据差异基因表达谱的火山图Fig.2 Volcano map of differential gene expression profiles of colonic tissue transcriptome data from UC patients and normal controls

图3 UC 患者和正常结肠组织转录组数据差异基因前25 位基因表达谱热图Fig.3 Heatmap of top 25 differential Gene expression profiling of colonic tissue transcriptome data from UC patients and normal controls
2.4 补骨脂乙素干预UC 靶点预测
把UC 组相比健康对照组的差异基因与数据库预测UC 靶点整合去重后取并集, 得到了1 088 个治疗靶点, 再与补骨脂乙素靶点取交集, 共得到107 个补骨脂乙素干预UC 的潜在靶点(见图4).
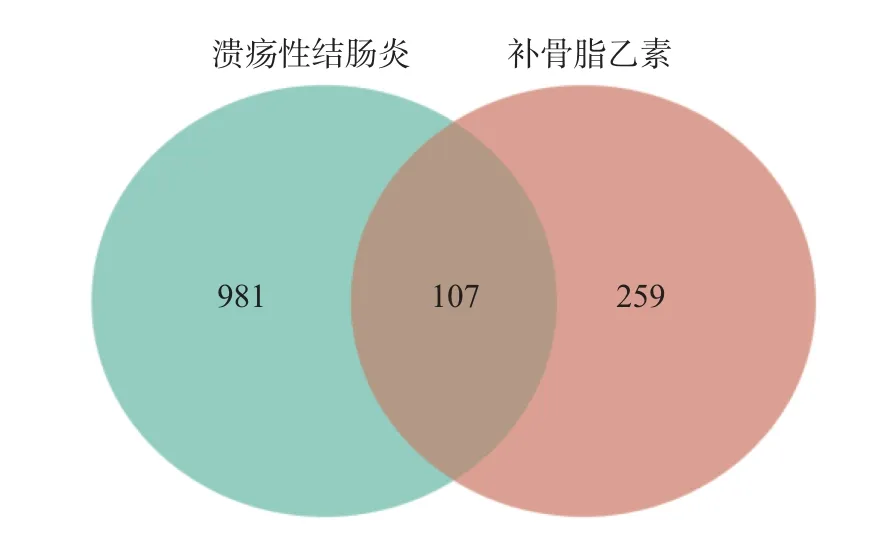
图4 溃疡性结肠炎和补骨脂乙素靶点交集韦恩图Fig.4 Venn diagram of UC and isobavachalcone target intersection
2.5 靶点的网络构建
把107 个靶点导入STRING 数据库构建PPI 网络, 下载该网络的TSV 文件, 共得到107个节点(nodes) 和1171 条边(edges). 图5 为蛋白质靶点相互作用网络图. 将PPI 网络TSV文件导入Cytoscape 软件中可视化, 使用NetworkAnalyzer 工具计算各个节点的网络特征参数Degree (DC)、BC、CC, 即以DC≥17, BC≥0.003 以及CC≥0.512 为条件, 筛选出二级网络图(包含41 个节点和497 条边). 同样, 以二级网络特征参数的中位数为筛选条件, 即以DC≥35、BC≥0.009 以及CC≥0.573 为条件, 得到三级网络(包含14 个节点和89 条边). 最终筛选出6 个靶点作为补骨脂乙素-UC 的核心靶点, 结果图5 和6 所示.
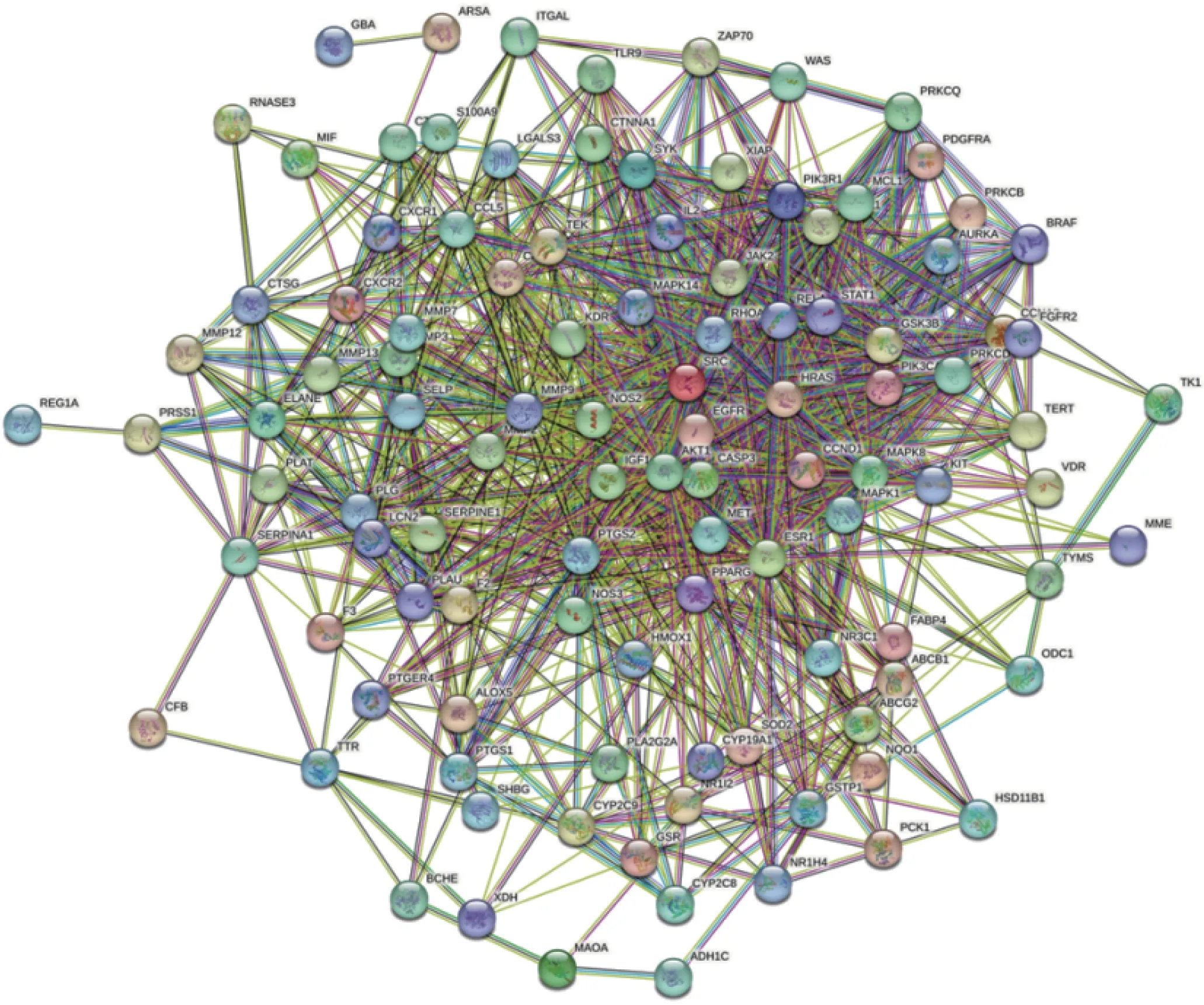
图5 PPI 网络Fig.5 PPI network
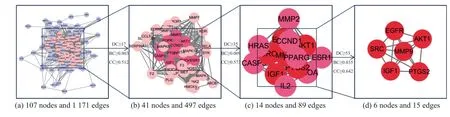
图6 核心靶点筛选流程图Fig.6 Flowchart of core targets screening
2.6 富集分析
对107 个靶点进行富集分析, 结果如图7 所示. 由图7 可知: 生物过程(bioprocess, BP)显著富集于炎症反应、创伤修复、氧化应激反应、对细菌源性分子的应答及细胞对化学应激的应答过程等; 细胞组分(cellular component, CC) 显著富集于囊腔、胞质囊腔、分泌颗粒腔、脂筏及膜微区等; 分子功能(molecular function, MF) 显著富集于丝氨酸内肽酶活性、丝氨酸酶活性、丝氨酸水解酶活性及酪氨酸激酶活性等. KEGG 富集分析显著富集于脂质与动脉粥样硬化、P13K-AKT 信号通路、肺癌蛋白多糖、RAS 信号通路等(见图8).
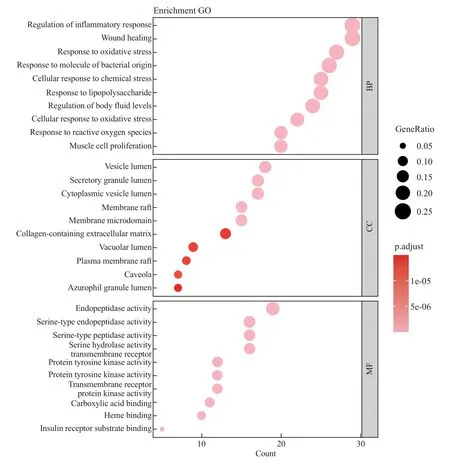
图7 GO 富集分析Fig.7 GO enrichment analysis

图8 KEGG 分析Fig.8 KEGG analysis results
2.7 分子对接
对6 个核心靶点完成模拟分子对接操作后, 发现除PTGS2 以外, 其他靶点与补骨脂乙素均有结合潜力(见表1). 图9 为核心靶点分子对接结果. 可以看出, 丝氨酸/苏氨酸蛋白激酶1(AKT1)、基质金属蛋白酶9(matrix metalloprotein-9, MMP9)、表皮因子生长受体(epidermal growth factor receptor, EGFR)、胰岛素样生长因子(insulin like growth factor I,IGFI) 和非受体酪氨酸激酶(SRC) 与补骨脂乙素有良好的结合能力.

表1 6 个核心靶点分子对接结果Table 1 Docking results of 6 core targets
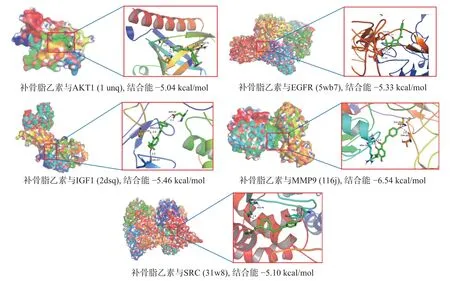
图9 核心靶点分子对接结果Fig.9 Molecules docking results of core targets
3 讨 论
本研究共发现107 个补骨脂乙素干预UC 的潜在治疗靶点, 表明补骨脂乙素可能介导多靶点发挥着抗UC 的作用. GO 富集分析可知这些潜在作用靶点主要参与调控炎症反应、氧化应激应答及细胞对化学应激的应答等, 且很可能发生于囊腔、分泌颗粒腔、脂筏及膜微区等.分子功能主要包括丝氨酸内肽酶活性、丝氨酸酶活性、丝氨酸水解酶活性及酪氨酸激酶活性等. KEGG 富集分析显著富集于脂质与动脉粥样硬化、P13K-AKT 信号通路、RAS 信号通路、Rap1 信号通路等. 根据网络拓扑学参数的中位值, 经过3 轮筛选出了6 个关键靶点, 再经过分子对接模拟验证, 它们与补骨脂乙素均可结合, 其中AKT1、MMP9、EGFR、IGF1 及SRC 有良好的结合能力.
UC 是炎症性肠病(inflammatory bowel disease, IBD) 的类型之一, 其病因与环境刺激、遗传、免疫等多个因素有关[16-18], 其中免疫机制的紊乱是机体多种促炎细胞因子与抗炎细胞因子作用失衡的结果[19-20]. 炎性相关细胞因子的调控和释放与PI3K/AKT 信号传导通路密切相关[21]. PI3K/AKT 活化后, 可激活核因子kB, 调控免疫炎症反应相关基因的表达, 如上调炎症细胞因子IL-8、IL-1β、TNF-α、诱生型一氧化氮合酶(inducible nitric oxide synthase,iNOS) 等基因的表达, 促进细胞因子的产生和释放, 诱导细胞因子的失衡, 引发肠道部位的炎症反应和粘膜损伤, 加剧UC 的进一步恶化[22]. 黄晓丽等[23]通过给予UC 患者结肠粘膜组织PI3K/AKT 信号通路抑制剂干预后,发现结肠组织炎症反应明显减轻.AKT 是PI3K-AKT 信号通路的核心因子, 在细胞增殖、细胞分化、细胞凋亡、代谢、蛋白质合成、转录等多种细胞活动中起关键作用[24-25]. AKT1 作为AKT 家族重要成员之一, 具有促进和维持成肌细胞分化的作用, AKT1 缺失会导致多种组织生长迟缓和细胞凋亡的增加[26-27]. 分析结果表明, AKT1可能作为补骨脂乙素抗UC 的潜在作用靶点, 但仍需进一步实验验证. 金属基质蛋白酶家族(matrix metalloproteinase, MMP) 参与IBD 病变组织的重建和破坏过程. 研究发现, MMP9在UC 患者中持续性高表达且在实验模型中可通过激活肌球蛋白轻链激酶破坏结肠上皮的通透性以及刺激骨髓细胞向病变结肠上皮细胞处募集, 刺激促炎因子TNF 的生成, 诱发炎症发应[28-29]. 李亚兰等[30]发现中药复方葛根芩连汤可通过抑制MMP-9、TNF-α、IL-1β 的表达,阻断p38-MAPK 信号通路的激活, 增加结肠组织紧密连接蛋白的表达, 从而修复肠道黏膜屏障. EGFR 是原癌基因erbB1 编码的一种受体酪氨酸激酶, 其配体表皮生长因子(epidermal growth factor, EGF) 与EGFR 结合后, 启动p85 基因并激活位于细胞膜附近的p110, 催化细胞膜内表面的PIP2 转化为PI3P; PI3P 充当第二信使, 促进下游信号通路AKT、GSK3β 及Wnt 等的活化, 促进结肠上皮细胞的生长和增殖[31-33]. SRC 是一种编码酪氨酸激酶的原癌基因, 参与调节多个生物学过程, 包括细胞增殖、存活、分化、黏附和侵袭等[34]. 研究发现, SRC可通过影响其下游蛋白STAT3 信号通路, 对结肠炎相关癌症早期的发生、发展起关键性作用[35-36]. IGF1 是一种由肝细胞分泌的一种蛋白多肽, 正常状态下具有促进上皮细胞生长、修复的作用. 在UC 发生过程中, 机体处于炎症状态时, IGF1 的表达水平显著下调, 结肠上皮细胞损伤无法及时修复而进一步加剧UC 的恶化[37]. 炎症刺激会诱导UC 患者黏膜内间质细胞向纤维原性表型的细胞转化, 纤维原性表型细胞的活化和持续性增殖导致肠道组织发生纤维化病变[38]. IGF1 参与调控纤维细胞的活化、增殖, 与UC 的发生密切相关[39]. 提示补骨脂乙素可能通过调控IGF1 的表达影响炎症反应发挥其抗UC 的作用, 具体作用机制需要进一步实验验证.
采用网络药理学方法联合GEO 测序数据发现补骨脂乙素干预UC 过程是通过多靶点、多通路来实现的, 分子对接进一步验证了关键靶点与补骨脂乙素结合的可能性, 为补骨脂乙素治疗UC 提供了理论基础. 本工作主要以大数据和生物信息学分析结果为基础, 后续拟进一步展开细胞及动物实验, 以期明确补骨脂乙素治疗UC 的关键作用靶点及信号通路.
