ALD 反应沉积超薄TiO2 改性LiNi0.8Co0.1Mn0.1O2正极材料及其电化学性能
2023-06-11朱明原刘文博李文献张久俊
朱明原, 刘文博, 李 瑛, 刘 杨, 李文献, 张久俊
(1. 上海大学材料科学与工程学院, 上海 200444; 2. 上海大学理学院可持续能源研究院, 上海 200444)
锂离子电池作为一种二次储能设备, 被广泛应用于便携式电子设备(手机、笔记本电脑等)和电动汽车. 为满足人们对高续航、高里程的需求, 需要发展高能量密度的锂离子电池. 正极材料作为锂离子电池的重要组成部分, 对电池的性能至关重要. 因此, 为了实现锂离子电池的高能量密度, 开发高容量正极材料起到了决定性的作用.
高镍三元层状材料LiNi0.8Co0.1Mn0.1O2(NCM811)因具有较低的成本、简单的合成工艺、较高的能量密度而被广泛关注. 但同时, NCM811 也存在较多会影响其电化学性能的问题. 例如: Li+/Ni2+离子半径接近, 易发生阳离子混排, 导致材料表面发生相变(层状-尖晶石相-NiO岩盐相)[1-5]; 材料表面的残余锂接触空气会在表面生成LiOH/Li2CO3, 导致NCM811 表面的界面电阻较高[6-7]; 循环过程中电解液的副产物HF 对NCM811 的侵蚀会导致过渡金属离子的溶解[8-11].
已有研究表明, 表面包覆能有效改善材料的电化学性能, 包覆层可以有效阻碍材料与电解液的直接接触, 抑制过渡金属离子的溶解[12-13]. 本工作通过原子层沉积(atomic layer deposition, ALD)反应在NCM811 颗粒表面沉积了一层均匀的TiO2涂层, 并通过控制ALD反应的循环次数, 精确控制了沉积厚度[14]. 结果表明, 该方法可以明显改善NCM811 的电化学性能.
1 实 验
1.1 材料合成
本工作所使用的主要化学试剂有六水合硫酸镍(NiSO4·6H2O)、七水合硫酸钴(CoSO4·7H2O)、一水合硫酸锰(MnSO4·H2O)、氢氧化钠(NaOH)、氨水(NH3·H2O)、一水合氢氧化锂(LiOH·H2O). 以上试剂均为分析纯, 采购于中国医药集团上海化学试剂有限公司.
(1) 分别称取一定量的NiSO4·6H2O、CoSO4·7H2O、MnSO4· H2O, 按照摩尔比8∶1∶1混合. 加入去离子水配成总浓度为1 mol/L 的过渡金属离子盐溶液. 称取一定量的NaOH粉末(NaOH 为沉淀剂, 过渡金属离子与NaOH 的摩尔比为1∶2), 加入去离子水配成浓度为1 mol/L 的NaOH 溶液.
(2) 将过渡金属盐溶液以0.5 mL/min 的速率滴加到五口烧瓶中(五口烧瓶全程通入惰性气体, 底液为一定量的NH3·H2O), 同时滴入预先配好的NaOH 溶液. 控制NaOH 的滴加速率,维持底液pH=11.0∼11.5.
(3) 待反应完全后, 在55◦C 下静置陈化12 h. 之后, 分别用去离子水和无水乙醇洗涤抽滤多次, 洗去硫酸盐溶液, 再置于真空干燥箱中80◦C 烘干24 h. 取出研磨, 得到Ni0.8Co0.1Mn0.1(OH)2前驱体.
(4) 按照摩尔比1∶1.05 称取一定量制备好的Ni0.8Co0.1Mn0.1(OH)2和LiOH·H2O, 充分研磨后放置于流动的氧气中480◦C 预烧结5 h, 再升温至800◦C 高温烧结15 h(升温速率为3◦C/min). 自然冷却, 研磨得到LiNi0.8Co0.1Mn0.1O2粉末, 记为NCM811.
(5) 取一定量制备好的NCM811 粉末平铺在洁净的铝合金U 形槽中, 盖上500 目的不锈钢筛网, 放入MNT-P-100-42 原子层沉积设备反应腔中. 设置Ti 源(四-二甲氨基钛, tetrakis dimethylamido titanium,TDMAT)进源时间150 ms,O 源(H2O)进源时间40 ms,前驱体源停留时间100 s, N2吹扫剩余反应物时间100 s, 反应腔壁温度为150◦C, 基底温度为200◦C. 设置沉积循环次数为40. 沉积结束后, 取出TiO2沉积的NCM811 正极材料, 记为NCM@TiO2.
1.2 电极片制备及电池组装
分别以制备好的NCM811 和NCM@TiO2为活性物质, 乙炔炭黑为导电剂, 聚偏二氟乙烯(polyvinylidene difluoride, PVDF)为黏结剂, 按照m(活性物质)∶m(导电剂)∶m(黏结剂)=8∶1∶1 的比例混合, 加入适量N-甲基吡咯烷酮(N-Methylpyrrolidone, NMP), 搅拌过夜至均匀, 再均匀涂在涂碳铝箔上. 涂覆后放入真空干燥箱中, 80◦C 真空干燥12 h. 待完全干燥后, 使用冲孔机将电极片裁成12 mm 直径的圆形极片, 收集待用.
本工作组装的是CR2016 型的扣式电池. 将制备的电极片作为正极, 锂片作为对电极,15 mm 泡沫镍网作为对电极集流体, LiPF6/EC-DEC+5%FEC(V(EC)∶V(DEC) =1∶1)作为电解液, 20 µm 聚乙烯(polyethylene, PE)作为隔膜.
1.3 材料表征
采用Bruker D8 Advance X 射线衍射(X-ray diffraction, XRD)仪测试样品的晶体结构,扫描范围是2θ = 10◦∼90◦, 扫描速率为4(◦)/min. 采用Nova NanoSEM 450 场发射扫描电子显微镜(scanning electron microscope, SEM)和Tecnai G2 F20 高分辨透射电子显微镜(high resolution transmission electron microscope, HRTEM)拍摄样品的微观形貌. 采用Thermo Scientific K-Alpha X射线光电子能谱(X-ray photoelectron spectroscopy, XPS)分析样品表面的化学信息.
1.4 电化学性能测试
采用CT-2001A 蓝电测试系统进行充放电循环性能测试, 电压窗口为2.8∼4.3 V. 采用上海辰华CHI660e 电化学工作站进行循环伏安(cyclic voltammetry, CV)测试, 用于分析电池循环过程中的氧化还原状态, 电压测试范围为2.8~4.5 V, 扫描速率为0.1 mV/s. 测量不同扫描速率(0.1、0.3、0.5、0.7、1.0 mV/s)的CV, 用于计算材料中锂离子的扩散系数
2 结果与讨论
图1 所示为NCM811 和NCM@TiO2的XRD 图谱. 两组样品都是六方层状α-NaFeO2结构, 属于R3m 空间群. 可以看出: (006)/(102)和(108)/(110)两组峰分裂均较为明显, 说明形成了较好的层状结构; 两组样品的衍射峰尖锐, TiO2沉积后无杂峰出现, 衍射峰也未发生偏移, 表明TiO2涂层没有影响NCM811 的晶体结构. 这可能是由于TiO2的含量较低, 且TiO2属于非晶态.
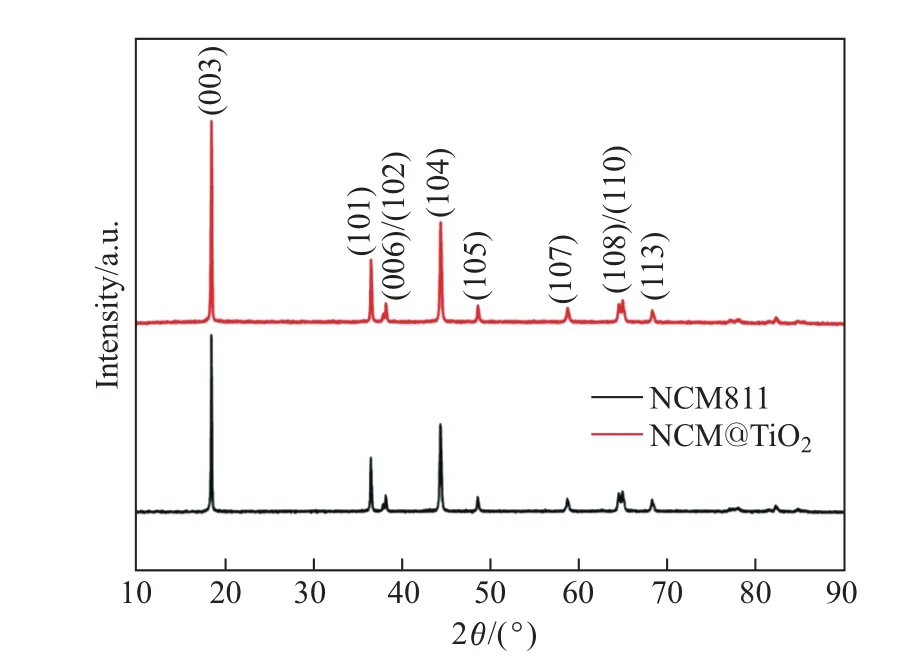
图1 NCM811 和NCM@TiO2 的XRD 衍射图谱Fig.1 XRD patterns of NCM811 and NCM@TiO2
(003)和(104)的峰强比可用于确定其阳离子混排的程度. 当比值小于1.2 时, 表明阳离子混合严重[15-16]. 由图1 可知: NCM811 和NCM@TiO2的峰强比均明显大于1.2, 说明所制备样品的阳离子混排问题较轻, 层状结构较稳定.
图2(a)∼(d)为采用SEM 对NCM811 和NCM@TiO2进行微观形貌表征的结果. 可以看到: 两组样品都是由300∼500 nm 的一次颗粒团聚堆积成的二次类球形颗粒, 粒径约为5 µm,且二者的形貌无明显区别. 这主要是因为经过ALD 反应沉积的TiO2包覆层的厚度极薄,SEM 的分辨率无法观测清楚.

图2 NCM811 和NCM@TiO2 的SEM 和TEM 图Fig.2 SEM and TEM images of NCM811 and NCM@TiO2
为进一步验证表面包覆层的存在, 对两组样品进行了TEM 表征分析, 结果如图2(e)和(f)示. 从图中可以清晰地看到包覆层的存在, 且涂层均匀, TiO2包覆层的厚度约为2.5 nm. 这种极薄的包覆层可以有效阻止电极材料在锂离子脱嵌过程中与具有腐蚀性的电解质直接接触, 避免了活性物质的溶解, 从而增强了材料的电化学循环稳定, 延长了循环周期的寿命.
通过ALD 反应, 采用TDMAT 和H2O 沉积超薄的TiO2包覆层. 将ALD 反应分为两个半反应[17-18], 即
图3 和方程式(1)、(2) 显示了TiO2的ALD 反应机理, 其中∗表示表面物质, 都是基团交换反应. 首先O 源(H2O)进入, H2O 中的—OH 吸附在NCM811 表面的活性位点. 然后当除去多余反应物后, Ti 源(TDMAT)进入, O—H 断裂, —Ti(N(CH3)2)3与吸附在NCM811 颗粒表面的—O 结合. 接着再一次除去多余反应物后, O 源进入, Ti—N(CH3)2键断裂, Ti 与—OH相连. 最后又一次除去多余反应物, 此为一个循环. 重复进行上述步骤可得到指定循环次数的原子层沉积TiO2样品, 即可通过控制循环次数精确控制沉积层的厚度. 本工作设置循环次数为40 次, 获得沉积层厚度为2.5 nm.

图3 TiO2 包覆的ALD 反应机理Fig.3 Reaction mechanism of TiO2 coating by ALD
为进一步验证表面化学组成,确定包覆层的成分,采用XPS 对NCM811 和NCM@TiO2进行分析,结果如图4 所示. 由图4(a)可见:NCM811 Ni 2p 拟合结果中有854.48、855.38、860.58、872.08、873.28 和878.88 eV 共6 个峰, 分别对应Ni2+2p3/2、Ni3+2p3/2、Ni 2p3/2卫星峰和Ni2+2p1/2、Ni3+2p1/2、Ni 2p1/2卫星峰. 由图4(c)可见:NCM@TiO2的Ni 2p 拟合结果中有854.78、855.38、860.68、872.18、873.38 和879.48 eV 共6 个峰. 这里Ni 的价态主要有Ni2+和Ni3+, 其中Ni2+易造成离子混排, 而TiO2的存在减少了Li/Ni 混排, 有利于材料的结构稳定性. 对比图4(a)和(c)可以看出, 相比于原始的NCM811, NCM@TiO2中的Ni2+含量更低、Ni3+含量更高. 图4(b)和(d)中NCM811 和NCM@TiO2O 1s 的XPS 拟合为2 个峰, 分别对应于样品的晶格氧和表面氧. 图4(e)中Co 2p 的峰分别位于779.78 和794.98 eV, 对应于Co3+2p33/2和Co3+2p1/2. 图4(f)中Mn 2p 的峰分别位于641.98 和653.88 eV, 对应于Mn4+2p3/2和Mn4+2p1/2. 图4(g)中Ti 2p3/2和Ti 2p1/2的中心结合能分别对应于458.48和464.18 eV. 这两个峰是由Ti4+引起的, 证明了TiO2存在于颗粒表面, 且Ti 2p 的峰形对称表明了TiO2可能是Ti 元素的唯一化学状态, 与文献[19-20]报道一致.

图4 NCM811 的Ni 2p、O 1s, NCM@TiO2 的Ni 2p、O 1s、Co 2p、Mn 2p、Ti 2p 的XPS 拟合图谱Fig.4 XPS fitting spectra of Ni 2p, O 1s of NCM811 and Ni 2p, O 1s, Co 2p, Mn 2p, Ti 2p of NCM@TiO2
NCM811 和NCM@TiO2的电化学测试性能如图5 所示, 其中恒流充放电测试均在2.8∼4.3 V 电压区间内进行. 由图5(a)可知, 在20 mA/g的电流密度下, NCM811 和NCM@TiO2的首次放电比容量分别为204.6 和210.5 mA·h/g, 二者的首次库伦效率分别为77.2% 和79.7%. 图5(b)所示为NCM811 和NCM@TiO2在100 次循环后的稳定性. 在100 mA/g 的电流密度下, 100 次循环后两组样品的容量保持率分别为77.9% 和87.6%,且NCM@TiO2的循环稳定性明显优于未包覆的NCM811. 图5(c)所示为NCM811 和NCM@TiO2在不同电流密度下的倍率性能. 尽管TiO2并不是良好的离子和电子导体,但NCM@TiO2同样表现出了更加突出的倍率性能, 尤其是在1 000 mA/g 的大电流密度下,NCM@TiO2的放电比容量为147.5 mA·h/g, 而相同电流密度下NCM811 的放电比容量仅为130.3 mA·h/g. 总的来说, 与未包覆的NCM811 相比, NCM@TiO2的放电比容量略有提升,说明通过ALD 反应沉积的超薄TiO2包覆层在一定程度上能够提高NCM811 的循环稳定性和倍率性能. 活性材料和电解质之间的直接接触会不可避免地导致电解质中少量HF 对活性材料产生侵蚀. 采用适当厚度的TiO2涂层对材料进行包覆改性, 可以在材料和电解质之间产生隔离, 并有效减少在循环过程中发生的副反应.

图5 NCM811 和NCM@TiO2 的首次充放电曲线、循环性能和倍率性能Fig.5 Initial charge and discharge curves、cycle performance and rate capacity of NCM811 and NCM@TiO2
CV 曲线可以反映电池的氧化还原过程, 包括电池的可逆循环和极化等. 图6(a)和(b)为NCM811 和NCM@TiO2组装电池后前两圈的CV 曲线, 电压区间为2.8∼4.5 V, 扫描速率为0.1 mV/s. 可以看出: 两组曲线在3.7∼4.0 V范围内的氧化还原峰主要对应于Ni2+/Ni4+, 说明ALD 反应形成的TiO2包覆层不会削弱NCM811 的电化学反应; 循环过程中样品发生了从层状结构(H1)向单斜晶相(M)以及其他2 个六角形相(H2 和H3)的相变.
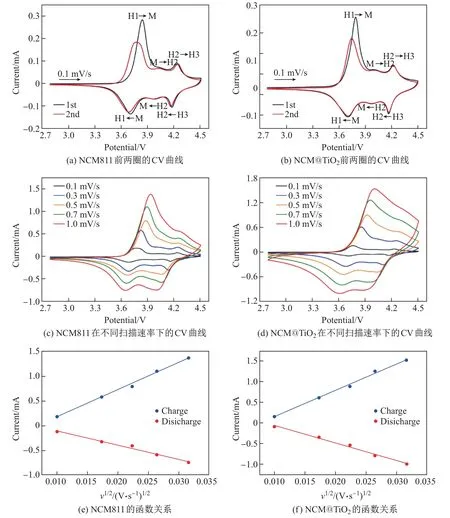
图6 NCM811 和NCM@TiO2 前两圈的CV 曲线、在不同扫描速率下的CV 曲线、峰值电流和扫描速率平方根的函数关系Fig.6 CV curves of the first two circles, CV curves at different scan rates, and peak currents as a function of the square root of scan rates for NCM811 and NCM@TiO2
峰的电位差(∆V)是锂离子嵌入/脱出可逆性的标志, ∆V 越小, 表示反应极化越小. 如表1所示, NCM811 前两圈的∆V 分别为0.135 和0.083 V, NCM@TiO2分别为0.086 和0.042 V,均明显低于NCM811. 这表明TiO2沉积后样品的电极极化效应变小, 证明了经TiO2沉积改性的电极材料的电化学反应的可逆性较高.
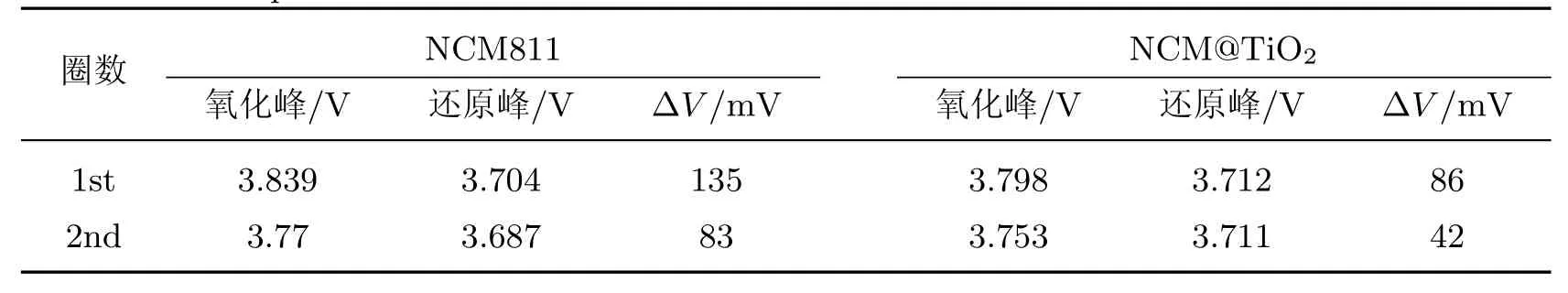
表1 NCM811 和NCM@TiO2 CV曲线的氧化峰和还原峰位置及电位差值Table 1 Position of oxidation and reduction peak of NCM811 and NCM@TiO2 CV curves and the potentia l difference
为了测试TiO2涂层对锂离子迁移动力学的影响, 拟合了NCM811 和NCM@TiO2在不同扫描速率(0.1∼1.0 mV/s)下的CV 曲线, 结果如图6(c)和(d)所示. 锂离子扩散系数可以根据Randles-Sevcik 公式[21]计算得到, 即
式中: n 是在电化学反应中转移的电子数(对于NCM811, n=1); A 是电极面积(cm2); D 是锂离子扩散系数(cm2/s); ∆C 是反应过程中的锂离子浓度; 峰值电流(IP)与扫描速率(v1/2)之间存在如图6(e)和(f)所示的线性关系.
表2 列出了线性拟合的斜率和计算得出的锂离子扩散系数. 计算结果表明, 在NCM@TiO2的充放电过程中, 锂离子的扩散系数分别为1.0×10−11和4.36×10−12cm2/s,明显大于NCM811. 这也解释了NCM@TiO2倍率性能提升的原因, 即虽然TiO2超薄包覆层会在一定程度上阻碍锂离子的传输, 但在循环过程中包覆层能够减缓NCM811 表面无电化学活性的物质产生, 减少副产物在NCM811 表面的堆积, 减小锂离子迁移受到的阻碍作用, 改善NCM811 界面处的锂离子扩散系数. 因此在循环过程中, 被TiO2包覆的活性材料表面的锂离子交换要比未包覆的NCM811 容易, 且在循环过程中TiO2与锂离子的反应性较强, 会部分形成LixTiO2界面[22], 有利于锂离子传输.

表2 NCM811 和NCM@TiO2 线性拟合的斜率及锂离子扩散系数Table 2 Slope of linear fitting between NCM811 and NCM@TiO2 and lithium ion diffusion coefficient
3 结束语
综上所述, 采用共沉淀法和ALD 反应制备了NCM@TiO2活性正极材料. 通过一系列表征测试, 证明了TiO2已成功沉积在NCM811 颗粒表面, 且经过TiO2修饰的NCM811 表现出了比原始NCM811 更优异的循环性能和倍率性能. 研究结果发现, 较薄且较为均匀的TiO2包覆层可以有效阻碍颗粒与电解液的直接接触, 抑制副反应的发生和电解质分解, 减轻表面结构转变, 从而在确保界面稳定的同时, 在材料表面提供离子通道, 以此提高电极材料的电化学性能. 本工作在电极材料的制备与改性处理等方面提供了一种新思路, 可大量用于电极材料开发与优化处理的基础研究.
