珠江口咸淡水池塘浮游动物群落结构特征及其影响因素
2023-06-11魏南陆尧李国栋孙凯峰
魏南 陆尧 李国栋 孙凯峰

摘要 [目的]研究河口浮游生物生態较少涉及的咸淡水池塘这一小型特殊生境。[方法]选取珠江口淇澳岛红树林保护区内一人工池塘作为研究对象,通过4年的月季调查,分析其物种组成、生物多样性、群落结构特征及其主要影响因素,为河口湿地生境的保护、恢复提供数据支撑。[结果]共发现浮游动物100种(不含浮游幼体),其中轮虫为绝对优势类群,具70种,平均丰度为467.3 个/L(17.0~1 924.0 个/L);群落结构分析可聚类为4个类群,且各类群之间都差异极显著(P<0.01),其差异主要由各类群的优势物种在月份间的丰度差异造成;各生物多样性指数[Margalef物种丰富度指数(D)、Pielou均匀度指数(J′)和ShannonWiener多样性指数(H′)]在类群间的总体差异均极显著(P<0.01);BEST/BIOENV和典范对应分析(CCA)都得出沉水植物(清塘导致沉水植物消失)、盐度、经济鱼类养殖活动等因素对浮游动物的群落结构影响显著,其中沉水植物消失影响最大。[结论]人为因素对淇澳岛咸淡水池塘生境的过度干扰,导致调查后期浮游动物物种多样性锐减,优势物种趋于单一化,群落结构已严重退化。
关键词 浮游动物;群落结构;咸淡水池塘;轮虫;沉水植物
中图分类号 Q958 文献标识码 A
文章编号 0517-6611(2023)10-0053-11
doi:10.3969/j.issn.0517-6611.2023.10.013
Abstract [Objective] Researches on estuarine zooplankton mainly focused on pelagic area,few papers on littoral small water bodies,such as estuarine ponds.[Method] In order to study this special habitat,an artificial brackishwater pond in the mangrove nature reserve on Qiao Island in the Pearl River Estuary was selected.The species composition,community structure characteristics and their main influencing factors were studied through four years of monthly sampling.[Result]100 species (excluding planktonic larva) were found in total,among which rotifer was the most dominant group,with 70 species recorded; the average total abundance was 467.3 ind./L,fluctuating between 17.0 ind./L and 1 924.0 ind/L.The zooplankton community was classified into four groups by the Nonparametric Multidimensional Scaling Analysis (NMDS),and the differences of structure between the groups were all significant (P<0.01).It was mainly caused by the differences in the abundance of dominant species between months in each group.Margalefs species richness index (D),Pielous species evenness index (J′) and Shannon-Wiener diversity index (H′) were all significantly different between groups (P<0.01).Both BEST/BIOENV and Canonical Correspondence Analysis (CCA) showed that submerged plants (the disappearance of submerged plants caused by mechanical cleaning of pond sediment),salinity,and economic fish aquaculture activities all had significant effects on zooplankton community structure,among which the disappearance of submerged plants had the greatest effect.[Conclusion]The excessive disturbance of the brackishwater pond on Qiao Island by human activities had led to a sharp decrease in zooplankton species diversity,the dominant species tended to be homogeneous and the community structure had been seriously degraded in the late stage of the survey.
Key words Zooplankton;Community structure;Brackishwater pond;Rotifer;Submerged plant
河口作为河流与海洋交汇区,受海、陆相互作用及人为干扰强烈,是环境变化的敏感区和生态系统的脆弱带,一直以来都是生态学领域研究的焦点之一[1-4]。浮游动物作为河口生态系统的关键类群之一,其动态变化控制着初级生产力的节律、规模和归宿,同时亦在水体营养盐循环和再生方面起重要作用,在河口生态系统结构、物流和能流中扮演重要角色[5-7]。其种类组成、丰度及生物量的时空变化都对河口生态系统结构、功能运转、渔业资源和环境产生影响[1,3-4]。因此,对河口浮游动物的生态学特征进行研究,具有十分重要的理论和实际意义。
珠江口是中国最具代表性的热带亚热带过渡性大型海岸带河口生态系统[8],其区域内的浮游动物调查已有相当积累,覆盖珠江8大口门[9-10]、伶仃水道[11]、潮间带[12]、河口及其近岸等区域[13-21],相关的研究主要集中在河口区的开阔水域,对其沿岸的一些小型湿地生境鲜有涉及,同时调查频次也较少,多为一年两次(旱季、雨季),缺少长期的动态监测。为获得河口区小型生境中浮游动物群落长期的调查数据,该研究选取珠江口珠海淇澳岛红树林自然保护区内一咸淡水池塘作为调查对象,展开了长达4年的月季跟踪调查。通过分析这一小型生境的浮游动物的群落结构组成及其动态变化,积累河口浮游生物群落的生态学数据,为河口湿地生态系统的保护、恢复提供基础数据。
1 材料与方法
1.1 研究区域及采样点概况 淇澳岛位于广东省珠海市唐家镇东北约2 km处,是珠江口西侧的一个小岛,海岛面积约24 km2(图1)。亚热带海洋季风气候,年均温23.1 ℃,温度范围12.6~32.0 ℃,年降水1 999.3 mm,雨季主要从4月到9月,潮汐属不正规半日潮[22]。岛上红树林保护区是珠海淇澳—担杆岛省级自然保护区的一部分,保护面积为5 103.77 hm2,其中红树林湿地面积419.03 hm2[22],主要位于西北部的大圍湾内。淇澳岛是目前珠江三角洲地区红树林分布最为集中、面积最大的地区[23],有丰富的物种资源,具重大的保护价值和科研价值。
该研究涉及的咸淡水池塘(113° 37′51.73″E,22° 25′ 40.03″N)位于淇澳岛的红树林保护区内,其形状为三角形,水深不超过1.5 m,下埋管道与潮沟相连,并受人为控制其水体交换,外侧潮沟水位亦由邻近闸口控制,因而池塘与外部水体交换相对较少。具体位置见图1。
调查前期咸淡水池塘受人为因素干扰相对较少,沿岸区域常年零星分布有狐尾藻(Myriophyllum verticillatum)。2008年8月至12月,狐尾藻生长迅速、大量增殖。为进行经济鱼类养殖,于2008年12月底进行了机械清塘(包括清理底泥、构筑塘坝,同时清理了泛滥的狐尾藻),后投放了较低密度的鱼类(主要为尼罗罗非鱼Oreochromis niloticus)。
1.2 样品采集与处理 浮游动物样品采集于2007年1月至2010年12月间,每月下旬采集1次,持续4年。浮游动物定量样品使用2.5 L有机玻璃在采样点重复采集2次混合,装入5 L的塑料桶,后立刻加入终浓度为4%的甲醛固定水样,带回实验室静置48 h后,去除水样上清液,浓缩至50 mL倒入80 mL透明小瓶内待镜检计数。定性样品使用25号浮游生物网(64 μm孔径)以“∞”型来回拖网5 min,分样2份,1份使用80 mL的透明小瓶收集,立刻用甲醛溶液固定,用于物种定性鉴定;1份不固定,使用500 mL的小瓶收集,加入适量原位样点水,带回实验室活体观察。
浮游动物镜检计数,首先将浓缩的固定样品摇匀,后吸取1 mL样品注入1 mL的Sedgewick-Rafter浮游生物计数框中,在光学显微镜(Nikon E800,日本)10倍镜下观察计数,重复计数至少2次,若2次计数结果偏差较大,增加计数次数,直至偏差控制在总个体数的±20%范围之内。若样品丰度较小,将样品浓缩至合适丰度后再进行计数,每份样品所计总个体数在200个以上,或者整个样品都要计数[24]。
1.3 物种鉴定 各浮游动物类群中,单卵巢类轮虫、浮游桡足类和枝角类鉴定到种水平,而固定后的蛭态类轮虫标本缩为一团,丢失了分类学特征,因而只进行计数。其他类群如底栖猛水蚤和浮游幼虫等也只鉴定到大类并计数。
桡足类物种鉴定主要参考《中国海洋浮游桡足类多样性》[25],枝角类鉴定主要参考《中国动物志 淡水枝角类》[26],轮虫鉴定主要参考《Rotatoria:Die Rdertiere Mitteleuropas》[27]。桡足类和枝脚类标本挑选和解剖在体视显微镜(舜宇SZ,宁波)下进行。
1.4 环境因子测定 现场环境指标水温(temperature)和盐度(salinity)测定与浮游动物采集同步进行,使用YSI 650水质分析仪测定。总氮(total nitrogen)和总磷(total phosphorus)水化学指标,采集500 mL表层水带回实验室分别测定。环境因子每2个月测定1次,具体采集和测定方法参考《海洋调查规范(GB/T 12763.4—2007)》[28]。
1.5 数据分析 该研究浮游动物群落生态数据使用PRIMER 6.1[29]和CANOCO 5.0[30]进行多元非参数统计分析。具体步骤为:丰度数据首先经log(x+1)对数转化,利用Bray-Curtis相似性方法构建相似性矩阵,后使用非参数多维尺度分析(non-metric multi-dimensional scaling,NMDS)方法进行排序分析,并根据分析结果划分类群,使用主坐标约束分析(constrained analysis of principal coordinates,CAP)对上述分组结果进行统计检验,并根据检验结果优化分组。利用相似性分析(analysis of similarity,ANOSIM)功能检验划分类群间的差异性,相似性百分比(similarity percentage analysis,SIMPER)分析构成各类群之间差异显著的主要物种及各物种的贡献率。环境因子数据首先经log(x+1)正态化转化并标准化处理,利用Euclidean距离方法构建相似性矩阵。使用REALTE功能检验群落结构数据矩阵与环境因子矩阵的相关性,后使用BEST/BIOENV进一步分析影响浮游动物群落结构最佳的环境因子组合,同时使用CANOCO 5.0的前向选择(step forward selection)进一步验证浮游动物群落结构与环境因子之间的关系,并使用典范对应分析(canonical correspondence analysis,CCA)序标分析可视化相关结果。优势种根据种的Mcnaughton优势度指数(Y)来确定[31],Y≥0.02的种类视为优势种。生物多样性指数使用Margalef物种丰富度指数(D)、Pielou均匀度指数(J′)和Shannon-Wiener多样性指数(H′)表示,并使用单因素方差分析(analysis of variance,ANOVA)检验各生物多样性指数分组的总体差异及两两分组之间的差异性。浮游动物丰度与理化因子的关系使用Pearson相关性进行分析。
2 结果与分析
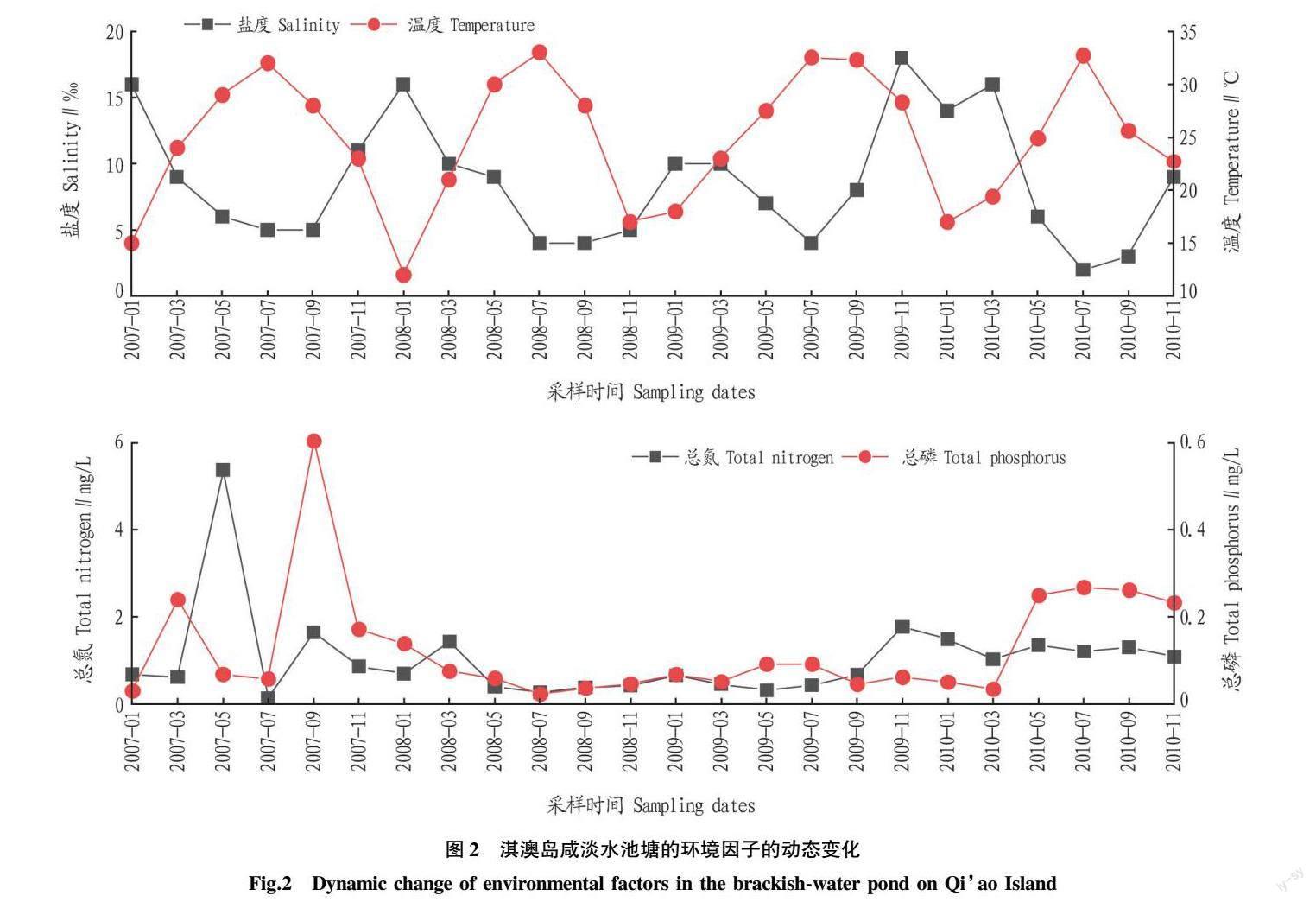
2.1 环境因子 珠江口淇澳岛咸淡水池塘各环境因子的变化见图2。盐度、温度、总氮和总磷的波动范围分别为2.0‰~18.0‰、12.0~32.5 ℃、0.13~5.38 mg/L和0.02~0.60 mg/L,其平均值分别为8.7‰、25.0 ℃、1.08 mg/L和0.13 mg/L。盐度和温度变化较有规律,呈季节性周期性变化,其中盐度冬季出现峰值,夏季出现最低值,而温度的变化趋势与盐度大致相反,夏季出现峰值,冬季出现最低值。总氮和总磷浓度没有明显的变化规律,总氮浓度最低值出现在2007年7月,最高值出现在2007年5月,2009年11月之后的月份浓度总体上相对较高;总磷最低值出现在2008年7月,最高值出现在2007年9月,2010年5月之后的月份浓度总体上相对较高。
2.2 种类组成 珠江口淇澳岛咸淡水池塘共鉴定到100种浮游动物和只能鉴定到大类的10类幼体或其他类群,分别为瓣鳃类幼虫、腹足类幼虫、多毛类幼虫、蔓足类幼虫、桡足幼体、鱼仔、长尾类幼虫、蛭态类、猛水蚤、水母。其中轮虫物种数最多,为70种,占总物种数的70.0%;其次为桡足类23种,占总物种数的23.0%;枝角类最少,为7种,占总物种数的7.0%。具体物种名录及其生态习性见表1。
4年浮游动物调查期间,各月份出现的物种数平均值为12种,物种数最多的月份为2008年的11月份,有28种;最少的为2009年9月,仅5种。总体来说,月份间物种数的变化没有明显规律,其中2007年1月、2008年8月、9月、10月、11月和2009年6月、7月和8月物种数相对较高,均大于16个物种,其他月份相对较低(图3)。
2.3 丰度
珠江口淇澳岛咸淡水池塘各浮游动物类群月份间丰度变化见图3。4年的浮游动物平均丰度为467.3 个/L,其中丰度最大值为1 924.0 个/L,出现于2010年5月,最小值为17.0 个/L,出现于2010年1月。2007—2010年各年份的平均豐度大小顺序为2007年550.9 个/L(77.5~1 475.0 个/L)>2008年523.2 个/L(52.0~1 785.0 个/L)>2010年448.5 个/L(17.0~1 924.0 个/L)>2009年335.6 个/L(34.5~860.0 个/L)。而从其各组成类群的平均丰度上来看,大小顺序为桡足类(包括其幼体)244.7 个/L(7.0~1 786.0 个/L)>轮虫191.9 个/L(0.5~1 106.0 个/L)>其他浮游幼体(除去桡足类幼体)30.4 个/L(1.5~270.0 个/L)>枝角类27.8 个/L(1.0~132.0 个/L)。
由各浮游动物类群丰度组成百分比(图4)可知,桡足类为绝大多数月份样品中的优势类群,其丰度百分比的平均值为53.8%,其中比例最高的为2007年10月,高达95.8%;其次为轮虫,其丰度百分比的平均值为37.1%,其中比例最高的为2010年8月,高达93.9%;丰度占比较少的为其他浮游幼体和枝角类,其丰度百分比的平均值分别为7.3%和1.8%。
通过计算咸淡水池塘浮游动物物种的优势度(Y≥0.02),可知优势物种有10种,分别为S.cf.kitina、圆型臂尾轮虫B. rotundiformis、环顶六腕轮虫Hexarthra fennica、角突臂尾轮虫Brachionus angularis、爱德里亚狭甲轮虫Colurella adriatica、披针纺锤水蚤A.southwelli、囊形腔轮虫Lecane bulla、史氏腔轮虫L.stenroosi、Synchaeta bicornis和奥贡中剑水蚤Mesocyclops ogunnus,具体优势度见表2。
RELATE相关性检验各年份间丰度矩阵的相似性,分析得出2007与2008年之间具有最高的相似性(ρ=0.463,P<0.01),其次为2009与2010年之间(ρ=0.434,P<0.01),最低的为2008年与2009年之间(ρ=0.314,0.01
2.4 群落结构聚类分析 淇澳岛咸淡水池塘浮游动物群落结构非参数多维尺度(NMDS)序标分析结果见图5,并根据CAP检验进一步优化聚类结果。结果显示,4年浮游动物群落样品可聚类划分为4个类群。根据聚类结果,使用SIMPER分析获得各类群的主要物种,同样通过计算各类群中物种的优势度(Y≥0.02),得出各类群的优势物种名录(表2),结果与SIMPER分析基本一致,因此以其主要物种(对群落丰度贡献度累加超过70%的物种)进行类群命名,具体结果如下:①类群a,斑纹腔轮虫Lecane punctata-爱德里亚狭甲轮虫-囊形腔轮虫-奥贡中剑水蚤-史氏腔轮虫-月形腔轮虫L.luna-尖趾腔轮虫L.closterocerca,该群落仅包括2008年的9、10、11和12月4个月份;②类群b,环顶六腕轮虫-圆型臂尾轮虫-角突臂尾轮虫-S.cf.kitina,该类群主要包括2007年至2010年间主要的夏季月份(6、7、8、9月);③类群c,披针纺锤水蚤-爱德里亚狭甲轮虫-Notholca sp.n-矮小拟镖剑水蚤Paracyclopina nana-壶状臂尾轮虫B. urceolaris,该类群主要包括除去类群a和类群b所含月份,2008年12月底咸淡水池塘清塘前,无水产养殖活动的月份;④类群d,S.cf.kitina-披针纺锤水蚤,该类群主要包括除去类群a和类群b所含月份,2008年12月底咸淡水池塘清塘后,进行经济鱼类养殖活动的月份。
ANOSIM(One-Way)检验咸淡水池塘浮游动物4个类群之间的差异性,结果表明各类群之间的总体差异较大(Global R=0.667,P<0.01),且两两类群之间的差异也都差异显著,其中类群a与其余3个类群之间的差异最大(类群a与类群d的R=0.991,P<0.01;类群a与类群c的R=0.930,P<0.01;类群a与类群b的R=0.862,P<0.01),其次为类群b与类群c和d之间的差异(类群b与类群d的R=0.641,P<0.01;类群b与 类群c的R=0.604,P<0.01),最小的为类群c和类群d之间的差异(R=0.557,P<0.01)。SIMPER进一步分析造成各类群之间差异的原因,其差异多由各类群的优势物种在月份间丰度的差异造成。如差异性最大的类群a和类群d,主要是类群a的优势物种(斑纹腔轮虫、爱德里亚狭甲轮虫、囊形腔轮虫、奥贡中剑水蚤、史氏腔轮虫、月形腔轮虫、尖趾腔轮虫)在类群d的相应月份丰度较低,而类群d的优势物种(S. cf.kitina、披针纺锤水蚤)在类群a的相应月份丰度较低。同理,差异性最小的类群c和类群d,主要由其相应类群的优势物种在不同月份丰度的差异造成,具体见表3。
2.5 生物多样性分析 ANOVA(One-Way)分析淇澳岛咸淡水池塘浮游动物3种多样性指数[Margalef物种丰富度指数(D)、Pielou均匀度指数(J′)和Shannon-Wiener多样性指数(H′)]在4个类群间的差异可知,3种多样性指数总体差异均显著(D,F=4.800,P<0.01;J′,F=3.535,0.01 2.6 群落結构与环境因子的相关性 RELATE/BIO-ENV分析浮游动物丰度矩阵与环境因子矩阵的相关性,得出二者具有较高的相关性(ρ=0.522,P<0.01)。BEST进一步分析影响浮游动物群落结构动态变化最大的环境因子组合,得出沉水植物(R=0.522)为影响浮游动物群落结构最大的因素,其次为盐度(R=0.182)和养殖活动(R=0.135),而其余因子的影响都相对较小(R<0.1)。同样,使用典范对应分析(canonical correspondence analysis,CCA)前向选择(step forward selection)的方法验证环境因子与浮游动物群落结构之间的相关性,沉水植物也为影响浮游动物群落结构最大的因素(pseudo-F=2.9,P<0.01),其次为盐度(pseudo-F=1.7,P<0.01)、总磷(pseudo-F=1.6,0.01 使用典范对应分析CCA重新分析浮游动物主要优势物种与前向选择的4个影响因子之间的相关性(pseudo-F=2.0,P<0.01),并构建序标图(图7),排序的所有特征值共解释了主要优势浮游动物群落结构变异程度的31.28%。由CCA序标图可知,主要物种多分布于图中3个区域,其中多数物种与沉水植物的爆发呈正相关,分布于图的右侧;一部分物种与盐度正相关,分布于图的左上方;另有少部分物种与养殖活动呈正相关,分布于图的左下侧(图7)。 3 结论与讨论 3.1 物种多样性及其生态类群 该研究珠江口淇澳岛咸淡水池塘共发现100种浮游动物,其中包括70种轮虫、23种桡足类、7种枝角类,以及未鉴定的浮游幼体等类群,与珠江口历史调查资料相比,轮虫超过了一向为优势类群的桡足类[4,9-20],为该次浮游动物调查的优势群体。主因珠江口海域浮游动物的研究多采用《海洋调查规范(GB/T 12763.6—2007)》[32]和《海洋监测规范(GB 17378.7—2007)》[33]所规定的具较大网孔的浅水Ⅰ型(网孔505 μm)或浅水Ⅱ型(网孔160 μm)网采集,导致体型相对较小的轮虫(体长一般为50~1 000 μm[34])多被大孔径的滤网滤过,致使仅少数研究涉及轮虫类群[9-10,12,15,21,35-36],且物种多相对较少,除Wei等[36]在淇澳岛另外区域开展的研究外,最高的为王庆等[35]对珠江口磨刀门浮游轮虫的研究为56种。Wang等[37]研究指出,使用64 μm孔径的浮游生物网过滤水样会导致90%的小型轮虫丢失,使用20 μm孔径的网过滤水样不会显著降低轮虫的丰度,采用直接沉淀法最能体现自然状态下的轮虫群落面貌,该研究采用直接沉淀的方法,能较为准确地反应咸淡水池塘浮游动物群落物种的组成。 根据浮游动物的生态习性和地理分布,珠江口区的浮游动物一般可划分为淡水生态类群、河口低盐生态类群、广温广盐生态类群、近岸暖水生态类群、外海暖水生态类群5个生态类群[13-14,17]。由于该研究采样点仅为半封闭的咸淡水池塘,相较于其他大范围开阔水域的调查,生态类别相对较少,主要为河口和淡水类群。调查到的23种桡足类和7种枝角类多为河口低盐种,另有少数淡水种出现于咸淡水池塘盐度较低的月份(表1)。 根据Fontaneto等[38-39]对全球生活在咸水生境中轮虫物种的统计,河口和海洋中生存的轮虫可分为咸水偶见种(haloxenous)、广盐种(euryhaline)和真正海水种(strictly haline)3个类群。该研究采集到的70种轮虫,多为广盐种和咸水偶见种,同时发现了15种真正海洋物种(表1),远高于该区域已有的相关研究[9-10,12,15,21,35],同时与国外其他河口轮虫的调查相比,真正海洋物种也相对较多,如Azémar等[40]对比利时Schelde河河口的调查,共发现52种轮虫,其中51种为淡水种,仅有1种为真正海洋种;Rougier等[41]对法属圭亚那的Kay河河口的轮虫调查,108种轮虫中只有4种为海洋种。 3.2 群落结构动态变化及其影响因素 由珠江口淇澳岛咸淡水池塘浮游动物NMDS分析(图5)和RELATE相关性检验各年份间丰度矩阵的相似性都可知,2008年12月底进行的机械清塘(沉水植物消失)及后续的经济鱼类养殖活动,严重影响了咸淡水池塘生态系统,其中人为因素导致的沉水植物消失是影响浮游动物群落结构的最大因素(R=0.522)。有较多的研究表明,沉水植物及其周丛生物是水生生态系统经典和碎食食物链的重要基础,亦是浮游动物提供产卵、孵化、育幼栖息地和躲避捕食的庇护场所[42],因而相较开阔水域,沉水植物区域更有利于形成较高生物多样性和丰度的群落[43-44]。且周丛生物的物种丰富度和丰度通常与沉水植物的结构有关,更复杂的结构,可提供更多种类的栖息地,以及更多数量或种类的食物[44-45]。该研究淇澳岛咸淡水池塘狐尾藻于2008年9月至12月期间大量存在,较高生物量的沉水植物孕育了相对较高物种多样性(图3、图6)和丰度(图3)的浮游动物群落(类群a),且其群落物种组成和群落结构显著有别于具少量或无沉水植物的月份(类群b、c、d)(图5)。类群a的主要物种(斑纹腔轮虫、爱德里亚狭甲轮虫、囊形腔轮虫、奥贡中剑水蚤、史氏腔轮虫、月形腔轮虫、尖趾腔轮虫)适应于沉水植物较多的生境(图7),多为底栖-悬垂生活(benthic-periphytic)的物种(表1),而类群b、c、d(少量或无沉水植物的月份)的主要物种多为浮游的物种(图7,表1),因而致使沉水植物为该研究最大的影响因素。 BEST和CCA分析都得出,另一人为因素——放养经济鱼类的养殖活动(R=0.135)亦为影响淇澳岛咸淡水池塘浮游动物群落结构的重要因素。较多的研究表明,鱼类可通过摄食直接影响其摄食生物的种群密度,并沿食物链下传,影响食物链的各个环节[46],也可通过自身代谢活动加速水体营养盐的循环,从而对浮游生物群落结构产生影响[47]。该研究淇澳岛咸淡水池塘清塘养殖经济鱼类后,优势种由4种(包括2种桡足类,类群c)退化为2种(包括1种桡足类,类群d),且绝对优势种转变为体型较小的S.cf.kitina,群落结构严重退化,各多样性指数显著下降(图6),这应该与鱼类的养殖活动密切相关。咸淡水池塘放养的罗非鱼,是以浮游生物为主的杂食性鱼类[48],其在幼鱼开口阶段以摄食小型浮游生物为主[49-50],随着幼体的发育逐渐具备视觉主动捕食能力,可捕食大型的枝角类和桡足类,而在发育阶段后期,则转为滤食为主的摄食方式[48,51]。由此可见,不同发育阶段的罗非鱼都可影响浮游动物的种类组成、体长分布等,从而表现在物种丰度、生物量及其群落结构的差异。 除了上述人为因素引起的影响之外,盐度亦为影响咸淡水池塘浮游动物群落结构的主要因素。Pearson相关性分析表明,咸淡水池塘盐度与浮游动物总丰度显著负相关(R=-0.384,P<0.05),此结果与Yuan等[21]对珠江口浮游动物群落结构的研究类似,盐度与轮虫、枝角类和总丰度显著负相关,为影响浮游动物多样性和丰度的主要理化因子。CCA序标图也得知,仅有少数主要物种与盐度正相关分布于图的左上方,大多数物种与盐度相关性不大,与盐度的垂线多接近于圆点(图7),这应与该研究获得的物种主要为河口种和淡水种有关,较高的盐度不适宜多数河口和淡水种的生存。一般来说物种都能耐受一定的盐度,但是不同的种类有其不同的盐度适宜性[38-39],从而限制了其时间与空间的分布。Egborge[52]研究了尼日利亚Lagos港口的Badagry小溪水体系统中的轮虫,认为随着盐度的增加,轮虫物种数逐渐降低,大多数种类出现在盐度低于1‰的水体。Fontaneto等[38]也指出全球仅有13.97%的轮虫物种可以生活于盐度超过1‰的盐水中。因此,盐度的月季变化影响了不同浮游动物物种在咸淡水池塘中的时间分布,从而显著影响了其群落结构的动态变化。 参考文献 [1]杨宇峰,王庆,陈菊芳,等.河口浮游动物生态学研究进展[J].生态学报,2006,26(2):576-585. [2] 郭沛涌,沈焕庭,刘阿成,等.长江河口浮游动物的种类组成、群落结构及多样性[J].生态学报,2003,23(5):892-900. [3] 李开枝,尹健强,黄良民.河口浮游动物生态学研究进展[J].海洋科学,2007,31(3):72-75. [4] 张达娟,闫启仑,王真良.典型河口浮游動物种类数及生物量变化趋势的研究[J].海洋与湖沼,2008,39(5):536-540. [5] LABUCE A,IKAUNIECE A,JURGENSONE I,et al.Environmental impacts on zooplankton functional diversity in brackish semienclosed gulf[J].Water,2021,13(14):1-19. [6] CONNELLY K A,ROLLWAGENBOLLENS G,BOLLENS S M.Seasonal and longitudinal variability of zooplankton assemblages along a riverdominated estuarine gradient[J].Estuar Coast Shelf Sci,2020,245:1-24. [7] HBERT M P,BEISNER B E,MARANGER R.Linking zooplankton communities to ecosystem functioning:Toward an effecttrait framework[J].J Plankton Res,2017,39(1):3-12. [8] 中国海湾志编纂委员会.中国海湾志:第十四分册(重要河口)[M].北京:海洋出版社,1998:1-799. [9] 高原,赖子尼,王超,等.珠江口浮游动物分布特征研究[J].中国水产科学,2008,15(2):260-268. [10] 高原,赖子尼,王超,等.2006年夏季珠江口浮游动物群落结构特征分析[J].南方水产,2008,4(1):10-15. [11] 刘玉,李适宇,吴仁海,等.珠江口伶仃水道浮游生物及底栖动物群落特征分析[J].中山大学学报(自然科学版),2001,40(S2):114-118. [12] ZHANG H G,CAI B S,ZHANG Z M,et al.Species diversity and distribution for zooplankton in the intertidal wetlands of the Pearl River estuary,China[J].Procedia Environ Sci,2012,13:2383-2393. [13] 李开枝,尹健强,黄良民,等.珠江口浮游动物的群落动态及数量变化[J].热带海洋学报,2005,24(5):60-68. [14] LI K Z,YIN J Q,HUANG L M,et al.Spatial and temporal variations of mesozooplankton in the Pearl River estuary,China[J].Estuar Coast Shelf Sci,2006,67(4):543-552. [15] TAN Y H,HUANG L M,CHEN Q C,et al.Seasonal variation in zooplankton composition and grazing impact on phytoplankton standing stock in the Pearl River estuary,China[J].Cont Shelf Res,2004,24(16):1949-1968. [16] 黄彬彬,郑淑娴,田丰歌.珠江口枯水期和丰水期中小型浮游动物群落动态[J].应用海洋学学报,2019,38(1):43-52. [17] 徐姗楠,龚玉艳,詹凤娉,等.珠江口海域南沙段浮游动物群落生态特征[J].海洋湖沼通报,2017(6):82-90. [18] 彭鹏飞,李绪录,蔡钰灿.珠江口万山群岛海域秋春季浮游动物的分布特征及其与环境因子的关系[J].安徽农业科学,2015,43(18):170-174. [19] 吴玲玲,朱艾嘉,郭娟,等.珠江口夏季中、小型浮游动物生态特征研究[J].海洋通报,2012,31(6):689-694. [20] 方宏达,朱艾嘉,董燕红,等.2005~2006年珠江口浮游动物群落变化研究[J].台湾海峡,2009,28(1):30-37. [21] YUAN D N,CHEN L D,LUAN L L,et al.Effect of salinity on the zooplankton community in the Pearl River estuary[J].J Ocean Univ China,2020,19(6):1389-1398. [22] WANG G,YU C X,SINGH M,et al.Community structure and ecosystem carbon stock dynamics along a chronosequence of mangrove plantations in China[J].Plant Soil,2021,464(1/2):605-620. [23] 叶翔,李靖,王爱军.珠江口淇澳岛滨海湿地沉积环境演化及其对人类活动的响应[J].海洋学报,2018,40(7):79-89. [24] HARRIS R P,WIEBE P H,LENZ J,et al.ICES zooplankton methodology manual[M].London UK:Academic Press,2000:1-684. [25] 连光山,王彦国,孙柔鑫,等.中国海洋浮游桡足类多样性[M].北京:海洋出版社,2018:1-835. [26] 蔣燮治,堵南山.中国动物志:节肢动物门 甲壳纲 淡水枝角类[M].北京:科学出版社,1979:1-295. [27] KOSTE W.Rotatoria:Die rdertiere mitteleuropas[M].Berlin,Stuttgart:Borntraeger,1978. [28] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.海洋监测规范 第4部分 海水分析:GB 17378.4—2007[S].北京:中国标准出版社,2007:1-162. [29] CLARKE K R,GORLEY R N.PRIMER v6:User manual/tutorial[M].Plymouth,UK:PRIMERE Ltd,2006:1-192. [30] MILAUER P,LEP J Multivariate analysis of ecological data using Canoco 5[M].2nd ed.Cambridge,USA:Cambridge University Press,2014:1-362. [31] MCNAUGHTON S J.Relationships among functional properties of Californian grassland[J].Nature,1967,216(5111):168-169. [32] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.海洋调查规范 第6部分 海洋生物调查:GB/T 12763.6—2007[S].北京:中国标准出版社,2007:1-159. [33] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.海洋监测规范 第7部分 近海污染生态调查和生物监测:GB 17378.7—2007[S].北京:中国标准出版社,2007:1-96. [34] WALLACE R L,SNELL T W,WALSH E J,et al.Phylum Rotifera[M]//Thorp and Covichs freshwater invertebrates.San Diego:Academic Press,2019:219-267. [35] 王庆,侯磊,陈实,等.珠江口磨刀门轮虫群落结构特征与水质生态学评价[J].生态环境学报,2014,23(5):824-833. [36] WEI N,XU R L.Distinct difference of littoral rotifer community structure in two mangrove wetlands of Qi′ao Island,Pearl River estuary,China[J].Zool Stud,2014,53(1):1-12. [37] WANG Q,YANG Y F,CHEN J F.Impact of environment on the spatiotemporal distribution of rotifers in the tidal Guangzhou segment of the Pearl River estuary,China[J].Int Rev Hydrobiol,2009,94(6):688-705. [38] FONTANETO D,DE SMET W H,RICCI C.Rotifers in saltwater environments,reevaluation of an inconspicuous taxon[J].J Mar Biol Assoc UK,2006,86(4):623-656. [39] FONTANETO D,DE SMET W H O,MELONE G.Identification key to the genera of marine rotifers worldwide[J].Meiofauna marina,2008,16:75-99. [40] AZMAR F,MARIS T,MIALET B,et al.Rotifers in the Schelde estuary (Belgium):A test of taxonomic relevance[J].J Plankton Res,2010,32(7):981-997. [41] ROUGIER C,POURRIOT R,LAMHOAI T,et al.Ecological patterns of the rotifer communities in the Kaw River estuary (French Guiana)[J].Estuar Coast Shelf Sci,2005,63(1/2):83-91. [42] CHOI J Y,JEONG K S,KIM S K,et al.Role of macrophytes as microhabitats for zooplankton community in lentic freshwater ecosystems of South Korea[J].Ecol Inform,2014,24:177-185. [43] ESPINOSARODRGUEZ C A,SARMA S S S,NANDINI S.Zooplankton community changes in relation to different macrophyte species:Effects of Egeria densa removal[J].Ecohydrol Hydrobiol,2021,21(1):153-163. [44] SON S H,KWON S J,IM J H,et al.Aquatic macrophytes determine the spatial distribution of invertebrates in a shallow reservoir[J].Water,2021,13(11):1-17. [45] DEOSTI S,DE FTIMA BOMFIM F,LANSACTHA F M,et al.Zooplankton taxonomic and functional structure is determined by macrophytes and fish predation in a Neotropical river[J].Hydrobiologia,2021,848(7):1475-1490. [46] LOMARTIRE S,MARQUES J C,GONCALVES A M M.The key role of zooplankton in ecosystem services:A perspective of interaction between zooplankton and fish recruitment[J].Ecol Indic,2021,129:1-8. [47] YU J L,XIA M L,ZHEN W,et al.Densitydependent effects of omnivorous bitterling (Acheilognathus macropterus) on nutrient and plankton communities:Implications for lake management and restoration[J].Hydrobiologia,2020,847(15):3309-3319. [48] VASCONCELOS F R,MENEZES R F,ATTAYDE J L.Effects of the Nile tilapia (Oreochromis niloticus L.) on the plankton community of a tropical reservoir during and after an algal bloom[J].Hydrobiologia,2018,817(1):393-401. [49] GROVER J J,OLLA B L,O′BRIEN M,et al.Food habits of Florida red tilapia fry in manured seawater pools in the Bahamas[J].Progr Fish Cultur,1989,51(3):152-156. [50] UFODIKE E B C,WADA R K.Feeding habits of tilapia,Sarotherodon nilotica (Perciformis:Cichlidae) fry in Jos,Nigeria[J].Rev Biol Trop,1991,39(2):189-192. [51] IBRAHIM A N A F,NOLL M S M C,VALENTI W C.Zooplankton capturing by Nile Tilapia,Oreochromis niloticus (Teleostei:Cichlidae) throughout post-larval development[J].Zoologia (Curitiba),2015,32(6):469-475. [52] EGBORGE A B M.Salinity and the distribution of rotifers in the Lagos HarbourBadagry Creek system,Nigeria[J].Hydrobiologia,1994,272(1):95-104.
