益生菌对万寿菊发酵品质及叶黄素含量的影响
2023-06-09甄莉娜刘丽珍朱晋纬潘登奎刘慧君
甄莉娜 刘丽珍 朱晋纬 潘登奎 刘慧君

摘要:万寿菊是提取叶黄素的天然原料,由于使用单一乳酸菌,发酵周期长,叶黄素损失量大,文章分别选用2种益生菌菌群(乳酸菌菌群、乳酸菌+芽孢杆菌菌群),采用2个接种量(2‰、5‰)发酵万寿菊鲜花,通过比较感官指标、温度、pH值、还原糖和叶黄素酯含量来研究益生菌对万寿菊鲜花发酵的影响。结果表明,发酵结束后,由乳酸菌发酵万寿菊的感官评价指标优于乳酸菌+芽孢杆菌菌群,乳酸菌对pH和还原糖含量的降低效果较好,5‰接种量发酵效果优于2‰。发酵57 h后,乳酸菌+芽孢杆菌菌群的发酵温度均高于乳酸菌,接种量越大,温度波动越小。5‰乳酸菌和2‰乳酸菌+芽孢杆菌菌群发酵万寿菊叶黄素酯含量保存效果较好。与常规万寿菊发酵效果相比,益生菌菌群发酵能够更好地缩短发酵周期,减少叶黄素酯的损失。
关键词:万寿菊发酵;乳酸菌;芽孢杆菌;叶黄素酯
中图分类号:TS201.3文献标志码:A 文章编号:1000-9973(2023)06-0195-04
Abstract: Tagetes erecta is a natural raw material for extracting lutein. Due to the long fermentation period and the large loss amount of lutein caused by using a single lactic acid bacterium, two probiotic bacteria floras (lactic acid bacteria flora, lactic acid bacteria+Bacillus flora) are selected in this paper, and two inoculation amounts (2‰,5‰) are used to ferment Tagetes erecta flowers. The effects of probiotics on fermentation of Tagetes erecta flowers are studied by comparing sensory indexes, temperature, pH value, reducing sugar and lutein ester content. The results show that the sensory evaluation indexes of Tagetes erecta fermented by lactic acid bacteria are better than those of Tagetes erecta fermented by lactic acid bacteria+Bacillus flora after fermentation, lactic acid bacteria have a better effect on reducing pH and reducing sugar content, and the fermentation effect of 5‰ inoculation amount is better than that of 2‰ inoculation amount. After 57 hours of fermentation, the fermentation temperature of lactic acid bacteria+Bacillus flora is higher than that of lactic acid bacteria, and the greater the inoculation amount, the smaller the temperature fluctuation. The content of lutein ester in Tagetes erecta fermented by 5‰ lactic acid bacteria and 2‰ lactic acid bacteria+Bacillus flora has a good preservation effect. Compared with conventional Tagetes erecta fermentation effect, fermentation by probiotic flora can better shorten the fermentation period and reduce the loss of lutein ester.
Key words: Tagetes erecta fermentation; lactic acid bacteria; Bacillus; lutein ester
收稿日期:2022-11-26
基金項目:国家自然科学基金项目(31400479);山西省应用基础研究计划项目(201801D121258,201901D111306);大同市平城区重点研发计划项目(202003);大同大学科研项目(2021CXZ7,202177)
作者简介:甄莉娜(1983—),女,副教授,博士,研究方向:微生物发酵、矿区生态修复。
*通信作者:刘慧君(1977-),男,副教授,博士,研究方向:动植物有效成分的提取、分离与检测。
叶黄素是一种天然色素,在万寿菊(Tagetes erecta)花中含量很高,占总类胡萝卜素的90%以上[1]。万寿菊花中含有叶黄素和6种叶黄素二酯,颜色越深,叶黄素酯的含量越高,色素含量与脂肪含量呈正相关[2]。
万寿菊的鲜花部分叶黄素含量最高[3],为了能较高程度地提取叶黄素,本试验采用万寿菊鲜花进行发酵。万寿菊提取叶黄素预处理工艺流程:鲜花采摘→保鲜发酵→去水干燥→粉碎造粒[4-6]。万寿菊鲜花中的化学成分主要有水、粗脂肪、灰分、粗蛋白、粗纤维、总糖等,其中,含量最高的是水(占48.15%),其次是总糖(占36.28%)[7]。发酵可以使万寿菊鲜花中结合状态的叶黄素变成游离状态,游离状态的叶黄素很容易被有机溶剂萃取出来[8];万寿菊鲜花中的水分直接影响叶黄素的提取,通过发酵可以尽可能地分离出鲜花中的水分,且花朵色泽仍保持鲜艳[9]。万寿菊鲜花中总糖占30%左右,通过乳酸菌等微生物的发酵可消耗菊花中的糖类,便于之后造粒;在发酵过程中,乳酸菌能很快生长增殖,从而产生很多乳酸和乙酸,这些产物既对有害菌有较强的抑制作用,同时也可以起到软化细胞壁的作用,便于后续叶黄素的提取;对万寿菊鲜花进行发酵处理,可以使万寿菊鲜花细胞壁破裂,使叶黄素更易被提取出来[10]。
本试验采用大同本地的万寿菊花进行发酵试验,通过设置不同的菌种类型、接种量和发酵温度,检测发酵过程中的温度、pH、还原糖含量和叶黄素酯含量,来探究使用益生菌对万寿菊发酵的适宜条件。在保证叶黄素含量和质量的前提下,使万寿菊尽可能地进行充分发酵,缩短发酵时间,提高发酵效率,便于后续叶黄素的提取与分离。
1 材料與方法
1.1 材料与设备
1.1.1 试验材料
于山西省大同县万寿菊种植基地采摘万寿菊鲜花作为试验材料。
1.1.2 供试菌种
发酵菌剂A:乳酸菌菌群(植物乳杆菌(Lactobacillus plantarum)、嗜酸乳杆菌(Lactobacillus acidophilus)、两岐双岐杆菌(Bifidobacterium bifidum)),发酵菌剂B:乳酸菌+芽孢杆菌菌群(枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)、凝结芽孢杆菌(Bacillus coagulans)、植物乳杆菌、嗜酸乳杆菌),菌剂A与菌剂B菌种均由各菌种等比例混合而成。发酵菌剂均由山西大同大学农学与生命科学学院微生物实验室分离筛选。
1.1.3 试验试剂
葡萄糖(生化试剂)、3,5-二硝基水杨酸、酒石酸钾钠、重蒸酚、亚硫酸钠、氢氧化钠:均为分析纯。
1.1.4 主要仪器设备
HPX-9272MBE恒温培养箱、9070MBE恒温鼓风干燥箱 上海博迅实业有限公司;C21-Simple 103电磁炉 美的集团;SP-723紫外可见分光光度计 上海光谱仪器有限公司;JH1102精度天平 上海精科天美科学仪器有限公司;DK-8D电热恒温水浴锅 常州市国旺仪器制造有限公司。
1.2 试验方法
1.2.1 万寿菊发酵试验
试验设置2种益生菌菌剂类型,分别为乳酸菌菌群(发酵剂A)和乳酸菌+芽孢杆菌菌群(发酵剂B),每种菌群各2个接种量(2‰、5‰),并设置空白对照组,共5个处理,每个处理重复3次,计算平均值。
分别称取新摘的万寿菊14 kg,放入塑料箱中,将2种菌剂分别溶于300 mL蒸馏水中,搅拌均匀,并将其分别接入万寿菊鲜花中,混合均匀。对照组倒入300 mL蒸馏水。15袋万寿菊均在27~30 ℃下培养。
1.2.2 pH测定方法
称取5 g发酵中的万寿菊花瓣,放入小烧杯中,再加入30 mL去离子水,搅拌1 min,放置5 min后,用校准后的笔式pH计进行测定并记录[11]。
1.2.3 温度测定方法
将两支温度计同时插入发酵中的万寿菊中部的不同位置,30 s后读数,取两支温度计读数的平均值,每隔5 h测定一次温度。
1.2.4 还原糖含量的测定
将万寿菊发酵过程中取得的样品烘干后,用粉碎机进行粉碎,发酵结束后测定还原糖的含量。本试验采用比色法,在540 nm波长处测定还原糖的含量[12]。
1.2.5 叶黄素酯含量的测定
取适量的提取物,按测定叶黄素含量的标准曲线制作方法,在443 nm处测其吸光度值,代入回归方程,求出提取物中叶黄素酯的含量[6]。
1.2.6 万寿菊发酵的感官评价
为了能比较直观地反映万寿菊花的发酵效果,对发酵结束万寿菊的质量优劣进行评定[13]。感官评价标准见表1。
2 结果与分析
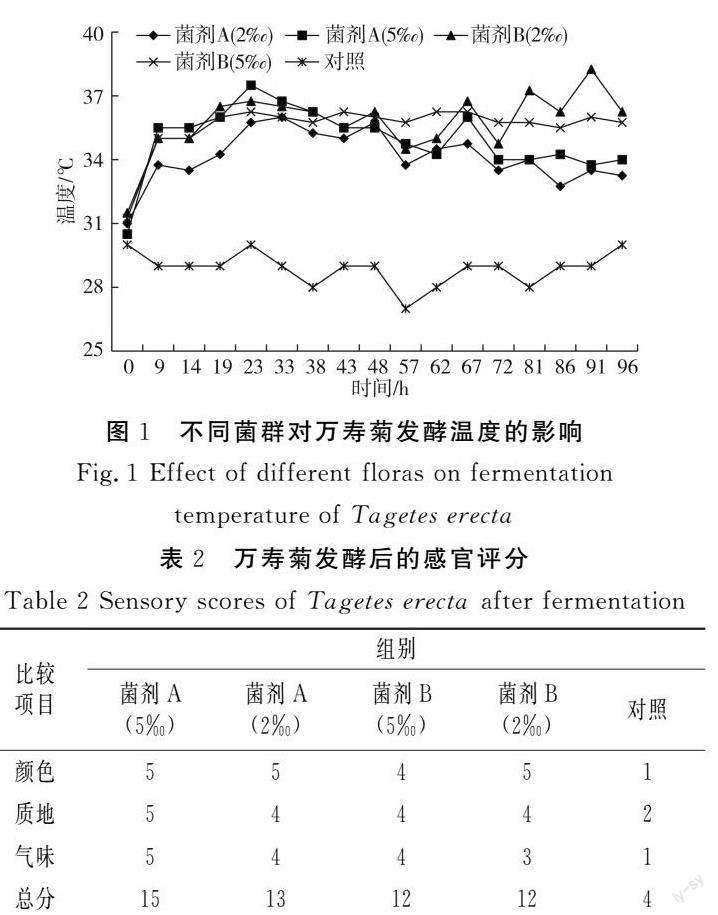
2.1 发酵过程中温度的变化
由图1可知,菌剂A的发酵温度表现出先升高后降低的趋势,5‰和2‰添加量在发酵23 h和33 h时达到高峰,均高于36 ℃;菌剂B的发酵温度波动较大,经历了2个高峰期,发酵后期温度较高,5‰水平在发酵23 h和67 h时分别达到37.5 ℃和36 ℃,5‰水平在发酵19 h和62 h时达到第2个高峰期,均为36 ℃。
2.2 万寿菊发酵后的感官评分
发酵结束后,对万寿菊进行感官评价,结果见表2。
用乳酸菌菌群(菌剂A)发酵的处理组与用乳酸菌+芽孢杆菌菌群(菌剂B)发酵的处理组相比,其颜色、质地、气味更好;乳酸菌接种量为5‰时发酵效果更好。对照组发酵过程中花色变暗褐色,腐烂变质。
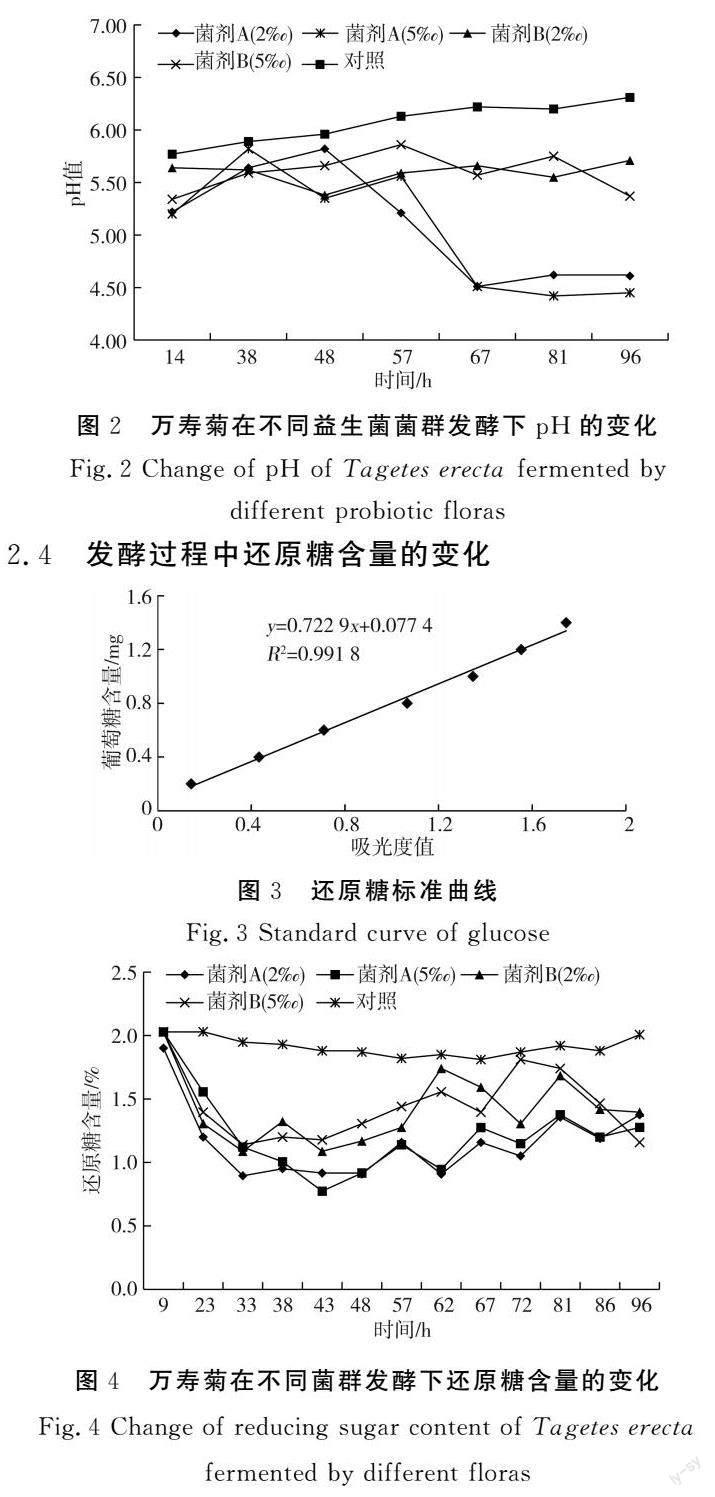
2.3 发酵过程中pH值的变化
万寿菊发酵过程中pH的变化见图2。与对照相比,菌剂A发酵万寿菊pH值显著降低(P<0.05),在发酵55 h左右下降幅度最大,2种添加量在发酵结束后pH值相近;菌剂B(乳酸菌+芽孢杆菌菌群)发酵的万寿菊,芽孢杆菌占主导地位,在发酵过程中pH虽然有所下降,但变化幅度不大,均低于对照组。乳酸菌将植物组织中可溶性的碳水化合物转化成有机酸,短时间内降低了pH值,抑制了其他杂菌的生长[14]。
由图4可知,还原糖含量表现出先降低后升高的趋势,且在整个发酵过程中,均低于空白对照组。在发酵前33 h内,2种益生菌菌剂均使万寿菊还原糖含量骤降,菌剂A(乳酸菌菌群)的还原糖含量低于菌剂B(乳酸菌+芽孢杆菌菌群)。万寿菊发酵过程中还原糖含量与温度变化成反比。发酵前期,乳酸菌对还原糖的降解量高于芽孢杆菌,可能是由于乳酸菌在发酵初期快速消耗糖类化合物转化成乳酸等物质[14]。芽孢杆菌的抗逆性强,在厌氧和好氧条件下均能生长繁殖,能够产生蛋白酶、脂肪酶等水解酶,芽孢杆菌在后期对还原糖增加幅度较大,可能是芽孢杆菌产生纤维素酶,降解万寿菊中的纤维素转化成糖类所致[15]。有研究发现乳酸菌+芽孢杆菌发酵玉米秸秆,使还原糖含量提高了3倍[16]。
2.5 发酵过程中叶黄素酯含量的变化
由图6可知,在菌剂A和菌剂B的2个添加量发酵50 h之后,叶黄素酯的含量均达到最低,与鲜花相比,乳酸菌菌群和乳酸菌+芽孢杆菌菌群万寿菊花干粉损失叶黄素酯量分别是5~6 mg/g和4~5 mg/g。发酵后期,随着鲜花中水分的散失,发酵花中叶黄素酯的含量不断增加,叶黄素酯含量的升高可能是发酵过程中水分的消耗与蒸发以及营养物质被大量分解利用,使得叶黄素酯的相对含量升高[17]。对万寿菊进行发酵处理时,为使万寿菊花的颜色保持鲜艳,发酵时间仍应在50 h以内,此时的糖含量较低,便于后续的造粒工艺且叶黄素酯的损失较少;相同条件下,乳酸菌的接种量越大,发酵速度越快。
3 小结
试验选用2种不同的益生菌菌群,在不同接种量下对万寿菊鲜花进行发酵,通过观察不同处理组的颜色、气味和测量发酵过程中的温度、pH以及还原糖含量等指标来获得万寿菊發酵的适宜条件。结果发现,由乳酸菌发酵万寿菊的感官评价指标优于乳酸菌+芽孢杆菌,乳酸菌对pH和还原糖含量的降低效果较好,5‰接种量发酵效果优于2‰。发酵57 h后,乳酸菌+芽孢杆菌菌群的发酵温度均高于乳酸菌,接种量越大温度波动越小。5‰乳酸菌和2‰乳酸菌+芽孢杆菌菌群发酵万寿菊叶黄素酯含量保存效果较好。与常规万寿菊发酵相比,益生菌菌群发酵能够缩短发酵周期,减少叶黄素的损失。结合感官评价指标分析,要保持万寿菊花的颜色鲜艳,发酵时间应在2 d以内,若发酵时间过长则易导致万寿菊花色变化,从而影响叶黄素酯的提取。
参考文献:
[1]QUACKENBUCH F W.Use of heat to saponify xanthophyll esters and speed analysis for carotenoids in feed material: collaborative study[J].Journal of Association of Official Analytical Chemists,1973,56:748-753.
[2]孟丽,赵文军.万寿菊干花中叶黄素酯的超声提取工艺研究[J].食品工业科技,2009,30(3):270-271.
[3]李凤伟,刘丽娜.万寿菊花中叶黄素提取工艺的优化[J].湖北农业科学,2012,51(18):4094-4096.
[4]张志强,凡前峰,李佳佳,等.万寿菊叶黄素的提取与皂化条件的研究[J].青海大学学报(自然科学版),2013,31(5):39-43.
[5]王琦,高彦祥,刘璇.动态夹带剂强化超临界CO2萃取万寿菊中叶黄素[J].中国调味品,2008(7):30-33.
[6]吴红艳,安琪,李秀鑫,等.葵花籽油微乳液对万寿菊中叶黄素提取工艺优化[J].中国调味品,2021,46(9):161-165.
[7]周曦,付娟娟,殷建忠.万寿菊化学成分及其应用的研究进展[J].国外医学(医学地理分册),2011,32(1):51-52.
[8]道达·萨达·阿巴,于锋,周芸.利用干发酵方法处理废弃物[J].沈阳化工大学学报,2014,28(2):184-192.
[9]张志强,刘进风,吕伶俐,等.万寿菊叶黄素的提取与皂化工艺研究[J].中国食品添加剂,2011(4):97-101.
[10]孙丹丹,陶正国,吴秀丽.一株用于青贮万寿菊的植物乳杆菌的分离、鉴定及发酵工艺研究[J].广东饲料,2013,22(7):18-21.
[11]梁宝玲,郎海洋,呼和.酸度计的校准与使用[J].内蒙古科技与经济,2013(1):96-97.
[12]江龙发.干红葡萄酒中总糖快速测定技术研究[D].南昌:南昌大学,2015.
[13]吴兴壮,张华,王小鹤,等.万寿菊鲜花乳酸菌发酵技术研究[J].农业科技与装备,2011(11):30-31.
[14]马媛,耿伟涛,王金菊,等.乳酸菌代谢与食品风味物质的形成[J].中国调味品,2019,44(1):159-163.
[15]侯星,易弋,张兴猛,等.发酵食品中微生物的功能特性[J].中国调味品,2019,44(1):191-194.
[16]王巍杰,常丽新,田亚红.枯草芽孢杆菌和乳酸菌混合发酵玉米秸秆制备饲料的工艺研究[J].饲料工业,2014,35(5):35-37.
[17]吴兴壮,张华,王小鹤,等.制备万寿菊叶黄素技术研究进展[J].食品工业科技,2012,33(6):456-459.
