低盐泡菜制作工艺优化
2023-06-09刘祯珍贾倩雯李田田周姝静迟乃玉张庆芳
刘祯珍 贾倩雯 李田田 周姝静 迟乃玉 张庆芳


摘要:为探究低盐泡菜的最佳制作工艺,对盐浓度为0%、2%、4%的3种泡菜发酵过程中pH、总酸、还原糖、可溶性固形物、亚硝酸盐等理化指标进行追踪检测,感官评判泡菜产品的品质,采用高通量技术进行菌群分析。结果表明,不同盐浓度的泡菜发酵过程中总酸、可溶性固形物、亚硝酸盐含量均有差异。发酵第9天时,不同盐浓度的泡菜的pH均达到3.6左右,亚硝酸盐含量均不超过6.0 mg/L,无盐泡菜的总酸、还原糖含量最高,分别达2.73 g/dL和2.80 mmol/L,4%盐浓度的泡菜的可溶性固形物含量最高,达11.05%。对不同时间下3种盐浓度的泡菜进行评定,发现发酵30 d、4%盐浓度的泡菜产品评价最好。细菌多样性分析结果表明,乳酸菌(Lactobacillus,10.09%)、明串珠菌(Leuconostoc,4.29%)等菌群占绝对优势。
关键词:低盐;泡菜;感官评价;制作工艺优化
中图分类号:TS255.54文献标志码:A 文章编号:1000-9973(2023)06-0132-06
Abstract: In order to explore the best production process of low-salt pickles, pH, total acid, reducing sugar, soluble solids, nitrite and other physicochemical indexes of three kinds of pickles with salt concentration of 0%, 2%, 4% during the fermentation are traced and detected, and then the quality of pickle products is evaluated by sensory evaluation, and high throughput technology is used to analyze the microflora. The results show that the content of total acid, soluble solids and nitrite in pickles during fermentation is different with different salt concentrations. On the 9th day of fermentation, the pH of pickles with different salt concentrations is all about 3.6, and the nitrite content is all less than 6.0 mg/L. The content of total acid and reducing sugar of pickles without salt is the highest, reaching 2.73 g/dL and 2.80 mmol/L respectively. The content of soluble solids of pickles with 4% salt concentration is the highest of 11.05%. The three kinds of pickles with different salt concentrations are evaluated at different time, and it is found that the pickle products fermented for 30 days with 4% salt concentration have the best evaluation.The results of bacterial diversity analysis show that Lactobacillus (10.09%) and Leuconostoc (4.29%) are the dominant microflora.
Key words: low salt; pickle; sensory evaluation; optimization of production process
收稿日期:2022-12-24
基金項目:国家重点研发计划(2018YFC0311100);辽宁省自然科学基金(2014020134)
作者简介:刘祯珍(1999-),女,硕士研究生,研究方向:微生物与发酵工程。
*通信作者:张庆芳(1965-),女,教授,博士,研究方向:微生物资源开发与利用。
我国泡菜历史悠久,具有“爽、脆、咸、鲜”的特色。其以蔬菜为原料,利用微生物在高盐卤水中进行厌氧或兼性厌氧发酵而成,成品中含有丰富的有机酸、维生素、膳食纤维、氨基酸及益生菌[1]。
有研究表明[2-3],泡菜含有大量的乳酸菌,乳酸菌发酵除了可将原料中的糖类、蛋白质、脂肪等大分子物质转变成更易吸收的小分子物质如氨基酸和脂肪肽以外,还可合成多种维生素来提高泡菜中的有效营养成分。适当食用泡菜不但能补充人体多种膳食纤维和微量元素,而且能有效改善机体胃肠道功能,预防胆固醇等多种疾病[4]。在泡菜加工过程中,影响泡菜品质的因素众多。大多数学者对泡菜发酵工艺的研究主要集中在发酵菌种的选择和配比、温度、配方和香辛料等方面,但随着研究的进行,盐作为发酵蔬菜中必备的原料,其对泡菜品质的影响逐渐受到学者们的关注[5-10]。传统泡菜腌渍多使用高盐食盐水(10%~20%),如处理不当不但在后期处理时会给环境带来极大负担,而且人体过多摄入盐分还会造成高血压、肾功能受损等不良后果[11]。欧雪等[12]探究了不同盐浓度(2%、5%、8%)对接种萝卜泡菜的影响,发现盐浓度越高,泡菜的硬度和脆度降低速率越缓慢,盐度过低会导致泡菜酸软。Xiong等[13]探究了盐浓度对中国传统酸菜发酵的影响,发现发酵前期盐浓度的影响较大,盐浓度过高会抑制乳酸菌繁殖代谢,延缓酸菜的成熟进程。因此,探究泡菜的食盐添加量对优化泡菜工艺、提高泡菜品质具有重要意义。除此之外,现在泡菜多是家庭作坊式生产,腌制手法不当易导致亚硝酸盐含量超标。亚硝酸盐作为一级致癌物亚硝胺的前体物质,摄入过量会导致机体患癌概率增高[14]。
为探究低盐泡菜的最佳制作工艺,本实验利用自然发酵技术发酵混合型泡菜,探究不同低盐浓度泡菜的pH、总酸、可溶性固形物、还原糖、亚硝酸盐等多项理化指标的变化趋势,再结合感官评价评判泡菜产品的品质,并利用高通量技术对其进行微生物菌群分析,以期为泡菜腌制过程中盐浓度的选择以及泡菜产品品质的改良提供理论参考,为符合人们健康饮食理念的低盐泡菜提供了相应的理论支持。
1 材料和方法
1.1 材料
圆白菜、白萝卜、胡萝卜、黄瓜、地环、洋姜、食盐(氯化钠):市售。
1.2 试剂
亚铁氰化钾、乙酸锌、基准邻苯二甲酸氢钾、硼酸钠、氢氧化钠、对氨基苯磺酸、盐酸、盐酸萘乙二胺、亚硝酸盐(均为分析纯):天津市科密欧化学试剂有限公司;葡萄糖、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid, DNS)、氯化钠、四水酒石酸钾钠(均为分析纯):国药集团化学试剂有限公司。
1.3 主要仪器与设备
PH828 pH计 希玛仪器仪表有限公司;BioTek Synergy HTX多功能酶标仪 美国伯腾仪器有限公司;TD10WZS手持式折射仪 研朗科学仪器(上海)有限公司;DW-86L500 -86 ℃超低温冷柜 澳柯玛(AUCMA)股份有限公司;电子天平 上海佑科仪器仪表有限公司。
1.4 方法
1.4.1 低盐泡菜的制作工艺
取无机械性损坏、无虫咬等的新鲜蔬菜,用无菌水冲洗,晾干后切成2~3 cm的小块放于灭菌后的泡菜坛子中,按0%、2%、4% 3种低盐浓度分别加入食盐,放置于室温(<20 ℃)下发酵,每天取15 mL发酵液进行分析,连续取样9 d,取样时先将泡菜轻轻摇匀,对样品进行理化指标检测并存样于-80 ℃用于后续实验。
1.4.2 理化指标分析检测
pH值的测定:从泡菜坛子底部取汁,用纱布过滤后,用pH计测量滤液;可溶性固形物含量的测定:从泡菜坛子底部取汁,采用手持式折射仪测定;亚硝酸盐含量的测定:按国家标准GB 5009.33-2010《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》测定;总酸含量的测定:按国家标准GB/T 12456-2008《食品中总酸的测定》测定;还原糖含量的测定:按国家标准GB/T 5009.7-2008《食品中还原糖的测定》测定。每组试验重复3次,取平均值。
1.4.3 感官评价
按照《中国泡菜的品质评定与标准探讨》[15]制定低盐泡菜的感官评定标准。感官评价标准见表1,各项目满分共计200分。
1.4.4 微生物菌群分析
本实验无菌过滤出低盐泡菜样品干物质60 g,再加入15 mL发酵液打成匀浆过滤,参照基因组试剂盒方法提取匀浆中DNA。以细菌16S rRNA的V4区域作为目标DNA序列进行PCR扩增。引物序列:515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。反应条件:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸40 s,25个循环;72 ℃延伸10 min。扩增结束后,PCR扩增产物使用2%琼脂糖进行凝胶电泳检测扩增效果。最后将检测合格的样品PCR产物送至北京诺禾致源科技股份有限公司,对产物进行纯化、定量和均一化,形成测序文库并用Illumina HiSeq 2500进行测序。
1.4.5 数据处理
每个实验组设置3个平行对照,数据结果取平均值。采用Excel 2010处理数据;采用Origin 2018绘图。
测序结果分析:采用GenBank 数据库(核酸序列数据库)、BLAST(序列局部比对工具)、Clustal X1.83(多序列比對工具)进行比对分析。
2 结果与分析
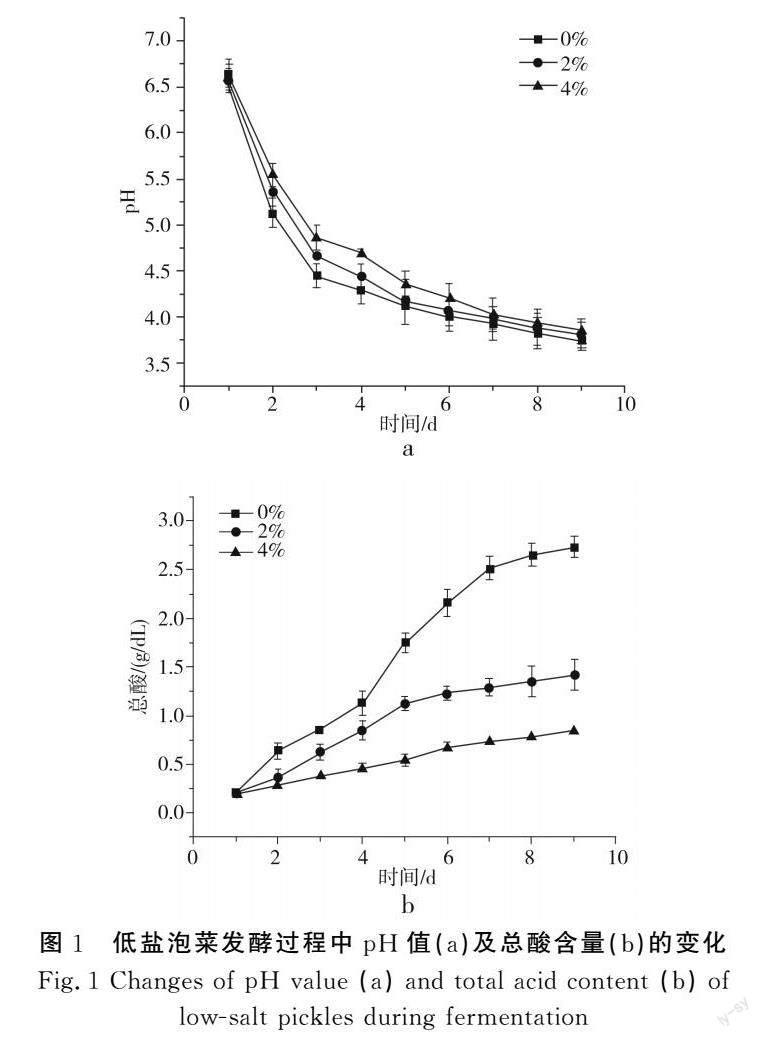
2.1 不同盐浓度对pH和总酸的影响
由图1中a可知,发酵起始,0%、2%、4% 3种不同盐浓度发酵液的pH值均在6.6左右;发酵前期,pH急剧下降,第3天发酵液的pH分别达到4.44,4.65,4.86;发酵中后期,发酵液的pH值下降趋势减缓,在第9天均达到3.6左右。0%、2%、4% 3种不同盐浓度中,食盐浓度越低,泡菜发酵液的pH值下降速度越快,但最终pH值差距不大。由图1中b可知,随着发酵时间的不断增加,总酸含量在发酵前中期迅速上升(未加盐组高于另外两组),第7天后开始趋于稳定。发酵起始,3组总酸含量均为0.25 g/dL,其中未加盐组发酵液的总酸含量上升趋势最快,第5天达到1.8 g/dL,第9天达到2.5 g/dL,远高于其他两组。而2%、4%盐浓度的发酵液总酸含量在第9天分别达到1.42 g/dL和0.83 g/dL。
通常乳酸菌在发酵前期大量繁殖代谢有机酸,pH急剧下降,当发酵液的pH值降低到一定程度后又会抑制乳酸菌的代谢繁殖,pH趋于平缓。发酵前期,0%盐浓度的发酵液与2%、4%盐浓度的发酵液相比,pH值下降速率和总酸含量上升速率较快,这可能与渗透压相关。大多数微生物细胞的渗透压为30.17~61.15 kN/m2,1%食盐溶液的渗透压大约在61.17 kN/m2,与微生物细胞的渗透压相近。因此,0%盐浓度的发酵液无法借助溶液渗透压来抑制微生物的生长代谢;而2%盐浓度所产生的渗透压可能略高于微生物细胞的渗透压,该盐浓度溶液渗透压可以一定程度抑制微生物的生长繁殖和产酸;4%盐浓度所产生的渗透压略高于2%盐浓度的渗透压,抑菌效果也好于2%盐浓度。申文熹等[9]研究发现,较高盐浓度会抑制部分乳酸菌如乳酸乳球菌和明串珠菌的生长代谢,减缓pH和总酸的变化趋势。值得注意的是,这两种菌是泡菜发酵过程中的重要菌种。发酵中后期,乳酸菌代谢乳酸等多种弱酸性物质使发酵液呈酸性,抑制有害微生物的生长,维持微生物菌落结构的稳定。随着溶液中pH值下降到4.0,不耐酸的异型乳酸菌逐渐被高耐酸、产酸能力强的同型乳酸菌所替代,3种不同盐浓度的泡菜总酸含量迅速增加,但较高盐浓度会影响乳酸菌的同型发酵,总酸含量始终与盐浓度成反比。欧雪等[12]在探究不同盐浓度(2%、5%、8%)接种萝卜泡菜的有机酸含量中发现,发酵过程中2%盐浓度组的乳酸、乙酸和苹果酸含量远高于其他两组,这也证实了微生物代谢会受到盐浓度的影响。
结合本实验发酵过程中测得的pH值和总酸变化趋势推测,一定盐浓度范围内,盐浓度越低,pH下降速率和总酸含量上升速率越快,高盐浓度可能会抑制乳酸菌的生长代谢,与低盐浓度相比,pH值更高,总酸生成量更低,泡菜盐水的盐浓度与总酸含量呈显著的负相关,这一推测和曹佳璐[16]的研究相佐证。
2.2 不同盐浓度对还原糖和可溶性固形物的影响
由图2中a可知,3组发酵液的还原糖含量随时间增加的趋势明显。发酵初期,所有发酵液中的还原糖含量较高,分别为22.33,14.20,8.80 g/L,从第2天开始,3组还原糖含量急剧下降,第4天后开始上下浮动但整体呈下降趋势,除第9天外,发酵过程中未加盐组的还原糖含量始终高于其他两组,第9天3组发酵液的还原糖含量基本都稳定在2.40 g/L左右。由图2中b可知,3组发酵液中可溶性固形物含量差异显著但整体呈上升趋势。其中4%盐浓度的发酵液可溶性固形物含量高,为4.5%,上升趋势最快,第8天达到11.05%,2%盐浓度次之,0%盐浓度最慢。发酵初始,0%和2%盐浓度的发酵液中可溶性固形物含量相差不大,在2.05%左右。发酵过程中2%盐浓度发酵液中可溶性固形物含量在第2天上升趋势明显,可达4.18%,后期趋势平缓,第8天达到5.82%;未加盐组发酵液中可溶性固形物含量上升趋势最平缓,第8天仅达2.71%。
发酵前期,可溶性固形物含量受盐浓度的影响很大。盐浓度改变引起卤水渗透压和泡菜内部水分活度的变化:盐度越高,泡菜内部水分活度越低,溶液中所含析出物质越多,原料自带微生物所能利用的物质也越多。根据蔬菜种类和品种的不同,所含维生素、氨基酸、糖类、微量元素、膳食纤维等营养物质和自带微生物都有所差别。发酵过程中糖类变化受诸多因素的影响:蔗糖可被肠膜明串珠菌中葡萄糖蔗糖酶和细菌或真菌中蔗糖水解酶水解成葡萄糖和果糖;葡萄糖作为微生物最常利用的还原糖,可通过己糖发酵途径生成乳酸、乙酸、乙醇和二氧化碳等多种物质,而果糖在果糖激酶或甘露醇脱氢酶的作用下被转化成己酸、乙酸等多种物质。
本实验发酵前期,发酵液的菌群丰度和物种丰度较低,原料中析出的还原糖量和生成的还原糖量之和大于消耗量,发酵液中还原糖含量上升;但随着发酵时间的延长,微生物大量繁殖,糖类消耗迅速,还原糖生成量远小于消耗量,发酵液中还原糖含量下降,第4天还原糖含量达到最低值;之后3组发酵液的酸度持续上升,霉菌、酵母菌等不耐酸微生物死亡,菌群开始演替,发酵液中还原糖含量也开始波动;随着耐酸性微生物如植物乳杆菌占据主导地位,菌群结构变得稳定,此外,乳酸菌代谢的乳酸等有机酸在发酵液中累积到一定程度后可能会反向抑制菌群代谢,进而导致蔗糖利用减慢,发酵液中还原糖含量最终趋于平稳。
2.3 不同盐浓度对亚硝酸盐的影响
由图3可知,发酵初期,0%、2%、4%盐浓度的发酵液中亚硝酸盐含量不断上升,起始含量分别为0.83,0.25,1.5 mg/L,分别在第7,4,4天达到亚硝峰(9.14,6.96,8.29 mg/L)。发酵前期,未加盐组泡菜的亚硝酸盐含量较低,发酵第3天开始急剧上升,第7天达到亚硝峰(9.14 mg/L),后期始终维持在一个较高水平,第9天亚硝酸盐含量为5.73 mg/L;2%盐浓度组泡菜整体亚硝酸盐含量偏低,第4天达到亚硝峰(6.96 mg/L)后开始下降,最终达到1.5 mg/L;4%盐浓度的泡菜前期亚硝酸盐含量高,第4天开始迅速下降,第7天开始略有波动,最终达到5 mg/L左右。我国GB 2762-2005《食品中污染物限量》中明文规定蔬菜及其制品腌渍蔬菜中所含亚硝酸盐的限量不得超过20 mg/kg,因此,3组实验中亚硝酸盐含量均符合国家标准。
亚硝酸盐和硝酸盐之间可以相互转化。大多有关蔬菜腌制的研究[17-18]都发现并证实了蔬菜腌制时期硝酸盐含量持续下降到较低水平,亚硝酸盐含量逐渐上升达到亚硝酸盐峰值后开始下降这一规律。硝酸盐作为自然界中最普遍存在的含氮化合物,可被植物储存在体内。泡菜自然发酵初期,pH值较高,乳酸菌等尚未成为优势菌群,肠杆菌、酵母菌等有害菌群此时占据优势,其中大肠杆菌、白喉棒状杆菌、金黄色葡萄球菌和黏质赛氏杆菌等革兰氏阴性好氧菌产生的硝酸还原酶都会导致大量亚硝酸盐产生[19]。摄入过多亚硝酸盐可能会引发高铁血红蛋白症,严重引起消化系统癌变。目前降解亚硝酸盐主要为微生物降解和酸降解:发酵液pH>4.5时,亚硝酸盐降解主要依靠植物乳杆菌、短乳杆菌、干酪乳杆菌鼠李糖亚种等[20-22]乳酸菌分泌的亚硝酸还原酶;随着发酵的进行,乳酸菌大量代谢乳酸,pH降到4.0以下以酸降解为主。
此外,食用過程中部分硝酸盐会被人体消化道中的硝酸还原菌转化为亚硝酸盐[23]。食物发酵时硝酸盐转化成亚硝酸盐越多,人体消化道细菌可利用硝酸盐越少,生成的亚硝酸盐越少,因此在发酵过程中尽可能将硝酸盐转为亚硝酸盐后再降解,可能更有利于人体安全。
2.4 感官评价
随机选择10位食品专业同学进行专业培训后组成感官评定小组对9种不同盐浓度、不同发酵时间的泡菜进行感官评价,对得到的感官数据进行处理,并从中选出评分较高的产品,评定结果见图4。
由图4和表2可知,发酵10 d的泡菜普遍评价不高,特别是滋味,但4%盐浓度的泡菜整体表现优于其他两种盐浓度。发酵20 d时,不同盐浓度的泡菜各项指标差异不大,但4%盐浓度的泡菜略逊一筹。发酵30 d后,不同盐浓度的感官评价出现较大差异,随着发酵时间的延长,颜色评价整体下降,但是其余3项评价均有所提升,其中4%盐浓度的泡菜整体评分最佳,2%盐浓度的泡菜整体评分和4%盐浓度的泡菜相近。
上述感官评分表明,发酵30 d、4%的泡菜和发酵30 d、2%的泡菜差异不显著。为在这二者之间选出最优产品,采取随机抽样调查。
由图5可知,选择4%盐浓度泡菜产品的人数最多,总占比达到63.34%,与2%盐浓度相比明显更受欢迎,最终确定发酵30 d、4%盐浓度的泡菜为终产品。
2.5 低盐泡菜微生物菌群分析
蔬菜发酵过程中理化指标尤其是亚硝酸盐的变化可能受到微生物的影响,而不同品种和不同产地的蔬菜本身自带的微生物种类和数量也有所差别[24-25]。利用Illumina HiSeq 2500技术对发酵30 d、4%盐浓度的泡菜(P1)进行16S rRNA测序。结果显示,低盐泡菜(P1)的原始细菌总序列为106 745条,去冗杂和优化数据后,最终总碱基数目为40 131 997 bp,序列总数为96 991条,平均长度为414 bp。
由表3可知,P1经过16S rRNA测序分析后,该产品已知分类细菌可归属到7个门、11个纲、23个目、38个科、58个属、157个种。
2.6 基于门水平低盐泡菜中的微生物群落
由图6可知,在门水平上,P1物种相对丰度大于0.1%的已知分类细菌门有蓝藻门(Cyanobacteria,55.80%)、变形菌门(Proteobacteria,29.53%)、厚壁菌门(Firmicutes,15.78%)。其中Cyanobacteria在门水平菌群中占据了绝对优势。钱杨等[26]对不同原料发酵的四川传统泡菜的微生物多样性解析发现,4种泡菜中主要门水平是厚壁菌门、变形菌门、拟杆菌门,但原料不同会导致同种微生物的相对丰度存在差异,这可能是与本研究存在一定差异的原因。
查阅相关文献发现[27],蓝藻细菌与叶绿体有较近的亲缘关系,叶绿体中有多种类型蓝藻细菌的部分基因组。基于此,推测P1中出现的蓝藻门细菌有以下两种原因:一是可能低盐泡菜的盐浓度过低,无法很好抑制杂菌生长;二是因为样品加入了过多的蔬菜,从而受到了蔬菜宿主基因组污染。
闫鸣霄等[28]分析探讨了泡菜发酵中影响大肠杆菌生长的因素,发现在一定盐浓度范围(1%~6%)内,高盐、高蒜浓度、低pH的发酵环境可以有效抑制大肠杆菌生长,这基本与本研究的发酵环境相同。查找P1蓝藻纲的相应基因序列并与GenBank数据库进行了BLAST比对佐证。通过Clustal X1.83软件进行多序列对比,结果见图7。其中P1所含大部分蓝藻基因与NCBI中叶绿体基因(NC_046879)相似度极高,最高可达100%。基于以上结果,推测可能是P1受到了宿主(混合蔬菜)基因组污染。因此,提取宿主中微生物DNA时如何有效避免宿主基因组干扰,是今后需攻克的难题。
2.7 基于属水平低盐泡菜中的微生物群落
由图8可知,在属水平上,P1中相对丰度大于0.1%的已知分类细菌属有叶绿体(Chloroplast,53.80%)、线粒体(Mitochondria,10.73%)、其他(Others,10.10%)、乳酸杆菌属(Lactobacillus,10.09%)、果胶杆菌属(Pectobacterium,4.42%)、明串珠菌属(Leuconostoc,4.29%)、沙雷氏菌属(Serratia,1.31%)、肠杆菌属(Enterobacter,1.16%)、乳球菌属(Lactococcus,1.02%)。
陈佩等[8]研究发现汉中地区泡菜水中细菌大多隶属于乳酸菌,平均含量>85%,产生差异的原因可能是本研究样本选取的主要成分是泡菜干物质。此外,结果表明,P1在属水平上没有相应蓝藻细菌属,取而代之的是叶绿体(Chloroplast),这佐证了笔者的推论,证实了终产品中蓝藻门细菌确实是叶绿体,这也和赵玲艳等[29]的推测相吻合。
3 结论
本研究对3种不同低盐混合型自然发酵泡菜发酵过程中理化指标进行监测,推测发酵前期蔬菜表面附着的微生物以蔬菜为原料进行发酵,需氧型微生物为主导消耗其中的还原糖和含氮化合物,亚硝酸盐逐步上升并在第4,5天达到亚硝峰。随着容器中氧气的消耗,兼性厌氧和厌氧乳酸菌逐渐占据上风并且开始产生乳酸,亚硝酸盐被乳酸菌等微生物和酸分解,含量下降最后趋于稳定,且低于国家标准。结合模糊感官评价,确定发酵30 d、4%盐浓度的自然发酵泡菜发酵制备工艺最佳。本研究对发酵30 d、4%盐浓度的低盐泡菜进行16S rRNA分析,发现乳酸菌属(Lactobacillus)占据绝对优势,证实了低盐泡菜开发的可行性。后续本课题组将继续探究不同低盐浓度混合型泡菜的风味物质和代谢产物,为之后开发新型低盐风味泡菜奠定了理论研究和小试基础。
参考文献:
[1]QIAN Y, ZHANG J, ZHOU X R, et al. Lactobacillus plantarum Cqpc11 isolated from Sichuan pickled cabbages antagonizes D-galactose-induced oxidation and aging in mice[J].Molecules,2018,23(11):1750-1754.
[2]RAGUL K, KANDASAMY S, DEVI P B, et al. Evaluation of functional properties of potential probiotic isolates from fermented brine pickle[J].Food Chemistry,2019,311:126-157.
[3]陳功.试论中国泡菜历史与发展[J].食品与发酵科技,2010,46(3):1-5.
[4]于新颖,刘文丽,殷杰,等.不同食盐浓度下白菜泡菜的乳酸菌数及理化指标变化[J].食品与发酵工业,2015,41(10):119-124.
[5]周艺萍,熊智,李选文,等.不同盐浓度对新平酸腌菜发酵过程的影响[J].中国调味品,2021,46(5):13-17.
[6]李军波.盐浓度对传统泡菜和强化发酵泡菜的影响[D].南昌:南昌大学,2016.
[7]赵虎威,陈燕飞,燕平梅.泡菜发酵中微生物的研究[J].中国调味品,2022,47(1):211-216.
[8]陈佩,刘莹,翟彩宁,等.基于高通量测序技术分析汉中地区泡菜水细菌多样性[J].中国酿造,2021,40(12):93-97.
[9]申文熹,陈功,唐垚,等.不同盐质量分数泡白菜发酵过程中乳酸菌群落结构的变化[J].食品科学,2017,38(10):104-110.
[10]黄道梅,胡露,贾秋思,等.多菌协同发酵萝卜过程中不同盐浓度对菌相的影响[J].食品与发酵工业,2016,42(6):36-43.
[11]李子未,封丽,许林季,等.酱腌菜加工废水处理技术综述[J].三峡生态环境监测,2019,4(4):57-64.
[12]欧雪,吴梦西,廖一漠,等.不同盐浓度对接种发酵萝卜泡菜品质的影响[J].四川农业大学学报,2022,40(3):438-448.
[13]XIONG T, LI J B, LIANG F, et al. Effects of salt concentration on Chinese sauerkraut fermentation[J].LWT-Food Science and Technology,2016,69:169-174.
[14]LIN X, TANG Y, HU Y, et al. Sodium reduction in traditional fermented foods:challenges, strategies, and perspectives[J].Journal of Agricultural and Food Chemistry,2021,69(29):8065-8080.
[15]陈功.中国泡菜的品质评定与标准探讨[J].食品工业科技,2009,214(2):335-338.
[16]曹佳璐.传统四川泡菜盐水乳酸菌多样性的研究[D].北京:中国农业大学,2017.
[17]姚荷,谭兴和,张春艳,等.发酵蔬菜中乳酸菌降解亚硝酸鹽的研究进展[J].中国酿造,2018,37(7):22-25.
[18]柳念,陈佩,高冰,等.乳酸菌降解亚硝酸盐的研究进展[J].食品科学,2017,38(7):290-295.
[19]YU Y Y, YU Y S, XU Z L. Evaluation of nitrite, ethyl carbamate, and biogenic amines in four types of fermented vegetables[J].Foods,2021,10(12):3150.
[20]王水泉,包艳,董喜梅,等.植物乳杆菌的生理功能及应用[J].中国农业科技导报,2010,12(4):49-55.
[21]张庆芳,迟乃玉,郑学仿,等.短乳杆菌(Lactobacillus brevis)去除亚硝酸盐的研究[J].微生物学通报,2004(2):55-60.
[22]王一茜,荣金诚,王晓辉,等.常见乳酸菌降解亚硝酸盐机理探讨[J].食品与发酵工业,2019,45(8):50-56.
[23]夏登胜,王松灵.唾液硝酸盐、亚硝酸盐代谢及其对人体影响的研究[J].北京口腔医学,2005,12(1):57-59.
[24]GUAN Q Q, ZHENG W D, TAO H, et al. Comparison of microbial communities and physiochemical characteristics of two traditionally fermented vegetables[J].Food Research International,2019,128(1):108-755.
[25]WANG Z X, SHAO Y Y. Effects of microbial diversity on nitrite concentration in pickles, a naturally fermented cabbage product from China[J].Food Microbiology,2017,72(1):185-192.
[26]钱杨,饶瑜,蒋云露,等.基于高通量测序技术分析不同蔬菜种类四川泡菜中微生物多样性[J].食品与发酵工业,2022(13):277-284.
[27]NAOKI S. Are cyanobacteria an ancestor of chloroplasts or just one of the gene donors for plants and algae?[J].Genes,2021,12(6):14-54.
[28]闫鸣霄,吴正云,司育雷,等.泡菜发酵中不同蒜浓度、pH和盐度组合对大肠杆菌生长影响的模拟研究[J].中国调味品,2019,44(9):44-46,54.
[29]赵玲艳,黄嘉欣,杨剑,等.盐渍辣椒细菌多样性分析[J].食品科学,2020,41(20):105-111.
