八角皂苷的提取及稳定性研究
2023-06-09郑燕菲蔡杰慧谭义秋韦凤韦海娟
郑燕菲 蔡杰慧 谭义秋 韦凤 韦海娟

摘要:文章以八角果实为研究对象,考察了超声波辅助法和加热回流法对八角果实中皂苷提取效果的影响,探讨了温度、氧化物、pH、金属离子、光照条件对八角皂苷稳定性的影响情况。结果表明,加热回流法提取八角皂苷比超声波辅助法提取效果好,超声波辅助法提取八角皂苷的得率为2.67%,加热回流法提取八角皂苷的得率达5.47%。温度和氧化物H2O2对八角皂苷的稳定性影响显著,金属离子对八角皂苷的稳定性有一定的影响;在生产、使用、存放时,八角皂苷在低温、pH为8、避光环境中稳定性更佳。该研究结果可为八角皂苷在天然药物和功能食品等领域中的开发利用提供理论参考。
关键词:八角;皂苷;提取;稳定性
中图分类号:TS201.2文献标志码:A 文章编号:1000-9973(2023)06-0096-04
Abstract: Taking star anise fruit as the research object, the effects of ultrasonic-assisted method and heating reflux method on the extraction effect of saponin from star anise fruit are investigated, and the effects of temperature, oxides, pH, metal ions and light conditions on the stability of star anise saponin are discussed. The results show that the extraction effect of saponin from star anise by heating reflux method is better than that by ultrasonic-assisted method. The yield of saponin from star anise extracted by ultrasonic-assisted method is 2.67%, while the yield of saponin from star anise extracted by heating reflux method reaches 5.47%. Temperature and oxide H2O2 have significant effects on the stability of star anise saponin, and metal ions have acertain effect on the stability of star anise saponin. During production, use and storage, star anise saponin has better stability at low temperature, pH 8 and dark environment. The research results could provide theoretical references for the development and utilization of saponin from star anise in the field of nature medicine and functional food.
Key words: star anise; saponin; extraction; stability
收稿日期:2022-12-11
基金項目:2020年广西自然科学基金项目(2020JJB120001);2021年广西高校中青年教师基础能力提升项目(2021KY0773);广西民族师范学院科研项目(2020YB011,2021YB038)
作者简介:郑燕菲(1987-),女,副教授,博士,研究方向:天然产物、功能食品的研究与开发。
*通信作者:谭义秋(1967-),男,教授,硕士,研究方向:天然高分子的改性及应用。
八角(star anise,Illicium verum Hook. f.),又名八角茴香,是在我国许多地区都有种植的芳香植物[1],广西八角的产量占全国的85%,占世界的70%,八角是广西地区最重要的经济树种之一[2]。八角既是食品中不可或缺的香辛料调味品,又可作为香精和药物的原料,其干燥成熟果实含有芳香油约5%~8%、脂肪油约22%,及黄酮、多酚、蛋白质、莽草酸等化学成分[3-5]。八角的有效成分是多种组分的混合物,具有抑菌、抗氧化、镇痛等多种生理功效[6-9]。皂苷是广泛存在于天然植物中的一种天然物质[10]。皂苷物质的研究是保健食品开发的重要方向,同时也是天然药物提取的重要途径,其在临床上有抗肿瘤、抗炎、抗氧化、降血糖、降血脂、降血压、增强免疫力等作用[11-14]。目前,对三七、人参、黄芪、红枣等植物中皂苷的研究[15-18]有很多,但对八角皂苷的提取及稳定性的研究鲜有报道。为了开发具有高附加值功能的八角产品,促进地区的经济发展和生态保护,本文以八角果实为研究对象,考察超声波辅助提取法和加热回流法对八角果实中皂苷得率的影响,探讨温度、氧化物、pH、金属离子、光照条件对八角皂苷稳定性的影响情况,结果为八角植物资源在医药品、食品中的开发利用和功能原料的发展提供了参考。
1 材料与方法
1.1 材料
八角干果:购于广西崇左市江洲区。将八角干果用粉碎机粉碎,过40目筛,于40~50 ℃烘箱内烘干,八角粉末用密封袋保存备用。
1.2 试剂
乙醇、香草醛、高氯酸、冰醋酸、浓硫酸、过氧化氢、乙酸酐、氢氧化钠、甲醇、氯化钾、无水氯化钙、三氯化铝、三氯化铁、氯化镁等:均为分析纯;实验用水均为蒸馏水。
1.3 仪器与设备
722型可见分光光度计 上海舜宇恒平科学仪器有限公司;SHZ-D Ⅲ型循环水式真空泵 河南予华仪器有限公司;DGX-9143BC-1型烘箱 上海福玛实验设备有限公司;KQ3200型超声波清洗器 昆山市超声仪器有限公司;AR224CN型电子分析天平 奥豪斯仪器(上海)有限公司;YP5102型电子天平 上海光正医疗仪器有限公司;HJ-3型恒温磁力搅拌器 金坛市易晨仪器制造有限公司;HH-S4型数显恒温水浴锅 金坛市医疗仪器厂;RE-3000B型旋转蒸发器 上海雅荣生化设备仪器有限公司。
1.4 实验方法
1.4.1 八角皂苷定量分析方法的建立
1.4.1.1 定量分析的原理
采用香草醛-硫酸法对八角皂苷的含量进行测定。原理为皂苷溶液与香草醛-冰醋酸、高氯酸溶液在加热条件下可显色,颜色的深浅与皂苷含量成比例关系,颜色越深,皂苷含量越多,颜色越浅,皂苷含量越少。根据物质的吸收光谱和光的吸收定律,利用香草醛-硫酸法对八角皂苷显色,在548 nm波长处进行吸光度检测[19],计算出皂苷的含量[20]。
1.4.1.2 标准曲线的绘制
分别准确移取0.00,1.00,2.00,3.00,4.00,5.00 mL质量浓度为0.007 0 mg/mL的齐墩果酸标准溶液于棕色试管中,在70 ℃水浴中加热至试管中的甲醇全部挥发,分别依次加入0.2 mL 5%的香草醛-冰醋酸溶液、0.8 mL高氯酸,摇匀,于水浴锅中加热20 min后,迅速放到冰水中冷却5 min,加入5 mL冰醋酸,充分摇匀,静置22 min,在548 nm波长处测吸光度,绘制标准曲线。
1.4.2 八角皂苷的提取
1.4.2.1 样品的预处理
准确称取85.00 g八角粉末,放入圆底烧瓶中,加入300 mL石油醚,在70 ℃油浴中回流4 h后,除去八角粉末中的石油醚,自然干燥后在50 ℃烘箱中烘干1 h,得到脱脂后的八角粉末,装入密封袋中保存备用。
1.4.2.2 超声波辅助法提取
准确称取50.00 g已脱脂的八角粉末放入250 mL圆底烧瓶中,加入100 mL 40%乙醇溶液,摇匀,150 W超声波辅助提取20 min,取出提取液;再加入100 mL 40%乙醇溶液,摇匀,150 W超声波辅助提取20 min,取上清液。合并提取液,离心、过滤、浓缩,于50 ℃烘箱中烘干,制得八角皂苷超声波辅助提取物。实验平行提取5次,用标准曲线绘制的香草醛-硫酸法对八角皂苷的含量进行测定,计算八角皂苷的得率。
1.4.2.3 加热回流法提取
准确称取50.00 g已脱脂的八角粉末放入250 mL圆底烧瓶中,加入100 mL 40%乙醇,摇匀,于70 ℃油浴加热回流1 h,取出提取液;再加入100 mL 40%乙醇溶液,摇匀,于70 ℃油浴加热回流1 h,取上清液。合并提取液,离心、过滤、浓缩,于50 ℃烘箱中烘干,制得八角皂苷加热回流提取物。实验平行提取5次,用标准曲线绘制的香草醛-硫酸法对八角皂苷的含量进行测定,计算八角皂苷的得率。
1.4.3 八角皂苷的定性分析
1.4.3.1 泡沫实验
取一定量的八角皂苷提取物,加入少量蒸馏水将其溶解,以蒸馏水作为空白对照,煮沸10 min,将煮沸后的提取液放入试管中,强烈振摇,观察实验现象。
1.4.3.2 Lieberman反应
用乙酸酐溶解一定量的八角皂苷提取物,向溶液中加入1滴浓硫酸,观察实验现象。以蒸馏水作为空白对照。
1.4.4 八角皂苷稳定性的测定
分别称取八角皂苷超声波辅助提取物和八角皂苷加热回流提取物各1.003 0 g,用甲醇溶解,定容于100 mL棕色容量瓶中,摇匀,制得质量浓度为10.03 mg/mL的八角皂苷液。
1.4.4.1 温度对八角皂苷稳定性的影响
分别取3 mL八角皂苷液于试管中,分别放在40,50,60,70,80 ℃恒温水浴锅中加热10 min,用香草醛-浓硫酸法显色后,在548 nm波长处测其吸光度。
1.4.4.2 氧化物对八角皂苷稳定性的影响
分别取3 mL八角皂苷液于试管中,分别加入1滴15%的H2O2溶液,用香草醛-浓硫酸法显色,以八角皂苷液为空白对照,在548 nm波长处测其吸光度。
1.4.4.3 pH对八角皂苷稳定性的影响
分别取3 mL八角皂苷液于试管中,分别用1%的HCl溶液和1%的NaOH溶液调节酸碱度,使得溶液的pH分别为2,4,6,8,10,12,以八角皂苷液为空白对照,用香草醛-浓硫酸法显色后,在548 nm波长處测其吸光度。
1.4.4.4 金属离子对八角皂苷稳定性的影响
分别取3 mL八角皂苷液于试管中,分别加入1.0 mg/mL的CaCl2、NaCl、MgCl2、KCl、AlCl3溶液,以八角皂苷液为空白对照,用香草醛-浓硫酸法显色后,在548 nm波长处测其吸光度。
1.4.4.5 光照条件对八角皂苷稳定性的影响
分别取3 mL八角皂苷液于试管中,分别进行日光照射和避光处理,每隔1 h,用香草醛-浓硫酸法显色,在548 nm波长处测其吸光度。
2 结果与分析
2.1 八角皂苷定性分析
在泡沫实验中,有八角提取物的试管中出现了蜂窝状泡沫,持续达20 min;蒸馏水空白对照试管中没有出现蜂窝状泡沫。在Lieberman反应实验中,刚加入浓硫酸时,有八角提取物的试管溶液颜色变为浅绿色,放置24 h后颜色褪去;蒸馏水空白对照试管中一直为无色。由此可知,八角提取物中含有三萜类皂苷。
2.2 八角皂苷定量分析
以齐墩果酸的浓度(C)作为横坐标,吸光度(A)作为纵坐标,绘制标准曲线。经过线性拟合得到方程为A=0.011C-0.024,R2=0.999 5。说明在质量浓度20.50~102.50 mg/mL的范围内,齐墩果酸呈良好的线性关系。经精密度实验、稳定性实验、加标回收实验,结果证明该方法的准确度高,可用于八角皂苷的定量分析。
不同提取方法对八角皂苷进行提取的得率不同,超声波辅助法提取八角皂苷的得率为2.67%,5次平行提取得率的相对标准偏差(RSD)为1.21%;加热回流法提取八角皂苷的得率为5.47%,5次平行提取得率的RSD为0.52%。由结果可知,这两种方法都可以用来提取皂苷。比较两种方法提取八角皂苷的得率及RSD可知,加热回流提取的得率明显比超声波辅助法提取的要高,并且更加稳定可行,故加热回流法用于提取八角皂苷更优。这是因为超声波辅助法提取时间短、能耗少,但没有加热回流法提取得充分,且超声波容易破坏皂苷的结构,所以,超声波辅助法提取皂苷的得率没有加热回流法提取的得率高,且所得皂苷也没有加热回流法提取的稳定。
2.3 八角皂苷的稳定性研究
2.3.1 温度对八角皂苷稳定性的影响
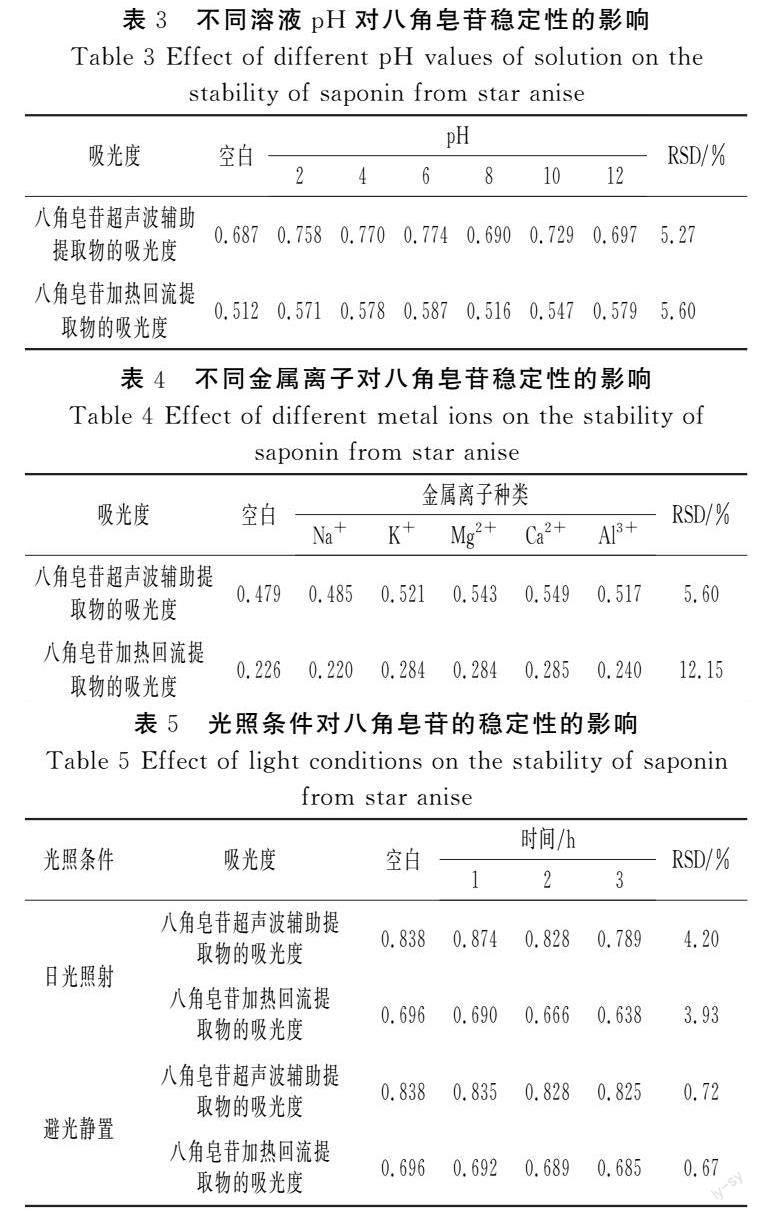
不同温度对八角皂苷稳定性的影响可由皂苷所对应的吸光度体现,结果见表1。
由表1可知,在40~80 ℃范围内,温度对八角皂苷稳定性的影响显著。随着温度的升高,两种提取物的吸光度均逐渐升高,这是因为温度升高,提取物中杂质发生变化,影响香草醛-浓硫酸法显色,使得吸光度增大。温度对八角皂苷加热回流提取物的影响强于对八角皂苷超声波辅助提取物,这可能是因为加热回流法提取的八角皂苷提取物中皂苷含量更高,这与2.2中加热回流法提取比超声波辅助法提取的得率高且稳定这一结论一致。所以,八角皂苷贮存时应置于低温的环境中,避免因热造成皂苷结构的改变。
2.3.2 氧化物对八角皂苷稳定性的影响
氧化物H2O2对八角皂苷稳定性的影响结果见表2。
由表2可知,氧化物H2O2对八角皂苷稳定性有显著的影响,说明氧化物H2O2对八角皂苷具有破坏性,这是植物皂苷易被氧化所引起的。
2.3.3 pH对八角皂苷稳定性的影响
不同pH对八角皂苷稳定性的影响结果见表3。
由表3可知,溶液的pH对八角皂苷稳定性的影响较小。在pH为8时,对八角皂苷稳定性的影响最小,故在生产、使用、存放时八角皂苷应置于pH为8的环境中。
2.3.4 金属离子对八角皂苷稳定性的影响
不同金属离子对八角皂苷稳定性的影响结果见表4。
由表4可知,金属离子对八角皂苷稳定性有一定的影响,其中Na+对八角皂苷稳定性的影响最小,K+、Mg2+、Ca2+对八角皂苷稳定性的影响基本一致。
2.3.5 光照条件对八角皂苷稳定性的影响
光照条件对八角皂苷稳定性的影响结果见表5。
由表5可知,不同的光照条件对八角皂苷稳定性的影响很小,但光照条件对八角皂苷稳定性的影响较避光条件大一些,即避光处理时八角皂苷的稳定性更佳,故八角皂苷储存时最好避光。
3 结论
建立了香草醛-浓硫酸测定八角皂苷的分析方法,其线性方程为A=0.011C-0.024,R2=0.999 5,该方法操作简便快捷,精密度和稳定性好,可以准确分析八角皂苷的含量。
超声波辅助法提取八角皂苷的得率为2.67%,加热回流法提取八角皂苷的得率为5.47%。加热回流法提取八角皂苷的效果比超声波辅助法好。
温度和氧化物H2O2对八角皂苷稳定性的影响显著,溶液的pH对八角皂苷稳定性的影响较小,金属离子对八角皂苷稳定性有一定的影响,光照条件对八角皂苷稳定性的影响很小。在生产、使用、存放时,八角皂苷在低温、pH为8、避光环境中稳定性更佳。
参考文献:
[1]韦小杰,陈小鹏,王琳琳,等.八角油提取新方法的研究[J].食品工业科技,2003(3):41-43.
[2]黄卓民.八角[M].北京:中国林业出版社,1994.
[3]阳小勇,唐荣平.八角茴香的化学成分及应用研究[J].中国调味品,2018,43(8):194-195,200.
[4]郑燕菲,蓝亮美,罗雅梅.八角茴香挥发油的化学成分及其包合物制备工艺研究[J].中国调味品,2020,45(11):38-41.
[5]唐凯,南美娟,章丹,等.响应面法筛选八角茴香多酚的提取工艺[J].陕西中医药大学学报,2019,42(5):48-54.
[6]侯振丽,胡爱林,石旭柳,等.八角茴香的化学成分及生物活性研究进展[J].中药材,2021(8):2018-2027.
[7]刘慧勤,李秋庭,汤星月,等.八角籽油成分和抗氧化性分析[J].中国调味品,2021,46(8):47-51.
[8]赵二劳,徐未芳,刘乐.八茴香抑菌作用研究进展[J].中国调味品,2019,44(4):191-193.
[9]赵二劳,徐未芳,刘乐.八角茴香抗氧化活性研究进展[J].中国调味品,2019,44(5):194-196.
[10]贾秀峰,李波,王佳莹.苜蓿皂苷提取方法的研究及皂苷含量的测定[J].食品研究与开发,2007,28(9):11-13.
[11]刘星,余江丽,刘敏,等.近10年甾体皂苷的生物活性研究进展[J].中国中药杂志,2015,40(13):2518-2523.
[12]罗林明,覃丽,裴刚,等.百合属植物甾体皂苷成分及其药理活性研究进展[J].中国中药杂志,2018,43(7):1416-1426.
[13]陳红艳,陈安,卢芳国,等.三七总皂苷的药理研究进展[J].湖南中医杂志,2019,35(1):154-157.
[14]马园园,王静,罗琼,等.黄芪总皂苷药理作用研究进展[J].辽宁中医药大学学报,2020,22(7):153-157.
[15]谭亮,汤秋凯,王守章,等.三七皂苷R1药理作用的研究进展[J].中国药理学通报,2018,34(5):604-607.
[16]李贵明,李燕.人参皂苷药理作用研究现状[J].中国临床药理学杂志,2020,36(8):1024-1027.
[17]唐冕,许晓芬.药用黄芪皂苷类化学成分及药理作用研究进展[J].中医药导报,2018,24(20):117-122.
[18]胡春凤,张平平,刘金福,等.红枣皂甙提取工艺及定性分析[J].食品研究与开发,2008(29):8-12.
[19]弓晓峰,谢明勇,陈奕.黑灵芝中三萜及其皂苷类化合物总量的光度测定[J].天然产物研究与开发,2006(5):825-829.
[20]耿立晶,周围.苦瓜皂苷的提取方法及生理功能的研究进展[J].中国酿造,2009(7):15-19.
