促醒针法对颅脑损伤昏迷大鼠额叶、顶叶及下丘脑食欲素A及其受体表达变化的影响
2023-06-09杨志琼黄桃李慧靖盘庆东梁蔚莉文希
杨志琼, 黄桃, 李慧靖, 盘庆东, 梁蔚莉, 文希
(1.广州中医药大学,广东广州 510405;2.广州中医药大学顺德医院,广东佛山 528300;3.广东省第二中医院,广东广州 510095)
颅脑损伤(traumatic brain injury,TBI)是指由于交通事故、高空坠落等外界暴力作用所致颅脑组织损伤的疾病。颅脑损伤后出现的以脑组织缺血、缺氧、脑水肿为特征的病理改变是患者继外伤后昏迷的主要原因,严重者可导致死亡[1]。颅脑损伤所致昏迷病死率及致残率较高,如何提高患者生存率及苏醒率,促进神经功能的恢复及改善其生活质量,是一个亟待解决的问题。本课题组前期临床研究[2-3]表明,促醒针法可改善颅脑损伤昏迷患者脑血流灌注及脑功能活动,具有促醒作用。本研究进一步以颅脑损伤昏迷大鼠为研究对象,探讨促醒针法对颅脑损伤大鼠的治疗作用及机制,以期为针刺治疗颅脑损伤昏迷的科研和临床研究提供参考,现将研究结果报道如下。
1 材料与方法
1.1 实验动物及分组选取SPF级健康雄性SD大鼠42 只,4~6 月龄,体质量222 ~304 g,由广州中医药大学动物实验中心提供,动物生产许可证号:SCXK(粤)2018-0034。动物实验于广东省第二中医院(广东省中医药工程技术研究院)完成,动物使用许可证号:SYXK(粤)2020-0059。实验过程严格按照《实验动物管理条例》规定进行,实验方案通过广东省中医药工程技术研究院实验动物伦理委员会审核批准(编号:048503)。将42 只大鼠称体质量后编号,前24只先按随机数字表分为假手术组、模型组、促醒针法组共3组,每组8只,实验期间出现死亡进行随机增补。
1.2 试剂与仪器食欲素A(Orexin-A)抗体、食欲素受体1(OX1R)抗体、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(Abcam 公司);辣根过氧化物酶(HRP)-山羊抗兔IgG(Abcam 公司);组织蛋白抽提试剂盒(北京康为世纪生物科技有限公司);苏木素-伊红(HE)染色试剂盒(广州优迪生物科技股份有限公司)。68099Ⅱ精密打击器(深圳瑞沃德生命技术有限公司);华佗牌一次性无菌针灸针(0.25 mm × 13 mm,苏州医疗用品厂有限公司);BT701-1B 型电针仪(上海华谊医用仪器有限公司);BX51T-PHD-J11 显微镜(日本奥林巴斯公司);低温冷冻离心机(珠海黑马医学仪器有限公司);多功能真彩色细胞图像分析管理系统(美国Media Cybernetics 公司);ChemiDoc™MP 凝胶成像分析系统、MiniTrans-Blot 湿转仪、MiniProtein3电泳仪(美国Bio-Rad公司)。
1.3 造模方法根据Wu[4]、Fournier[5]及Wu[6]等描述的控制性打击法建立颅脑损伤大鼠模型。方法:给予大鼠麻醉满意(大鼠四肢无自主活动,镊子夹尾后无反应,呼吸平顺)后取俯卧位,在无菌条件下剪开大鼠头顶部皮肤,妥善止血,分离骨膜,暴露顶部颅骨,并充分暴露顶骨冠状缝与矢状缝。使用动物立体定向固定架将大鼠固定在68099Ⅱ精密打击器的定位仪上,通过旋钮调整大鼠头部方位、角度,调节颅脑水平,确定打击方向垂直向下。根据大鼠脑立体定位图谱找到Bregma和Lambda点,将两点之间、中缝旁开2 mm处定为打击点,将适配器转移至打击器U 型地板上固定好,调节大鼠颅脑打击点与打击头呈90°。设置打击参数:打击速度(Speed)=(5.0±0.2)m·s-1、打击深度(Depth)=1.00 mm、打击停留时间(Dwell Time)=(0.18 ± 0.01)s。撞击后30 min 评估大鼠意识状态,以翻正反射消失和(或)后爪疼痛反射消失并持续30 min 定义为昏迷状态,判断建模成功[7]。建模成功后,行头皮术口缝合。假手术组仅开骨窗不进行打击,模型组和促醒针法组制备颅脑损伤昏迷模型。
1.4 干预方法仅促醒针法组于造模成功后1、4.5 h行促醒针法治疗,共针刺2次。方法:将大鼠俯卧位固定,参考《实验针灸学实验指导》[8]、徐东升等[9]的研究并结合解剖学进行腧穴定位,选取双侧风池穴、完骨穴、天柱穴、哑门穴及风府穴,局部常规消毒,使用华佗牌0.25 mm×13 mm针灸针,风池穴向后下方斜刺5 mm,天柱穴、完骨穴均直刺3 mm,哑门、风府穴直刺1 mm,风池、完骨穴行针后连接BT701-1B型电针仪,选用疏密波,刺激量由弱逐渐增强,以局部可见肌肉随脉冲频率抽动为度,通电30 min。假手术组和模型组大鼠置于原笼中,不做其他任何干预。
1.5 取材第2 次针刺完成后给予大鼠麻醉,麻醉满意后断头处死大鼠,迅速在冰盒上分离额叶、顶叶和下丘脑组织,分别装入EP 管后做好标示,即刻放入液氮中贮存备用。部分受损顶叶组织放入4%多聚甲醛固定液中备用。
1.6 观察指标与方法
1.6.1 大鼠意识状态评估 造模成功后1、5 h,进行意识状态等级评分。评估标准[10]:正常活动为Ⅰ级;活动较正常减少为Ⅱ级;活动减少,并且存在运动失调为Ⅲ级;若大鼠不能站立,但可引出翻正反射则为Ⅳ级;如果不能诱导复原反射,但发生刺痛,出现肢体回缩反应为Ⅴ级;对所有刺激都不产生反应为Ⅵ级,将Ⅴ级、Ⅵ级定义为昏迷。Ⅵ级为0 分,Ⅴ级为1 分,Ⅳ级为2 分,Ⅲ级为3 分,Ⅱ级为4分,Ⅰ级为5 分,分值越高表明大鼠意识越清醒。评分2 分为显效,3分为有效,4分为显著有效,5分为治愈。
1.6.2 HE 染色法观察大鼠顶叶组织病理学形态并计算正常神经元数目 取大鼠顶叶组织石腊切片,进行二甲苯脱蜡、梯度乙醇脱水,明矾苏木素浸染,1%盐酸酒精分化,淡氨水返蓝,1%伊红液染色,95%~100%酒精脱水,二甲苯透明,中性树胶封片。在显微镜40 倍视野下观察病理学形态,并根据形态学特征判定神经元,应用Olympus摄像系统进行图像采集,应用ImageLab 图像分析系统进行精确的细胞选取、测量与计数。
1.6.3 蛋白免疫印迹(Western Blot)法检测大鼠额叶、顶叶和下丘脑中Orexin-A 及OX1R 蛋白表达 取额叶、顶叶和下丘脑组织,严格按照全蛋白的提取试剂盒说明书提取全蛋白,采用二喹啉甲酸(BCA)蛋白定量法检测蛋白浓度。取50 mg样品和12 μL 样品处理液,混合均匀,95 ℃水浴10 min,每孔上样量20 μL。进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)(5%浓缩胶恒压90 V,约20 min;10%分离胶恒压120 V,约90 min),将蛋白转至聚偏氟乙烯(PVDF)膜上,50 g/L 脱脂奶粉常温封闭30 min,加入一抗(Orexin-A、OX1R,以1∶200的体积比稀释)4 ℃孵育过夜,TBS-吐温20(TBST)漂洗3 次。孵二抗(HRP-山羊抗兔IgG,以1∶5 000 的体积比稀释)常温孵育2 h,TBST 漂洗。增强化学发光(ECL)试剂显色,凝胶成像仪成像。以GAPDH为内参,应用ImageLab 软件分析条带灰度值,数据结果以目的蛋白与内参蛋白GAPDH的灰度值比值表示。
1.7 统计方法采用SPSS 21.0统计软件进行数据分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠打击后颅脑情况本实验打击造模成功的大鼠最主要的组织病理特征为大脑皮层钝挫伤伴组织出血,见图1。这与人闭合性颅脑外伤后观察到的组织病理特征相似。
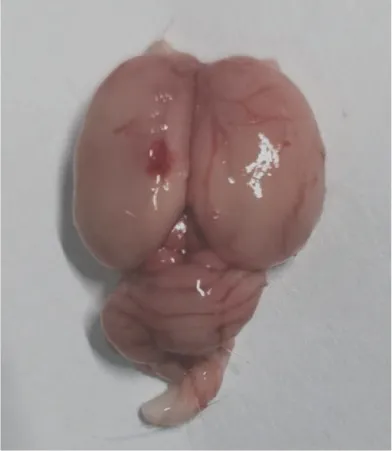
图1 大鼠打击后颅脑情况Figure 1 Cranial condition of the rat after a strike
2.2 各组大鼠意识状态水平比较假手术组、模型组、促醒针法组大鼠在造模成功后1、5 h 进行意识状态评估。造模后1 h 评估结果:假手术组7 只为Ⅵ级,1 只为Ⅴ级,促醒针法组及模型组8 只均为Ⅴ级。造模后4.5 h 评估结果:假手术组4 只为Ⅰ级,4只为Ⅱ级;模型组3只为Ⅵ级,3只为Ⅴ级,2 只为Ⅳ级;促醒针法组3 只为Ⅲ级,4 只为Ⅱ级,1只为Ⅰ级。见表1 ~表2。

表1 各组大鼠造模后1 h意识状态评级比较Table 1 Comparison of the conscious state ratings in each group of rats at 1 hour after modelling[只(%)]
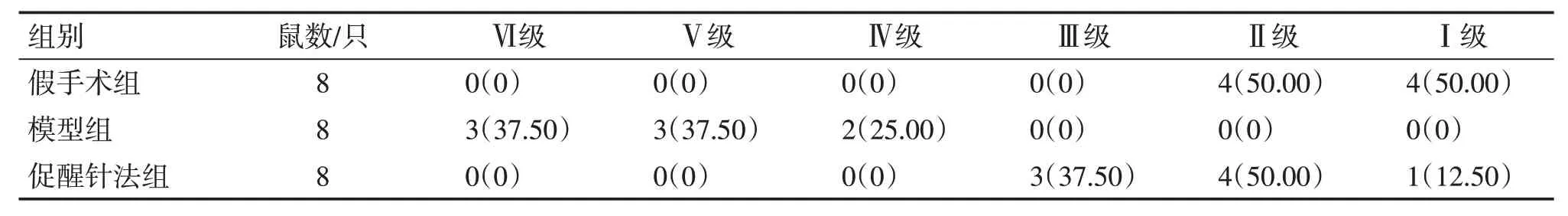
表2 各组大鼠造模后5 h意识状态评级比较Table 2 Comparison of the ratings on conscious states in each group of rats at 5 hours after modelling[只(%)]
组间比较:模型组大鼠意识状态评分明显低于假手术组(P<0.05);与模型组比较,促醒针法组大鼠意识状态评分明显升高(P<0.05)。表明促醒针法针刺可以明显改善颅脑损伤昏迷大鼠的意识状态。见表3。
表3 各组大鼠造模后5 h意识状态评分比较Table 3 Comparison of consciousness scores of rats in each group at 5 hours after modelling (±s,分)

表3 各组大鼠造模后5 h意识状态评分比较Table 3 Comparison of consciousness scores of rats in each group at 5 hours after modelling (±s,分)
注:①P<0.05,与假手术组比较;②P<0.05,与模型组比较
?
2.3 各组大鼠脑顶叶组织病理学变化及正常神经元数目比较图2结果显示:假手术组顶叶组织结构、细胞间隙正常,神经细胞排列有序,细胞核形状均匀规整;模型组顶叶损伤区组织可见明显水肿,细胞间隙增宽,神经细胞排列紊乱,细胞核形状不规整,部分细胞核固缩,这些病理变化符合颅脑损伤早期脑组织表现。针刺治疗后,促醒针法组顶叶组织病理形态较模型组减轻,可见神经细胞排列较有序,大部分细胞核形状均匀规整,小部分细胞核固缩,但仍较假手术组紊乱。

图2 各组大鼠脑顶叶组织病理学变化比较(HE染色,×40)Figure 2 Comparison of histopathological changes in parietal lobe in each group of rats(HE staining,×40)
图3结果显示:与假手术组比较,模型组正常神经元数目明显减少(P<0.05);与模型组比较,促醒针法组正常神经元数目明显增多(P<0.05)。提示颅脑损伤昏迷大鼠神经元损伤严重,而促醒针法可减轻颅脑损伤引起的神经元损伤。

图3 各组大鼠脑顶叶组织正常神经元数目比较Figure 3 Comparison of the number of normal neurons in parietal lobe among each group of rats
2.4 各组大鼠额叶、顶叶、下丘脑Orexin-A、OX1R蛋白表达比较表4 ~表5及图4 ~图6结果显示:与假手术组比较,模型组和促醒针法组的Orexin-A及OX1R表达水平明显下降,差异均有统计学意义(P<0.05);与模型组比较,促醒针法组的Orexin-A及OX1R表达水平升高,差异均有统计学意义(P<0.05)。
表4 各组大鼠额叶、顶叶、下丘脑Orexin-A蛋白相对表达量比较Table 4 Comparison of Orexin-A protein relative expression levels in frontal lobe,parietal lobe and hypothalamus in each group of rats(±s)

表4 各组大鼠额叶、顶叶、下丘脑Orexin-A蛋白相对表达量比较Table 4 Comparison of Orexin-A protein relative expression levels in frontal lobe,parietal lobe and hypothalamus in each group of rats(±s)
注:①P<0.05,与假手术组比较;②P<0.05,与模型组比较
?
表5 各组大鼠额叶、顶叶、下丘脑OX1R蛋白相对表达量比较Table 5 Comparison of OX1R protein relative expression levels in frontal lobe,parietal lobe and hypothalamus in each group of rats(±s)
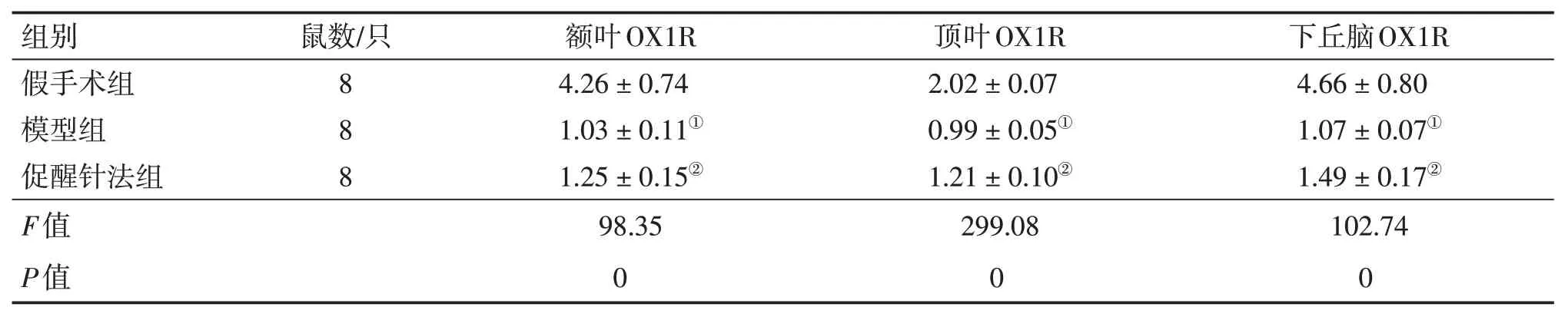
表5 各组大鼠额叶、顶叶、下丘脑OX1R蛋白相对表达量比较Table 5 Comparison of OX1R protein relative expression levels in frontal lobe,parietal lobe and hypothalamus in each group of rats(±s)
注:①P<0.05,与假手术组比较;②P<0.05,与模型组比较
?

图4 各组额叶Orexin-A、OX1R的Western Blot条带图Figure 4 Western Blot bands of Orexin-A and OX1R in the frontal lobe

图5 各组顶叶Orexin-A、OX1R的Western Blot条带图Figure 5 Western Blot bands of Orexin-A,OX1R in the parietal lobe
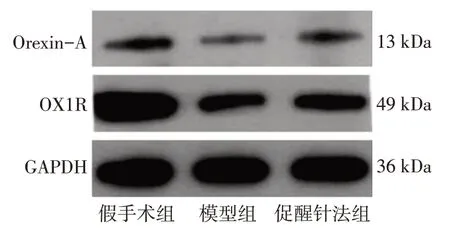
图6 各组下丘脑Orexin-A、OX1R的Western Blot条带图Figure 6 Western Blot bands of Orexin-A,OX1R in the hypothalamus
3 讨论
颅脑损伤昏迷可归属于中医学“神昏”“昏愦”范畴,《伤寒明理论》曰:“昏冒而神不清者,不知痛痒,谓之昏迷者是也。”颅脑损伤后,髓海血脉损伤,气机逆乱,瘀血或痰浊蒙蔽清窍,导致神机失用,昏迷不醒。气机逆乱、窍闭神昏是病机关键。促醒针法主要选穴为双侧风池、完骨、天柱、哑门及风府穴。其中,风池穴、完骨穴为足少阳胆经要穴,可条达阳经之气、益髓醒脑利机关,《针灸甲乙经》记载:“癫疾僵仆,完骨及风池主之。”天柱穴属于足太阳膀胱经,可调节头部经络气血,起清头明目、活血调气之功;哑门穴、风府穴为督脉选穴,可起通督调神、开窍启闭功用。以上诸穴配合治疗,针对病机,直达病所,协同发挥濡养脑部、通督调髓、醒神开窍、调和阴阳、活血通络之功效。现代研究表明:针刺风池穴与风府穴,能够对周围神经血管产生刺激,可提高血液流速,解除血管痉挛,减小血流阻力,调控脑细胞的缺血缺氧水平[11];针刺完骨穴可改善椎-基底动脉血供,促进脑血管侧支循环的形成,调节神经生长因子水平[12];针刺天柱穴可调节大脑皮层功能[13];电针风府、哑门穴可减轻血管损伤和神经细胞毒性,有利于病灶区脑组织生理功能恢复,促进昏迷患者苏醒[14];同时,针刺督脉选穴可抑制慢性脑缺血模型大鼠的炎性反应,减少慢性脑缺血损伤,改善脑血流量,有利于保护脑神经元[15]。针刺以上诸穴,直趋病所,改善大脑的血液循环,刺激处于“休眠”状态的神经细胞,以解除大脑皮层的抑制状态,促进部分处于可逆状态的受损脑细胞的恢复和侧枝循环的建立,激活上行网状激活系统,从而尽快减轻或消除意识障碍。
血脑屏障破坏和神经元损伤是颅脑损伤后的重要病理变化[16],如何有效、快速抑制神经元损伤及减轻脑水肿是治疗颅脑损伤的关键途径。Ren等[17]观察重度颅脑损伤大鼠的创伤半暗带区组织变化,发现颅脑损伤后1 h细胞间隙增大,提示血管源性水肿形成;6 h 时细胞膨大,细胞核皱缩,细胞质被空泡取代,表明细胞内水肿;血管源性水肿和细胞内水肿在颅脑损伤后12 h 时程度最为严重。黄康柏等[18]研究发现,脑缺血2 h 即出现神经元凋亡,而针刺可减轻神经元的损伤。已有研究表明,颅脑损伤昏迷进行干预的时间应该尽可能提前,早期电针干预在颅脑损伤急性期更为有效[19]。故本实验针刺干预时间定为造模成功后1 h以及第1次针刺完成后3 h。本研究HE染色结果显示,模型组大鼠脑顶叶损伤区组织可见水肿、神经元细胞损伤等颅脑损伤早期脑组织表现,且正常神经元数目减少,而通过促醒针刺治疗,促醒针法组顶叶损伤区脑组织较模型组明显改善,正常神经元数目明显增多。提示促醒针法可减轻颅脑损伤引起的神经元损伤,有脑保护作用。结合各组间大鼠行为学改变情况:假手术组4 只为Ⅰ级,4 只为Ⅱ级;模型组3 只为Ⅵ级,3 只为Ⅴ级,2 只为Ⅳ级;促醒针法组3 只Ⅲ级,4 只Ⅱ级,1 只Ⅰ级。3 组的清醒意识状态:假手术组>促醒针法组>模型组。提示促醒针法治疗能够改善颅脑外伤昏迷大鼠的意识水平,加速脑外伤昏迷大鼠的觉醒反应。
Orexins 是由外侧下丘脑分泌合成的一种神经多肽,参与摄食、能量代谢、自主神经功能及睡眠觉醒等众多生理功能的调节[20]。它主要通过分泌Orexin-A 和Orexin-B 两个亚基及其激活其受体OX1R、OX2R 来发挥作用,其在大脑皮层中均有广泛的投射。有研究[21]发现:给予麻醉大鼠模型侧脑室注射Orexin-A 可加速其苏醒,缩短其昏迷时间;反之,给予OX1R拮抗剂可使麻醉大鼠的昏迷时间延长。Orexin神经元的丧失可使大鼠由觉醒向昏迷发生转变。因此,Orexin-A 在觉醒中扮演着关键性的作用。本研究对颅脑损伤昏迷大鼠行2 次促醒针法治疗后进行脑组织取样,Western Blot结果显示,各组间大鼠Orexin-A及OX1R表达呈现假手术组>促醒针法组>模型组的递减趋势。提示促醒针法治疗能够上调颅脑损伤大鼠脑组织内Orexin-A 及OX1R 表达,起到保护神经及促兴奋、睡眠觉醒的作用。
综上所述,促醒针法可提高颅脑损伤后昏迷大鼠的意识水平,其机制可能与促进下丘脑、顶叶、额叶Orexin-A和OX1R表达有关;同时也表明促醒针法可能成为昏迷促醒的一种新型有效的治疗方法。
