全自动固相萃取-高效液相色谱法测定食品中红曲色素
2023-06-08王思媛段鹏雪
王思媛,段鹏雪
(庆阳市疾病预防控制中心,甘肃庆阳 745000)
红曲色素产生于红曲霉菌的代谢过程,是一类聚酮体化合物的混合物质,红曲色素在食品生产领域的应用相当广泛[1-2]。《食品安全国家标准 食品添加剂使用标准》(GB 2760—2014)中规定,红曲色素作为食品着色剂应用于酒、熟肉制品、糖果和腐乳中时可按需添加[3]。
高效液相色谱-质谱联用法[4-5]、高效液相色谱法[6]、分光光度法[7]和近红外光谱法[8]等检测方法已成为分析红曲色素的主要手段,其中高效液相色谱法是检测红曲色素最常使用的方法。本文利用全自动固相萃取技术对样品完成净化,采用高效液相色谱法进行检测分析,建立了食品中红曲素、红曲红素、红曲红胺定性定量的分析方法,为食品中的红曲色素成分的快速检测提供了实践参考。
1 材料与方法
1.1 仪器与试剂
Agilent 1200高效液相色谱仪,配有二极管阵列检测器(DAD);Reeko Fotector-06c全自动固相萃取仪;高速冷冻离心机;Milli-Q超纯水系统;HLB型固相萃取柱(200 mg/6 mL);SB5200DTDN超声波仪;Flex-MVP全自动真空浓缩仪。
标准品:红曲素(98.9%)、红曲红素(98.0%),红曲红胺(98.3%);甲醇为色谱纯,其余试剂均为分析纯;实验用水为超纯水。
1.2 试验方法
1.2.1 色谱条件
色谱柱:ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm);柱温:40 ℃;红曲红素、红曲素检测时波长设定为390 nm;红曲红胺检测时波长设定为264 nm;进样量20 μL;流速1.0 mL·min-1。流动相为甲醇-乙酸铵溶液(pH=5),流动相比例和梯度洗脱见表1。

表1 流动相比例和梯度洗脱
1.2.2 溶液配制
(1)单标准储备溶液的配制。称取红曲素5 mg、红曲红素100 mg、红曲红胺10 mg,分别用甲醇定容至100 mL、20 mL、100 mL。其中红曲素质量浓度为50 μg·mL-1、红曲红素为5000 μg·mL-1、红曲红胺为100 μg·mL-1,于4 ℃条件下冷藏保存。
(2)混合标准工作液的配制。分别吸取上述标准储备液0.50 mL、1.00 mL、2.00 mL、5.00 mL和10.00 mL于25 mL容量瓶中,用甲醇定容,于4 ℃保存。混合工作液质量浓度分别为红曲红胺2 mg·L-1、4 mg·L-1、8 mg·L-1、20 mg·L-1、40 mg·L-1,红曲素1 mg·L-1、2 mg·L-1、4 mg·L-1、10 mg·L-1、20 mg·L-1,红曲红素100 mg·L-1、200 mg·L-1、400 mg·L-1、1000 mg·L-1、2000 mg·L-1。
1.2.3 提取
分别称取醋、酱油、料酒、冷冻饮品、调制乳等液体样品5.00 g置于烧杯中,用无水乙醇进行溶解后,定容至50 mL,待净化。
分别称取熟肉制品、腌制蔬菜、调味品、膨化食品、发酵乳和炼乳等固体半固体样品5.00 g置于50 mL离心管中,用20 mL 80%的乙醇溶液涡旋混匀后,超声提取15 min,在4 ℃条件下,于4500 r·min-1离心5 min,取上清液,并用20 mL 80%的乙醇溶液复提1次,将两次提取液合并于50 mL容量瓶中,用无水乙醇定容,待净化。
1.2.4 净化
取1.2.3项下合并后的提取液20 mL于50 mL离心管内,并加入乙醇10 mL,在(60±2)℃下,真空浓缩达到近干状态,用2 mL 20%的甲醇溶解残渣2次,将其全部转移至10 mL进样瓶中,用全自动固相萃取仪净化富集,程序见表2。收集的洗脱液进行真空浓缩近干后,用2 mL 20%的甲醇溶解,待测液过0.45 μm有机滤膜后,进行测定。
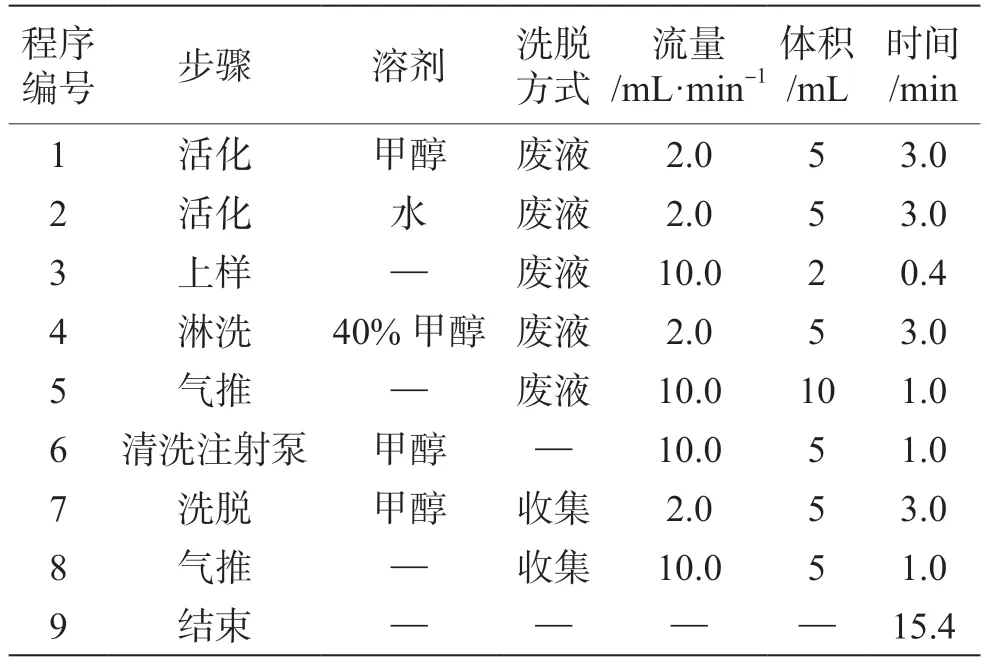
表2 净化富集程序
2 结果与分析
2.1 色谱分离效果
按照上述实验方法对红曲素10 mg·L-1、红曲红素2000 mg·L-1、红曲红胺20 mg·L-1的混合标准溶液进行实测。由图1可知,在264 nm波长下红曲红胺的出峰时间为9.599 min,在390 nm波长下红曲素和红曲红素出峰时间依次为10.862 min、11.502 min。

图1 红曲色素混合标准溶液色谱图
2.2 色谱柱的选择
红曲素、红曲红素和红曲红胺均为弱极性物质,在C18色谱柱上都有较好的保留,因红曲素、红曲红素和红曲红胺的化学结构具有相似特征,因此出峰时间较为相近。本试验选用C18(250 mm×4.6 mm,5 μm)色谱柱进行检测,通过调整流动相比例和梯度洗脱,使红曲素、红曲红素和红曲红胺可以完全分离。
2.3 流动相选择
用于分离红曲类色素的流动相有磷酸溶液pH=2.5±0.3和乙腈[6]、乙腈和水[4]、甲醇和1%乙酸[9]、甲醇和乙酸铵(pH=5)[10]等。试验发现,以上4种流动相中甲醇和乙酸铵(pH=5)能够较好地分离出红曲红胺、红曲素和红曲红素。同时试验采用的梯度洗脱程序用时18 min与《食品安全国家标准 食品中红曲色素的测定》(GB 5009.150—2016)用时30 min相比,检测样品所需时间更短,更适合批量检测。
2.4 标准曲线和检出限
根据3倍信噪比(3S/N)计算检出限[11],红曲素、红曲红素和红曲红胺的检出限分别为0.146 mg·kg-1、5.770 mg·kg-1、1.880 mg·kg-1,均低于GB 5009.150—2016中规定的检出限要求(红曲素0.30 mg·kg-1、红曲红素30 mg·kg-1和红曲红胺3.0 mg·kg-1),满足分析要求。
将1.2.2配制成的混合标准曲线工作液,依照色谱要求完成检测,以质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线。由表3可知,红曲素、红曲红素和红曲红胺的线性方程相关系数均在0.999以上,且线性关系良好。

表3 标准曲线和检出限
2.5 精密度和回收实验
取红曲色素混合标准溶液,按照低、中、高3个浓度水平进行加标回收试验,加标样品平行测定7次,计算3种红曲色素回收率及相对标准偏差,见表4。3种红曲色素的平均回收率在82.9%~106.0%,RSD在0.52%~2.38%,表明该方法精密度良好,能够满足测定要求。

表4 精密度和回收率(n=7)
3 结论
本试验采用高效液相色谱法对食品样品中的3种红曲色素进行分析,此方法具有精度高、操作便捷、强重现性以及应用范围广的特点,可以在大批量样品检测时使用,为食品中红曲色素的快速测定供了技术参考。
