血府逐瘀胶囊调控miR-532-5p/Arp2抑制ox-LDL诱导的人冠状动脉内皮细胞氧化应激损伤*
2023-06-08李江赵建廷吕昌光金一琦
李江,赵建廷,吕昌光,金一琦
南京医科大学附属苏州医院,江苏 苏州 215000
动脉硬化闭塞症是发病率最高的缺血性疾病之一,近年来其发病率逐年增加,此疾病最主要为下肢动脉硬化闭塞,其中30%发生于髂动脉,70%多见于股动脉、腘动脉及远端动脉等[1],在中医学中属于“脱疽”范畴。动脉粥样硬化(atherosclerosis,AS)是引起动脉硬化闭塞症的主要原因[2-3]。由氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)引起的内皮细胞功能障碍是AS发生的第一步。ox-LDL可破坏血管内皮细胞的氧化还原平衡,引起氧化应激损伤[4-5]。血府逐瘀汤是清代王清任《医林改错》中治疗血瘀的一个经典方剂,由桃仁、红花、生地黄、当归、赤芍、川芎、柴胡、枳壳、牛膝、桔梗、甘草11味中药组成,方剂中的桃仁、红花、生地黄、当归、赤芍、川芎6味药活血化瘀而养血;柴胡、枳壳、甘草行气和血而舒肝;桔梗可以开肺气、载药上行,配合枳壳则升降上焦之气而宽胸;牛膝通利血脉、引血下行。临床上发现此方剂可改善微循环、扩张微血管、增加组织灌注,被广泛用于包括AS在内的多种疾病的治疗[6-7]。临床研究发现,血府逐瘀汤可明显改善下肢动脉硬化闭塞症患者的症状[8],但是其作用机制尚未完全阐明。
微小RNAs(microRNAs,miRNAs)是一类长度为22~25个核苷酸的非编码RNAs。miRNAs是AS发生和发展过程的一类重要的调控因子[9-11]。最新的研究发现,血府逐瘀汤在颅脑损伤中发挥神经保护作用与miRNAs表达变化有关[12]。Sun等[13]的研究显示,miR-532-5p在AS患者血清中的表达水平比健康人低,且miR-532-5p低表达在 ox-LDL诱导的内皮细胞损伤中发挥重要作用[14]。故本实验检测血府逐瘀胶囊对下肢动脉硬化闭塞症患者血清中miR-532-5p表达的影响,并用ox-LDL诱导的人冠状动脉内皮细胞(human coronary artery endothelial cells,HCAECs)氧化应激损伤模型探究血府逐瘀胶囊含药血清对内皮细胞氧化损伤的作用并探讨其与miR-532-5p的关系。
1 材料
1.1 临床资料选择2021年1月至2022年5月在南京医科大学附属苏州医院经超声检查或血管造影等影像学检查确诊为下肢动脉硬化闭塞症并采用保守治疗的患者40例,其中男性26例,女性14例,年龄49~73岁,平均年龄61.7岁。所有患者均符合中国中西医结合学会制定的诊断标准,Fontaine分期为Ⅰ—Ⅲ期。排除标准:(1)具有严重的疾病病史,如血液病、恶性肿瘤、心肌梗死、严重肝肾功能异常、脑出血、自身免疫疾病;(2)精神异常、伴有严重肢体感染、具有传染性疾病;(3)肢体缺血性疾病,如大动脉炎、血栓闭塞性脉管炎;(4)患者依从性差。本研究经南京医科大学附属苏州医院伦理委员会批准(批号:2020-024),且所有患者均签署知情同意书。
1.2 实验动物与细胞6周龄SD大鼠由上海斯莱克实验动物有限公司提供,动物许可证号:SCXK(沪)2012-0002。大鼠饲养在苏州大学实验动物中心,温度(22±1) ℃,湿度(60±5)%,12 h/12 h昼夜交替,可自由进食饮水。适应饲养一周后进行实验。所有动物实验操作均经苏州大学实验动物伦理委员会审查批准(批号:2021-019)。HCAECs细胞(美国ATCC公司,货号:PCS-100-020)。
1.3 药物与试剂血府逐瘀胶囊(天津宏仁堂药业有限公司,批号:Z12020223);内皮细胞培养基(美国Sciencell公司,货号:1001);胎牛血清(美国Hyclone公司,货号:SH30396.02);Lipofectamine 3000(美国Invitrogen公司,货号:L3000008);ox-LDL、RIPA裂解液和BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,货号:IO1300、R0010、PC0020);丙二醛(malondialdehyde,MDA)测定试剂盒(微板法)和超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(WST-1 法)(南京建成生物工程研究所,货号:A003-4-1、A001-3-2);活性氧(reactive oxygen species,ROS)检测试剂盒和CCK-8试剂盒(上海碧云天生物技术有限公司,货号:S0033S、C0038);TRNzol Universal总RNA提取试剂、miRcute增强型miRNA cDNA第一链合成试剂盒、miRcute增强型miRNA荧光定量检测试剂盒(SYBR Green)(北京天根生化科技有限公司,货号:DP424、KR211、FP411);双荧光素酶报告基因检测试剂盒(美国Promega公司,货号:E1910);肌动蛋白相关蛋白2(actin-related protein 2,Arp2)兔单克隆抗体和GAPDH兔单克隆抗体(美国Abcam公司,货号:ab128934、ab181602);Annexin V-APC/PI凋亡试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号:E-CK-A217)。
1.4 仪器FACSCalibur流式细胞仪(美国BD公司);7500 Fast RT-PCR仪(美国ABI公司);NanoDrop 2000C超微量分光光度计和MultiskanTMFC 酶标仪(美国Thermo Fisher Scientific公司);Tanon 4600 全自动化学发光图像分析系统(上海天能科技有限公司)。
2 方法
2.1 治疗方法和血清收集将40例患者随机分成治疗组和对照组,每组20例。对照组患者入院后给予常规治疗,治疗组患者入院后在给予常规治疗的基础上口服血府逐瘀胶囊,每日两次,每次6粒。治疗前和服药4周后分别收集患者空腹静脉血5 mL,静置30 min后,3 000 r·min-1离心10 min,收集上清液即为血清样本。
2.2 血府逐瘀含药血清制备将大鼠随机分成血府逐瘀胶囊组和对照组,每组5只。血府逐瘀胶囊组大鼠灌胃给予0.48 g·kg-1血府逐瘀胶囊药液,给药体积10 mL·kg-1,每天2次[15],对照组大鼠给予同等剂量的生理盐水,连续7 d。末次给药2 h后腹主动脉采血,静置30 min后,4 ℃,3 000 r·min-1离心10 min,取上清液,56 ℃水浴30 min灭活补体,0.22 μm微膜过滤除菌后,-70 ℃冻存备用。
2.3 细胞培养和分组将HCAECs培养在含有5%胎牛血清的内皮细胞培养基中,置于细胞培养箱中培养(条件设置为37 ℃,5%CO2)。取对数生长期的细胞,胰蛋白酶消化后接种到细胞培养皿中,过夜培养后,将细胞进行以下分组:对照组、ox-LDL组(加入100 mg·L-1ox-LDL培养24 h)、血府逐瘀组(用体积分数2.5%血府逐瘀含药血清培养 48 h 后加入100 mg·L-1ox-LDL培养24 h)、血府逐瘀对照组(加入等量对照血清培养48 h后加入100 mg·L-1ox-LDL培养24 h)、血府逐瘀+miR-532-5p抑制剂组(用Lipofectamine 3000将miR-532-5p抑制剂转染至细胞24 h后加体积分数2.5%血府逐瘀含药血清培养48 h再用 100 mg·L-1ox-LDL继续培养24 h)、血府逐瘀+miR-532-5p抑制剂对照组(用Lipofectamine 3000将miR-532-5p抑制剂对照转染至细胞24 h后加入体积分数2.5%血府逐瘀含药血清培养48 h再用100 mg·L-1ox-LDL继续培养24 h)。
2.4 CCK-8测定细胞活力将2×103个HCAECs接种到96孔板,根据上述分组进行处理后,每孔加入10 μL CCK-8溶液,37 ℃,5%CO2细胞培养箱中孵育1 h,使用酶标仪在450 nm波长处测定吸光度。
2.5 ROS、MDA和SOD含量检测细胞内ROS水平根据DCFH-DA方法使用ROS检测试剂盒进行测定。将HCAECs接种到6孔板,分为对照组、ox-LDL组、血府逐瘀组和血府逐瘀对照组,按2.3项所述方法进行处理后,去除细胞培养基,加入1 mL 10 μmol·L-1DCFH-DA,在37 ℃细胞培养箱中孵育20 min,无血清的细胞培养液清洗细胞去除未进入胞内的DCFH-DA。收集细胞,调整细胞密度为1×106mL-1,用流式细胞仪检测荧光变化情况(488 nm激发波长,525 nm发射波长)。对于胞内MDA和SOD含量的检测:HCAECs分组处理后,弃上清液,细胞刮刀将细胞刮下后用移液器转移至微量离心管中,按照试剂盒说明书操作,用酶标仪分别在530 nm和450 nm波长处测定吸光度。
2.6 RT-PCR实验根据TRNzol Universal总RNA提取试剂说明书操作提取患者血清和HCAECs的总RNA,取1 μg进行逆转录后取1 μL cDNA使用miRNA荧光定量检测试剂盒在PCR仪上操作检测miR-532-5p的表达。反应程序:95 ℃预变性15 min,94 ℃变性20 s,60 ℃退火延伸30 s,40个循环。用U6做内参,按照2-△△Ct计算miR-532-5p的表达量。引物序列如下:miR-532-5p上游引物5′-ACACTCCAGCTGGGCATGCCTTGAGTGTAG-3′,下游引物5′-TGGTGTCGTGGAGTCG-3′;U6上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。
2.7 Western blot实验HCAECs细胞分组处理后用RIPA裂解液裂解,提取总蛋白后,测定总蛋白浓度。每个样本取20 μg进行10%聚丙烯酰胺凝胶电泳分离,之后将样本转移到PVDF膜上,用5%脱脂奶粉封闭2 h,分别加入提前稀释好的Arp2抗体(11 000)和GAPDH抗体(11 000)在4 ℃过夜孵育。将膜用TBST缓冲液洗涤3次后加入辣根过氧化物酶标记的二抗(15 000)孵育1 h。用ECL发光液对蛋白显色,拍照后用Image J软件分析蛋白条带的灰度值。以GAPDH作为内参蛋白,计算Arp2蛋白的相对表达量。
2.8 细胞凋亡检测将HCAECs接种到6孔板,分组处理后,收集上清液中悬浮细胞,用不含EDTA的胰酶消化细胞后收集细胞。PBS洗涤上述细胞后重悬细胞计数。取1×105个重悬细胞,300 r·min-1离心5 min,弃上清后用500 μL 1×Annexin V Binding Buffer将细胞重悬,然后加入5 μL Annexin V-APC试剂和5 μL PI试剂,混匀后室温避光孵育 15 min,用流式细胞仪检测细胞凋亡情况。
2.9 双荧光素酶报告基因检测miR-532-5p与Arp2的结合能力Starbase软件预测miR-532-5p的靶基因,发现Arp2是它的一个潜在靶基因。将Arp2-3′UTR和突变的Arp2-3′UTR插入pmirGLO双荧光素酶报告基因载体中构建Arp2-Wt和Arp2-Mut质粒。将HCAECs接种到24孔板中,进行以下分组处理:miR-532-5p组(用Lipofectamine 3000转染miR-532-5p和构建的Arp2-Wt或Arp2-Mut质粒)和miR-NC组(用Lipofectamine 3000转染miR-532-5p对照品miR-NC和构建的Arp2-Wt或Arp2-Mut质粒)。48 h后测定荧光素酶活性。
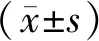
3 结果
3.1 血府逐瘀胶囊上调下肢动脉硬化闭塞症患者血清中miR-532-5p的表达与治疗前比较,治疗组患者给予血府逐瘀胶囊后血清中miR-532-5p表达显著升高(P<0.05);而对照组患者治疗前后miR-532-5p表达差异无统计学意义(P>0.05)。治疗后,血府逐瘀胶囊治疗组患者血清中miR-532-5p表达显著高于对照组(P<0.05)。见图1。

注:A:治疗组患者治疗前后血清miR-532-5p表达水平比较;B:对照组患者治疗前后血清miR-532-5p表达水平比较;C:治疗后两组患者血清miR-532-5p表达水平比较;与治疗前比较,*P<0.05;与对照组比较,#P<0.05
3.2 血府逐瘀含药血清可抑制ox-LDL诱导的内皮细胞氧化应激损伤与对照组比较,ox-LDL组HCAECs细胞活力显著降低(P<0.05),细胞凋亡率、ROS和MDA水平显著增加(P<0.05),SOD水平显著降低(P<0.05);与ox-LDL组比较,血府逐瘀组细胞活力显著升高(P<0.05),细胞凋亡率、ROS和MDA水平显著降低(P<0.05),SOD水平显著升高(P<0.05);与ox-LDL组比较,血府逐瘀对照组细胞活力、ROS、MDA和SOD水平以及凋亡率差异均无统计学意义(P>0.05),即对照血清对 ox-LDL诱导的内皮细胞氧化应激损伤无影响。见表1,图2。

表1 血府逐瘀含药血清对ox-LDL诱导的内皮细胞氧化应激损伤的影响
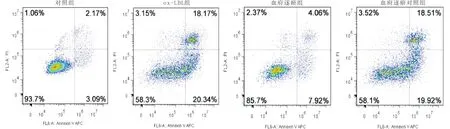
图2 流式细胞术检测细胞凋亡图
3.3 血府逐瘀含药血清对ox-LDL刺激的内皮细胞中miR-532-5p和Arp2表达的影响与对照组比较,ox-LDL组细胞中miR-532-5p表达显著降低(P<0.05),Arp2蛋白表达显著增加(P<0.05);与ox-LDL组比较,血府逐瘀组中miR-532-5p表达显著增加(P<0.05),Arp2蛋白表达显著降低(P<0.05);但是与ox-LDL组比较,血府逐瘀对照组中miR-532-5p和Arp2表达差异均无统计学意义(P>0.05)。见图3,表2。

表2 血府逐瘀含药血清对ox-LDL刺激的内皮细胞中miR-532-5p和Arp2表达的影响

图3 各组Arp2蛋白表达条带图
3.4 血府逐瘀含药血清通过miR-532-5p调控ox-LDL诱导的内皮细胞氧化应激损伤与血府逐瘀组比较,血府逐瘀+miR-532-5p抑制剂组HCAECs细胞活力显著降低(P<0.05),ROS和MDA含量以及凋亡率显著增加(P<0.05),SOD含量显著减少(P<0.05);但是与血府逐瘀组比较,血府逐瘀+miR-532-5p抑制剂对照组细胞活力、ROS、MDA和SOD含量以及凋亡率均无统计学意义(P>0.05)。见表3,图4。

表3 血府逐瘀含药血清通过miR-532-5p调控ox-LDL诱导的内皮细胞氧化应激损伤
图4 流式细胞术检测细胞凋亡图
3.5 miR-532-5p靶向调控Arp2的表达Starbase软件分析发现Arp2是miR-532-5p的一个潜在靶基因,两者的结合序列见图5A。双荧光素酶报告基因检测两者的结合能力,结果见图5B,miR-532-5p可减少转染Arp2-Wt质粒的HCAECs荧光素酶活性(P<0.05),但不能改变转染Arp2-Mut质粒的荧光素酶活性(P>0.05)。miR-532-5p抑制剂可增加Arp2蛋白表达,见图5C。
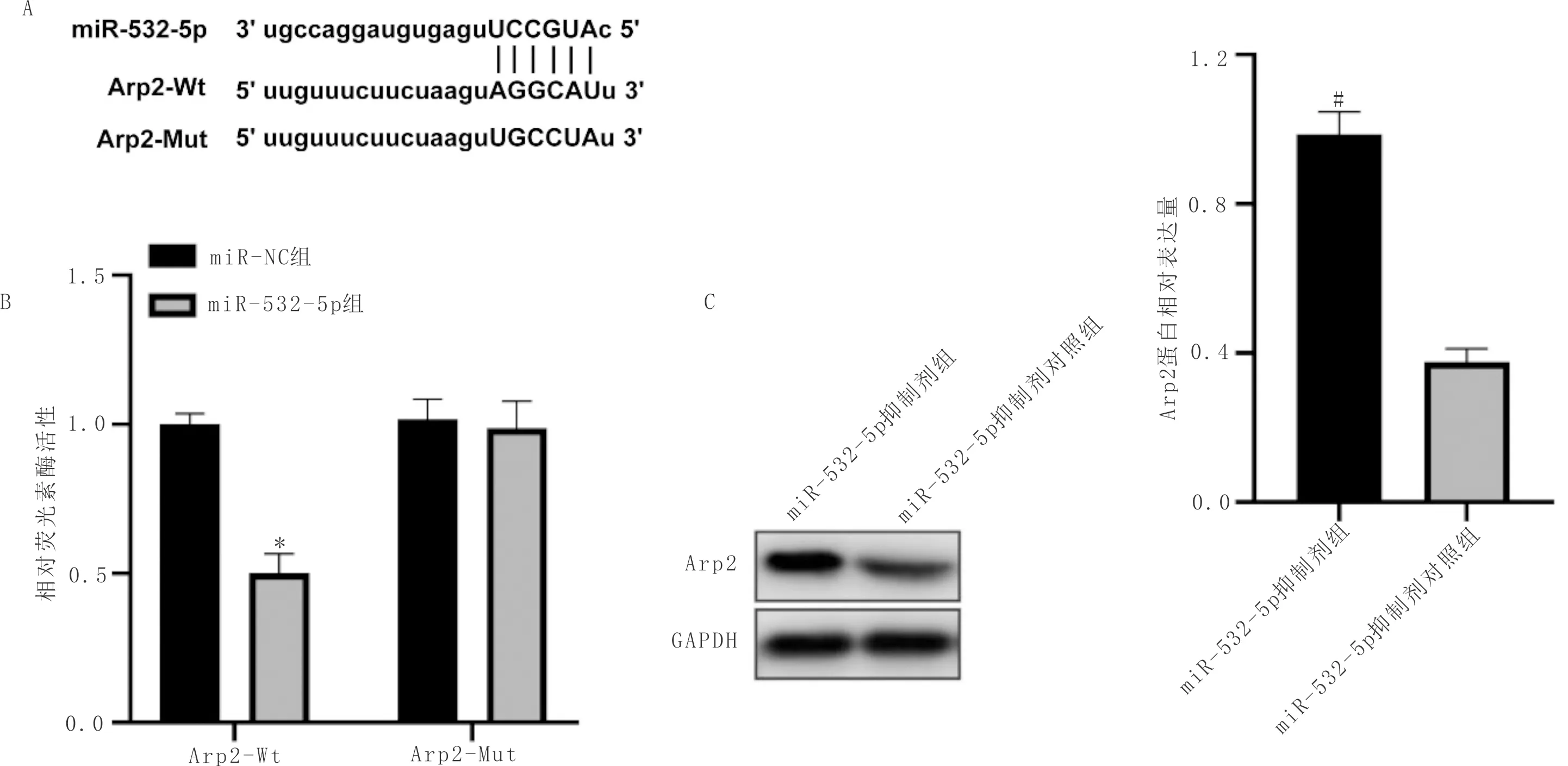
注:A:miR-532-5p和Arp2的结合位点以及Arp2的突变位点;B:双荧光素酶活性检测;C:Western blot检测结果。与miR-NC组比较,*P<0.05;与miR-532-5p抑制剂对照组比较,#P<0.05
4 讨论
中医认为下肢动脉硬化闭塞症主要是由于气血运行受阻,造成气滞血瘀引起的,临床上给予活血化瘀药物可提高治疗效果,改善临床症状。血府逐瘀汤具有活血化瘀、通络补气的功效,已被发现可改善下肢动脉硬化闭塞症患者的临床症状[8,16]。在ox-LDL等氧化应激因子的刺激下,内皮细胞会产生较多的活性分子,如ROS,破坏细胞的氧化-抗氧化平衡,进而引起内皮细胞损伤诱发AS形成[17-18]。SOD是一个重要的抗氧化酶,MDA是脂质过氧化的重要标志物[19-20]。因此,ROS、MDA和SOD是内皮细胞氧化应激的重要标志物[21]。本研究中,血府逐瘀含药血清不仅增加了ox-LDL刺激的HCAECs细胞活力、减少细胞凋亡,还降低了ROS和MDA水平、增加了SOD含量,这表明血府逐瘀含药血清可缓解ox-LDL诱导的内皮细胞氧化应激损伤。
研究显示,miR-532-5p在AS患者血清中低表达,在AS中发挥保护作用[13-14]。本研究中下肢动脉硬化闭塞症患者服用血府逐瘀胶囊一个疗程后血清中miR-532-5p表达上调,这表明血府逐瘀胶囊很可能是通过上调miR-532-5p的表达发挥作用的。Yao等[22]的研究显示miR-532-5p可抑制ox-LDL诱导的人脑微血管内皮细胞氧化应激损伤。本研究发现ox-LDL刺激HCAECs降低了细胞中miR-532-5p表达,而血府逐瘀含药血清可上调miR-532-5p表达。此外,miR-532-5p抑制剂可减弱血府逐瘀含药血清对细胞活力、凋亡和ROS、MDA和SOD含量的影响,这表明血府逐瘀胶囊很可能是通过上调miR-532-5p的表达减轻内皮细胞氧化应激损伤,从而改善下肢动脉硬化闭塞症患者症状的。
miRNAs通过与靶基因mRNA的3′端非翻译区特异性结合,在转录水平负调控相关基因表达[23-25]。Arp2/3复合体在肌动蛋白细胞骨架重塑过程中发挥重要作用[26-27],已发表的文献表明抑制Arp2/3复合体可减弱ox-LDL诱导的HCAECs氧化应激损伤[28]。Arp2是Arp2/3复合体中的一个重要亚基,Starbase生物信息学软件分析显示Arp2是miR-532-5p的一个靶基因,本研究使用双荧光素酶报告基因分析系统验证了miR-532-5p可与Arp2直接结合,而且miR-532-5p抑制剂可上调Arp2蛋白表达,表明Arp2是miR-532-5p的靶基因。本研究还发现,血府逐瘀含药血清可抑制ox-LDL诱导的HCAECs中Arp2蛋白表达。这些结果提示血府逐瘀胶囊在内皮细胞中的作用与miR-532-5p的靶基因Arp2表达被抑制有关。
综上所述,血府逐瘀胶囊可通过上调miR-532-5p抑制其靶基因Arp2的表达,进而抑制ox-LDL诱导的内皮细胞氧化应激损伤,从而缓解下肢动脉硬化闭塞症患者的症状。本研究进一步阐明了血府逐瘀胶囊治疗下肢动脉硬化闭塞症的分子机制,为其临床应用提供了一定的实验依据。
