胃上部癌全胃切除术后肺部并发症预测模型的构建
2023-06-07杨永康刘尚龙高源刘睿清郑龙波解文韬卢云
杨永康 刘尚龙 高源 刘睿清 郑龙波 解文韬 卢云
(青岛大学附属医院胃肠外科,山东 青岛 266555)
胃癌是全球人群发病率和死亡率最高的疾病之一[1],我国胃癌的发病率也在逐年上升,2015年的统计数据显示,胃癌导致的死亡位居癌症死亡的第2位[2]。外科手术目前仍是主要的治疗手段。手术方式包括原发病灶的切除及规范的淋巴结清扫[3-5]。胃上部癌,即肿瘤位于胃的上1/3处,病变累及贲门、胃底及部分胃体部,其病理特征、预后及治疗方法与胃中下部癌明显不同[6-7],近年来,胃上部癌的发病率呈上升趋势[8]。手术治疗是胃上部癌的主要治疗手段,其中最主要的术式是全胃切除术[9],术后肺部并发症(PPCs)是胃癌手术后较常见并发症之一[10-11],是影响患者术后生活质量和生存的重要因素[5]。全胃切除术与近端胃切除术、远端胃切除术相比,手术创伤更大,操作也更加复杂,手术区域距离膈肌和肺更近,PPCs发生率会显著增加。目前仅有较少胃上部癌PPCs发生的影响因素分析,根据影响因素构建的术后预测模型也未见报道。本研究利用单因素及多因素Logistic回归分析明确独立危险因素,并在此基础上构建列线图预测模型,对胃上部癌PPCs发生风险进行预测,为临床诊疗工作提供依据。
1 资料与方法
1.1 一般资料
选取2020年6月1日—2021年9月30日于我院因胃上部癌行全胃切除术的患者197例。患者纳入标准:①术前胃镜活检及术后病理检查明确为胃恶性肿瘤者;②肿瘤位置符合胃上部癌定义者;③根据影像及病理结果,肿瘤无肝脏、肺、骨等远处转移者;④病例资料完整(术前各项检验指标完善及术后诊断是否存在PPCs的依据充足)者;⑤手术术式为全胃切除术者。排除标准:①有胃手术史(包括内镜黏膜下剥离和内镜黏膜切除术等诊断性手术)者;②妊娠或哺乳妇女;③有未控制的癫痫、中枢神经系统疾病或精神障碍史者;④最近5年有其他恶性疾病史者;⑤曾行器官移植需要免疫抑制治疗者;⑥急诊手术者;⑦已参与其他临床试验者;⑧术中中转其他手术方式者。
1.2 患者的相关指标的收集及分组
收集所有患者的临床资料,包括基本信息(年龄、性别、BMI、吸烟史、吸烟时间、饮酒史、ASA分级)、术前合并基础疾病情况(高血压、糖尿病、冠心病、脑梗死、肺部合并症、贫血等)、手术相关信息(手术时间、手术方式、术中失血量、术中是否输血)、既往病史及治疗史(腹部手术史、新辅助治疗史)。根据术后1周内是否发生PPCs将所有患者分为发生组和未发生组。PPCs的诊断依据相关参考文献中的标准[13-15]。
1.3 统计学处理

2 结 果
2.1 影响患者PPCs发生的单因素分析
术后1周,未发生组患者126例,发生组患者71例,其中肺炎46例,胸腔积液50例,呼吸衰竭5例,肺不张26例,气胸2例。
分析结果显示吸烟时间、年龄、术前合并高血压、糖尿病、术前肺部合并症、吸烟史、术中输血、BMI>26 kg/m2以及术前血清白蛋白<35 g/L为胃上部癌全胃切除术后发生肺部并发症的危险因素(P<0.05)。见表1。
2.2 多因素Logistic回归分析胃上部癌全胃切除术PPCs发生的独立危险因素
将单因素分析中有差异指标作为自变量,以是否发生PPCs为因变量,进行多因素Logistic回归分析,各自变量赋值如下,年龄(原值输入)、吸烟时间(原值输入)、高血压(是=1、否=0)、糖尿病(是=1、否=0)、术前肺部合并症(是=1、否=0)、吸烟史(是=1、否=0)、术中输血(是=1、否=0)、BMI>26 kg/m2(是=1、否=0)以及术前血清白蛋白<35 g/L(是=1、否=0),结果显示,年龄、糖尿病、吸烟史、术前血清白蛋白<35 g/L及BMI>26 kg/m2为胃上部癌全胃切除术PPCs发生的独立危险因素。见表2。
2.3 胃上部癌PPCs列线图预测模型构建及验证
利用上述胃上部癌全胃切除术PPCs的独立危险因素构建列线图预测模型,详见图1A。该列线图预测模型的ROC曲线下面积为0.806(95%CI=0.746~0.817)(图1B),在二分类Logistic回归分析中,C指数等于AUC(0.806);预测模型校准曲线显示,实际模型与理想模型、矫正模型的拟合优度较高,即校准曲线与实际曲线吻合度高,且均接近理想曲线,说明该预测模型稳健性较强(图1C)。构建的DCA曲线图结果显示,当阈概率在0.12~0.85时,患者的临床净获益均较高,说明该预测模型具有良好的临床获益度,临床实用性较好(图1D)。
3 讨 论
目前国内外关于胃癌术后并发症的研究往往并不区分肿瘤发生的位置,针对具体胃上部癌的术后并发症的相关研究较少;目前已有的胃上部癌相关研究也主要是关于手术方式的探讨,缺乏胃上部癌全胃切除PPCs的相关研究。而胃PPCs发生率高,对患者预后的影响较大。本研究中纳入的胃上部癌全胃切除PPCs发生率约为36%,略高于既往PPCs相关的研究结果[16-17],考虑与胃上部癌手术操作均靠近膈肌,对肺部影响效果体现更为明显所致。
本研究的结果显示,高龄是胃上部癌全胃切除PPCs发生的独立危险因素,与之前的研究结果一致[18-19]。分析原因可能为:①老年患者术后恢复能力差,卧床时间长,增加PPCs发生的风险;②老年患者咳嗽咳痰能力较差,术后切口疼痛抑制呼吸等因素联合作用增加了老年患者PPCs发生率。③老年患者往往合并许多慢性基础性疾病(如心脑血管合并症)、内分泌疾病(如糖尿病)等,这也是高龄增加PPCs发生风险的一个重要原因。因此对于高龄患者,应术前完善心脏、肺部和脑部等相关检查,对术前的合并疾病应积极治疗及控制,围术期加强护理,以降低高龄患者PPCs发生率。

表1 影响患者PPCs发生的单因素分析

表2 多因素Logistic回归分析结果
本研究结果显示,吸烟史是胃上部癌全胃切除术PPCs发生的独立危险因素。研究显示,长期吸烟会损害肺功能,并对人体产生不良影响,PPCs以及其他种类并发症的发生率均呈现明显上升[20-22];AKUTSU等[23]研究显示,吸烟是食管术后肺部感染的高风险因素,与不吸烟者相比,吸烟者手术后并发症的相对风险从1.4倍增加到4.3倍。韩晓光等[24]研究发现,吸烟史是胃癌根治术后发生肺部感染的独立危险因素,且术前2周戒烟者术后肺部感染发生率明显低于术前2周未戒烟者,分别为8.1%及21.1%。提示吸烟是PPCs高度相关的危险因素。为降低手术患者PPCs发生率,务必做好围手术期宣教工作,强调戒烟的必要性。
本研究结果显示,患者BMI>26 kg/m2是术后发生PPCs的独立危险因素,与FUJITANI等[25]和胡建昆等[26]的研究结果一致。高BMI患者由于脂肪堆积,膈肌下降能力受限、胸壁顺应性降低而机体耗氧量明显增加,术前体质量过大会明显增加患者PPCs发生风险,对术前体质量过大的患者,应强调减轻体质量,并监测体质量变化。
多项研究显示,术前白蛋白水平低下是胃肠道手术后并发症的独立危险因素。术后患者处于高应激及高消耗状态,易发生低蛋白血症,严重影响患者的病情恢复。本研究显示,术前低白蛋白水平也是发生PPCs的独立危险因素。对于胃上部癌全胃切除手术患者,应注意加强营养,术前梗阻症状不能进食或进食量明显减少患者,应积极应用肠外营养支持[27]。术后根据患者病情恢复情况,恢复肠内营养。
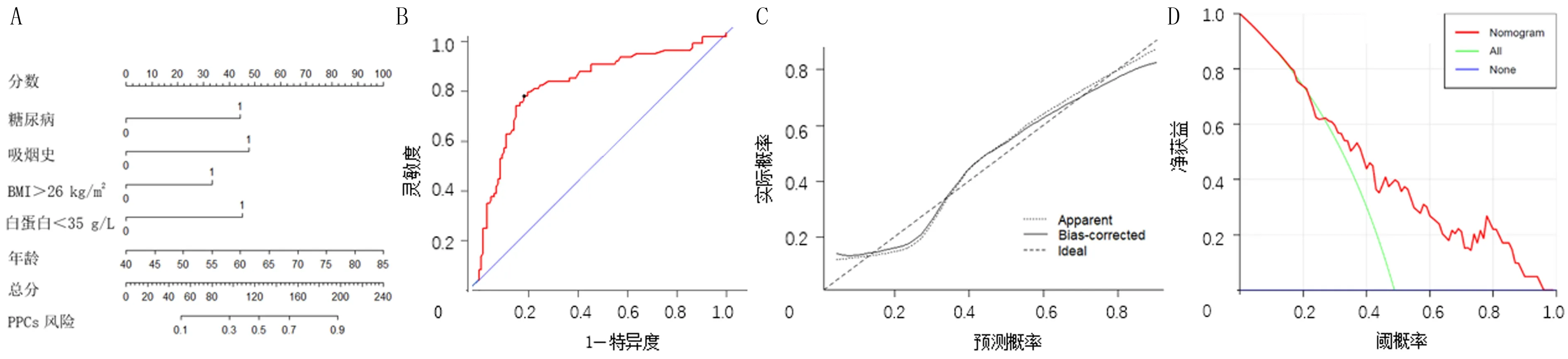
A:胃上部癌PPCs列线图预测模型,B:胃上部癌PPCs列线图预测模型ROC曲线图,C:胃上部癌PPCs列线图预测模型校准曲线,D:胃上部癌PPCs列线图预测模型DCA曲线
在本研究中,术前合并糖尿病为胃上部癌手术PPCs发生另一独立危险因素。研究显示,糖尿病患者术后多种并发症发生率较非糖尿病患者高[28]。糖尿病患者由于血糖升高,机体免疫水平降低,肺组织结构损伤和功能下降,利于呼吸道病原菌的生长,易发生肺部感染[29]。故对于术前合并糖尿病及高糖血症的患者,手术前后的血糖水平监测及控制非常重要。对出院患者的糖尿病相关宣教也是降低PPCs发生的有效举措。
本研究在多因素Logistic回归分析获得的独立危险因素基础上,建立了胃上部癌全胃切除PPCs发生率的列线图模型,该模型能更加直观和快速地预测患者PPCs发生风险;预测模型的校准曲线、DCA曲线显示,该模型稳健性较强,临床实用性较好。提示本研究构建的预测模型对临床实践有重要的指导意义。
本研究的创新点主要有:①首次对胃上部癌这一特定部位胃癌手术PPCs的相关因素进行分析,并构建了预测模型。②以列线图形式构建预测模型,可视性强,通俗易懂,且临床应用便捷,便于临床推广应用。本研究的不足之处:①本研究中纳入数据均为青岛大学附属医院单中心数据,且样本量较少;②因我院胃上部癌患者术中均采用气管插管全身麻醉,故麻醉方式等指标并未纳入分析中,对结果可能会产生一定影响。
综上所述,糖尿病、吸烟史、年龄、术前血清白蛋白<35 g/L及BMI>26 kg/m2是胃上部癌全胃切除PPCs发生的独立危险因素,构建的列线图预测模型具备良好的预测效能及临床实用性。该预测模型可以辅助临床医护人员进行决策,以此降低患者PPCs的发生率。
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL27152)。受试对象或其亲属已经签署知情同意书。
作者声明:卢云、杨永康、刘尚龙参与了研究设计;杨永康、高源、刘睿清、郑龙波、解文韬参与了论文的写作和修改。所有作者均阅读并同意发表该论文。所有作者均声明不存在利益冲突。
