螺旋藻中分析级藻蓝蛋白的高效制备
2023-06-07曹雷鹏李聪苗黄正花冯硕儒樊瑞娟刘玉环
关 瑞,王 玉,曹雷鹏,李聪苗,黄正花,冯硕儒,周 悦,樊瑞娟,刘玉环
(南昌大学食品科学与工程国家重点实验室,生物质转化教育部工程研究中心,江西 南昌 330047)
螺旋藻因其营养价值高而被广泛应用于人类和动物健康补充剂中,如食品和饲料、药品和个人护理等,其所有的功能性成分中,蛋白质的含量最高(高达干重的60%~70%),其中必需氨基酸含量高达8%,是营养全面的纯天然蛋白质食品源[1-2]。螺旋藻中藻胆蛋白根据吸收光谱差异主要分为藻蓝蛋白(C-phycocyanin,C-PC)、别藻蓝蛋白(A-phycocyanin,A-PC)及藻红蛋白(R-phycocyanin,R-PC),其中藻蓝蛋白占螺旋藻干重的20%,可作为天然色素用于食品、化妆品等[3]。藻蓝蛋白是一种多链全蛋白,主要由α-亚基(两个半胱氨酸和两个甲硫氨酸残基)和β-亚基(3个半胱氨酸和5个甲硫氨酸残基)组成,其中每个亚基含有160~180个氨基酸序列,而α3β3环状三聚体和(α3β3)2六聚体为藻蓝蛋白的主要存在形式[4]。同时,藻蓝蛋白的发色团主要来源于藻蓝素(线性四吡咯化合物),通过硫醚键与载体蛋白连接。C-PC溶液呈现水钴蓝而A-PC溶液为亮水蓝,C-PC和A-PC最大吸收波长分别在620和652 nm[5]。C-PC是一种被广泛开发的藻蓝蛋白类的天然蓝色化合物,根据其620 nm的特征峰值吸光度与280 nm的蛋白质吸光度之比的纯度等级进行划分,当A620/A280≥为0.7时,CPC为食品级;当A620/A280为0.7~3.9时,C-PC为试剂级;当A620/A280≥为4.0时,C-PC为分析级[6]。C-PC的纯度越高,其商业价值越高,食品级C-PC的价格在于0.9元·mg-1,而分析级C-PC的价格约105元·mg-1[7]。此外,先前的文献报道高纯度的藻蓝蛋白具有抗炎、抗氧化性、抗肿瘤、免疫荧光性等生物活性,可作为药物成分用于医疗保健无毒副作用的天然理想物质[8-9],因此大量的高纯度藻蓝蛋白成为当前实现藻蓝蛋白高价值应用的迫切需要。
目前研究报道从螺旋藻中提取C-PC的方法有物理、化学、生物等技术,如超声、高压均质、反复冻融、化学溶剂及酶处理法等[10-13]。Wanida[14]等采用螺旋藻粉为原料,采用超声细胞破碎法,10 mmol·L-1磷酸缓冲液、料液比为1:15、功率为750 W、时间5 min,最终得到的C-PC产率和纯度分别为60 mg·g-1和0.52。Tavanandi[15]等以螺旋藻干粉为原料,采用冻融法提取藻蓝蛋白,提取条件:0.1 mol·L-1磷酸缓冲液、料液比1:8、浸泡4 h、冻融4 h、解冻1 h,得到C-PC得率和纯度分别为73.73 mg·g-1和0.66。目前C-PC提取方法都存在一定的缺陷,如单独使用超声细胞破碎法或冻融法所提取的C-PC产率和纯度均比较低,且冻融法耗时较长,化学法和酶处理法成本较高。C-PC的纯化技术主要有盐析[16]、柱层析[17]、双水相萃取[15]、膜过滤[18]等。Marina[19]等利用50 kDa聚醚砜膜超滤藻蓝蛋白粗提液,C-PC纯度提高至1.5,之后经过离子交换柱,最终得到C-PC纯度为3.9,其回收率为79.7%。Ravi[20]等将超声波细胞破碎提取的C-PC粗提液,经过20%、70%硫酸铵两步沉淀,再经过DEAE-Cellulose阴离子交换柱层析,得到纯度为4.03的分析级C-PC。现有的C-PC分离纯化技术存在不稳定、不适合大规模应用、回收率不高等问题[21],为了促进藻蓝蛋白的深加工及其高价值应用,低成本高效快速生产高纯度藻蓝蛋白成为当前主要研究方向。
因此,本论文研究目的主要通过超声耦合高压均质法以低成本高效提取C-PC,并利用盐析-透析及柱层析方法纯化C-PC,以提高C-PC的纯度,同时采用SDS-PAGE和色泽分析鉴定所获得的分析级C-PC的分子量及色泽,为螺旋藻藻蓝蛋白的低成本高效生产及其高价值应用提供技术支撑。
1 材料与方法
1.1 原料、试剂与仪器
螺旋藻干藻粉原料(江西中藻生物科技有限公司);硫酸铵、氯化钠、氯化钡等均为分析纯(广州西陇科学股份有限公司);透析袋(8 000~14 000 Da,北京索莱宝科技有限公司);葡聚糖凝胶柱G-75(北京索莱宝科技有限公司);电泳试剂盒(北京索莱宝科技有限公司);低分子量Marker(北京索莱宝科技有限公司)
紫外可见分光光度计(UV-9000,上海元析仪器有限公司);台式高速冷冻离心机(H1850R,湖南湘仪实验室仪器开发有限公司);电脑紫外层析仪(HD-3001,上海嘉鹏科技有限公司);高压均质机(GJJ-0.06/100,上海台驰轻工装备有限公司);超声波细胞粉碎机(宁波新芝生物科技股份有限公司);电泳系统(Bio-BAD公司);凝胶成像分析仪(WD-9413C,北京六一生物科技有限公司);色差仪(TS7700,深圳市三恩时科技有限公司)。
1.2 藻蓝蛋白的提取方法及条件优化
1.2.1 高压均质提取
取50.0 g螺旋藻粉,添加1.0 L超纯水制备螺旋藻溶液,后于高压均质机连续处理3次,处理压力分别为0、20、40、60、80 MPa,处理后的藻浆于8 000 r·min-1条件下离心10 min。取上清液进行全波长扫描(200~800 nm)并测定620、280、652 nm处的吸光度,并计算不同压力下提取藻蓝蛋白的产率和纯度,以上实验重复3次。
1.2.2 超声提取
取50.0 g螺旋藻粉于2.0 L烧杯中,之后加入1.0 L超纯水。在超声功率为390 W,超声2 s后间歇2 s的条件下,分别破碎1、2、3、4、5、6 min,超声细胞破碎于4 ℃的水浴中进行以防止过热。超声结束后样品于4 ℃、8 000 r·min-1条件下离心10 min,取上清液进行紫外全波长扫描(200~800 nm)并测定620、280、652 nm处的吸光度,计算不同的超声时间所得藻蓝蛋白的产率和纯度,以上实验重复3次。
1.2.3 超声耦合高压均质法提取藻蓝蛋白
超声破碎法提取藻蓝蛋白的最佳条件为超声功率为390 W,超声2 s后间歇2 s,总处理时间为2 min;高压均质法提取藻蓝蛋白的最适处理压力为60 MPa连续处理3次。取50.0 g螺旋藻粉于2.0 L烧杯中,之后加入1.0 L超纯水搅拌均匀后,于超声破碎/高压均质法的最佳条件下进行细胞破碎,将破碎的溶液于4 ℃、8 000 r·min-1条件下离心10 min,取上清液进行全波长扫描(200~800 nm)并测定620、280、652 nm处的吸光度,计算所得藻蓝蛋白的产率和纯度[22],以上实验重复3次。
1.2.4 藻蓝蛋白(C-PC)含量与纯度测定
将所得样品测定620、280、652 nm处的吸光度,并根据公式1~3计算藻蓝蛋白的浓度、产率及纯度[13]:
Purity=A620/A280
(1)
C(mg·mL-1)=(A620-0.474A652)/5.34
(2)
C-PC产率(mg·g-1)=C*V/m
(3)
式中:A620 nm,A280 nm,A652 nm分别为藻蓝蛋白溶液在620,280,652 nm处的吸光度,C为藻蓝蛋白体积浓度(mg·mL-1),m为螺旋藻藻粉质量(g),V为藻蓝蛋白溶液体积(mL)。
1.3 藻蓝蛋白的盐析及透析处理
处理所得的藻浆于冷冻离心机4 ℃、8 000 r·min-1转速下离心10 min,取上清液,添加硫酸铵至10%、11%、12%、13%、14%、15%硫酸铵后,4 ℃避光保存6 h后于8 000 r·min-1转速下离心10 min,所得到的上清液继续补加硫酸铵至50%后,在4 ℃避光保存6 h后,并在4 ℃、8 000 r·min-1下离心10 min,最后将所得沉淀采用透析袋(8 000~14 000 Da)透析12 h,用氯化钡检验透析终点。
1.4 藻蓝蛋白柱层析纯化
采用葡聚糖凝胶柱G-75对透析脱盐后的样品进一步纯化。首先将葡聚糖凝胶干粉浸泡于蒸馏水中24 h,使其充分溶胀,柱形为2 cm×50 cm,柱床高30 cm。用pH 7.0的PBS缓冲液冲洗葡聚糖凝胶柱床,使填料达到阴阳离子平衡。将透析过夜后的样品用0.1 mol·L-1的NaCl进行梯度洗脱(洗脱速度为0.5 mL·min-1),每5 min收集1管。分别测定收集样品在620、280、652 nm处的吸光度并计算藻蓝蛋白的浓度和纯度。再将所得到纯度最高的组分进行200~800 nm全波长扫描。
1.5 SDS-凝胶电泳
分离胶质量分数为15%,浓缩胶质量分数为5%。样品在浓缩胶中的电泳仪电压为80 V,电泳30 min,再将电压变为120 V,电泳120 min。电泳结束之后,采用考马斯亮蓝染色30 min,用乙酸:乙醇:水=1:1:8的脱色液脱色,直至颜色脱净为终点。
1.6 色泽的测定
色泽的测定采用TS7700色差计,测色光源为D65光源,光斑直径为8 mm,均匀选取5个测量点,色差计经黑白色板校正后,测定各个测量点的L*a*b*值并取平均值,其中:L*代表样品的明度,其值范围为0~100;a*代表绿红值,其值范围为-120~+120;b*代表样品的蓝黄值,其值范围为-120~+120[23]。
1.7 实验处理与数据统计方法
实验数据的统计与分析采用Origin Pro 9.0和SPSS 9.0软件。对所有数据进行单因素方差分析,每组实验重复3次以上确保数据的准确性。不同字母代表数据之间存在显著差异(P<0.05)。
2 结果与分析
2.1 高压均质提取藻蓝蛋白
高压均质法是一种用于细胞破碎的快速方法,主要通过用高压的方法对细胞膜进行破碎,最终使得细胞内成分流出[24]。图1A中显示为50 g·L-1螺旋藻的藻溶液在不同压力处理连续处理3次后获得的藻蓝蛋白产量及其纯度。结果显示C-PC的产率随处理压力的增加而显著上升,并在60 MPa达到最大值88.15 mg·g-1,之后随着压力的继续升高无显著性差异。此外,C-PC纯度(A620/A280)在随着压力的升高而显著上升,20~60 MPa之后维持在0.63~0.66(<0.7),随着压力的进一步提高至80 MPa,其纯度降低至0.53左右,其主要原因可能是随着处理压力的增加,对细胞壁及细胞膜的破坏逐渐加大,导致细胞中C-PC溶出较多,最终使得C-PC产量提高[15]。在0~20 MPa,随着压力的提高,细胞内藻蓝蛋白的溶出显著提高,使得C-PC纯度也显著提高至最大值,之后随着处理压力增加至80 MPa,细胞壁破坏程度进一步加大,细胞内的核酸、糖类、脂质等物质释放,使C-PC纯度下降。图1B为60 MPa所获得的螺旋藻C-PC紫外扫描图(200~800 nm),结果显示C-PC于620 nm处具有最大吸收峰,与先前报道藻蓝蛋白的特征峰基本一致,表明60 MPa处理螺旋藻对藻蓝蛋白结构无影响。因此,综合考虑提取能耗成本效益,选择60 MPa作为高压均质法提取螺旋藻C-PC的最适压力。

F/MPa

λ/nm图1 不同处理压力对C-PC产率纯度的影响及紫外扫描图(60 MPa)Fig.1 Effect of different treatment pressure on purity and yield of C-PC and UV scanning (60 MPa)
2.2 超声法提取藻蓝蛋白
超声波细胞破碎通过超声波破坏生物组织的细胞壁,促进细胞壁内可提取化合物的释放,增强溶剂从连续相中进入细胞,增加细胞内化合物的释放而增加提取细胞内物质的得率[25]。图2A显示超声时间对藻蓝蛋白产量及纯度的影响。结果表明C-PC产率在前2 min内显著上升至81.29 mg·g-1,之后在2~4 min内产率无显著性差异,随着时间的进一步延长至6 min后期,产率显著下降至68.62 mg·g-1。由于超声波具有的空化效应和机械效应,可在极短的时间内,击碎细胞壁,促使细胞内物质外流[26],提高C-PC的溶出度因而C-PC得率增加。2~4 min条件下随着时间增加超声波对细胞壁的破坏没有显著影响,得率几乎不变。随着超声时间的延长(4~6 min),体系可能产生过多的热量,引起C-PC变性,导致得率下降。同时,随着超声时间的延长,细胞内的杂质持续浸出,C-PC纯度(A620/A280)由0.6显著下降至0.48(图2A)。图2B为超声2 min所获得的螺旋藻C-PC紫外扫描图(200~800 nm),结果显示C-PC于620 nm处具有最大吸收峰,与先前报道藻蓝蛋白的特征峰基本一致,表明超声2 min处理螺旋藻对藻蓝蛋白结构无影响。因此,综合考虑提取能耗成本效益,选择2 min作为超声法提取藻蓝蛋白的最适时间。
2.3 超声-高压均质联用法提取藻蓝蛋白
图3显示了高压均质和超声处理的最佳条件下,高压均质耦合超声法提取螺旋藻藻蓝蛋白效果。由图3A可知,高压均质耦合超声提取所获得的C-PC产率显著高于高压均质或超声提取,但其纯度显著低于高压均质或超声提取。超声处理后高压均质提取C-PC产率达到最大值(131.2 mg·g-1),其次是高压均质+超声处理(124.3 mg·g-1)、高压均质(86.85 mg·g-1)、超声处理(82.96 mg·g-1),比高压均质和超声提取所得产率分别提高了51.07%和58.15%。其主要的原因在于高压均质耦合超声法对细胞壁和细胞膜的破坏程度远高于单独处理,蛋白质、核酸、叶绿素、多糖等细胞内容物大量溶出,最终导致藻蓝蛋白含量显著提高,而其纯度达到最低值(0.69)[15]。该结果表明该耦合方法提取藻蓝蛋白效率远高于先前文献报道,Tavanandi[15]等采用4次冻融4 h法提取的藻蓝蛋白产率为73.73 mg·g-1;Pan-utai[26]等利用超声法提取5 min后所得藻蓝蛋白产量为60 mg·g-1;Ilter[27]等采用均质法获得的C-PC产率为67.61 mg·g-1;Kaferbock[28]等采用脉冲电场处理7 h所得C-PC产率为119.48 mg·g-1。因此,为获得较高藻蓝蛋白产率,后续实验采用超声法+高压均质作为C-PC的最适提取方法。

t/min

λ/nm图2 超声处理对C-PC产率纯度的影响及紫外扫描图(2 min)Fig.2 Effect of ultrasonic treatment on the yield and purity of C-PC and UV scanning (2 min)
图3B显示了4种方法所得C-PC的紫外全波长扫描结果,结果显示中显示4种提取方法得到的样品都有4个吸收峰,分别在280、400~450、620、670 nm。先前研究表明280 nm为蛋白质特征吸收峰,400~450 nm为类胡萝卜素的特征吸收峰,620 nm为藻蓝蛋白的特征吸收峰,而670 nm为叶绿素的特征吸收峰[29]。由3B可知4种方法提取的样品在280、620 nm处都有较高的吸收峰,表明提取物中主要的物质为藻蓝蛋白;且超声+高压均质提取的样品吸收峰都高于其他3条曲线,说明该提取方法所得的C-PC得率最高,但其含有的杂质较多,其纯度低于其余3种提取方法,这与图3A的结果是一致。

t/min

λ/nm图3 不同处理方法对藻蓝蛋白产率纯度及紫外吸光度的影响Fig.3 Effects of treatment methods on the purity and yield of phycocyanin and UV scanning
2.4 硫酸铵盐析及透析纯化藻蓝蛋白
利用硫酸铵对C-PC进行纯化的原理是盐溶和盐析。低浓度的硫酸铵包围着蛋白质分子,蛋白质分子将被盐化(溶解)。高浓度时,盐离子强度很强,更容易与水分子结合,盐与水分子的结合导致蛋白质分子之间的吸引力增加,从而使蛋白质分子发生疏水相互作用,降低溶解度因而形成沉淀[30]。由图4可知,C-PC的纯度随着硫酸铵浓度的增加,呈先上升至后下降的趋势。当硫酸铵浓度为12%时,C-PC纯度(A620/A280)达到最大值(1.09),之后显著下降至0.76。此外,随着硫酸铵浓度的增加,上清液中C-PC的回收率在硫酸铵浓度为10%~12%保持不变在90%左右,之后随着硫酸铵浓度提高至15%,C-PC的回收率显著下降至69.5%左右。其主要的原因可能是由于盐溶原理,刚开始时硫酸铵能够使杂质(叶绿素、类胡萝卜素等)沉淀下来,而目标产物不会损失故在上清液中C-PC的回收率不变而纯度增加。随着硫酸铵浓度的增加(>12%),过多的硫酸铵能够让C-PC沉降下来使目标产物损失,上清液中C-PC回收率下降。因此,本实验采用12%硫酸铵作为盐析的第一步对藻蓝蛋白进行溶解,之后添加硫酸铵浓度至50%使得C-PC完全沉淀以进行后续的纯化。

硫酸铵浓度/%图4 硫酸铵浓度对藻蓝蛋白纯度和回收率的影响Fig.4 Effect of ammonium sulfate concentration on the purity and recovery rate of phycocyanin
2.5 葡聚糖凝胶G-75纯化藻蓝蛋白
凝胶柱层析主要根据蛋白质相对分子质量不同从而对蛋白质进行分离纯化。先前研究表明C-PC在结构上由两条多肽链组成,即α单位(13~20.5 kDa)和β单位(11~24.4 kDa)[30]。葡聚糖凝胶G-75的分离范围大约在3~80 kDa,因此,本实验选择葡聚糖凝胶G-75对C-PC进行纯化。图5a为C-PC在吸光度为280和620 nm时的洗脱曲线。洗脱时间25 min时,在280和620 nm处均出现洗脱峰,而在620 nm的吸光度值远远大于在280 nm的吸光度,其纯度A620/A280达到最大值为4.20(分析级>4.0),其可能的原因是分子量比较大的杂蛋白经过葡聚糖凝胶柱G-75柱所需要时间较短,而分子量比较小的杂蛋白所需要的时间较长,杂蛋白与C-PC被分开[29],导致280 nm处吸收峰下降。通过柱层析的方法可将杂蛋白和C-PC分开以提高C-PC的纯度。因此,25 min作为葡聚糖凝胶G-75层析柱纯化藻蓝蛋白的最佳时间。
图5b显示藻蓝蛋白经过葡聚糖凝胶柱G-75洗脱25 min后收集的样品紫外扫描图,在620 nm处的吸光度出现了大幅度上升,而在280 nm处的吸光度出现了轻微的下降,其主要原因为经过葡聚糖凝胶G-75后杂蛋白质被进一步去除,故280 nm处吸光度下降,300~400 nm处出现微弱的峰可能是蛋白质中二硫键的吸收引起的。经过葡聚糖凝胶柱G-75,C-PC纯度由原来的0.85进一步提升至4.2,达到了分析级纯度。
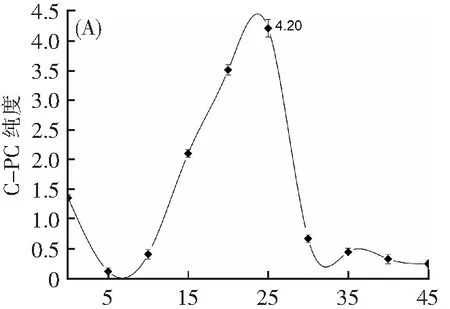
洗脱时间/min

λ/min图5 葡聚糖凝胶G-75洗脱曲线及过柱前后紫外扫描图Fig.5 Elution curve of dextran gel G-75 and UV Scanning of C-PC
2.6 分析级藻蓝蛋白的SDS-PAGE及色泽
超声-高压均质提取所得的粗藻蓝蛋白提取液经两步盐析、透析及25 min柱层析后,纯化的样品进行冷冻干燥,所得分析级藻蓝蛋白产率为107.65 mg·g-1,纯度为4.23,其回收率达到了82.05%。图6显示了分析级藻蓝蛋白SDS-PAGE和色泽。由图6a可知,经过盐析后透析的藻蓝蛋白的电泳泳道的条带比较多而且不明显,表明所得到的样品的杂质较多且纯度较低,而经过葡聚糖凝胶G-75柱层析纯化后的藻蓝蛋白电泳条带较少且清晰,表明杂质通过柱层析大部分全部被去除,因而电泳条带显示出目标蛋白质,纯化效果理想,这与图4和图5a所得到的藻蓝蛋白纯度结果一致。此外,通过与Marker样品对比评估,C-PC的分子量约为17 kDa,这与先前文献等所报道的分子量基本一致[31]。图6b显示了柱层析纯化后所获得的藻蓝蛋白色泽值,其亮度(L*值)为58.07,红度(a*)为-15.44,黄度(b*)为-17.86,该结果可能与先前报道的结果有差异,其可能与藻蓝蛋白的纯度和浓度、藻种有关[32]。
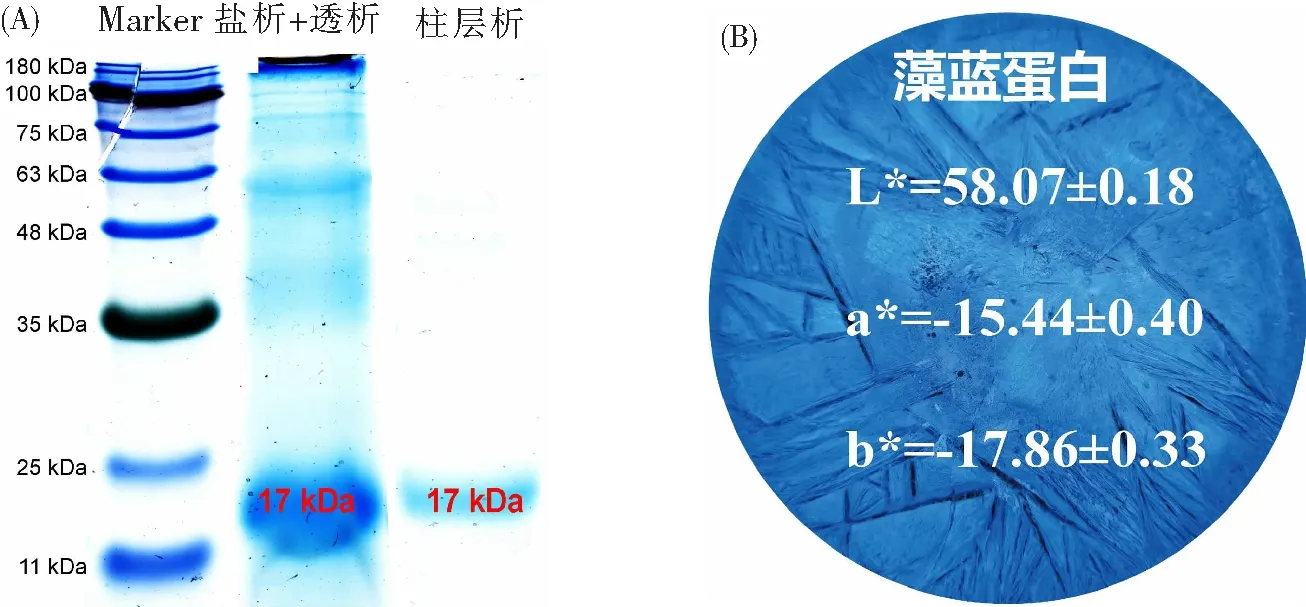
图6 SDS-PAGE电泳图和藻蓝蛋白色泽Fig.6 SDS-PAGE electrophoresis diagram and color of C-PC
3 结论
本文通过研究螺旋藻分析级C-PC的分离纯化工艺,以低成本高效生产分析级C-PC。首先分别优化高压均质处理压力和超声法的超声时间,并将二者的最佳条件联用,比较不同处理方法下C-PC的得率和纯度。结果显示超声-高压均质处理提取C-PC产率最高,其提取率分别比单独使用高压均质和超声处理提高了51.07%和58.15%,且高于先前报道的。优化了硫酸铵对藻蓝蛋白的盐溶浓度(12%)及盐析浓度为50%。超声-高压均质法的藻蓝蛋白粗提液经过硫酸铵两步沉淀、透析和25 min葡聚糖凝胶柱G-75柱层析法进行纯化后,藻蓝蛋白产率和纯度分别为107.65 mg·g-1和4.23(>4.0),其回收率达到82.05%。此外,采用SDS-PAGE对纯化后C-PC进行纯度及分子量(17 kDa)进行验证,与先前报的结果基本一致。本文通过对传统提取纯化工艺上进行改进,以高效低成本快速生产分析级C-PC,为螺旋藻分析级藻蓝蛋白的广泛应用提供技术支撑。
