典型大气压冷等离子体射流的剂量评估
2023-06-07赵潞翔罗岚月张子明李和平
李 静,赵潞翔,罗岚月,张子明,何 涛,袁 月,张 宇,*,李和平,*
(1.清华大学a.工程物理系;b.机械工程系;c.医学院;d.药学院,北京 100084;2.中国空气动力研究与发展中心空气动力学国家重点实验室,四川 绵阳 621000)
大气压冷等离子体(Cold atmospheric plasma,CAP)具有显著的非平衡特性,被广泛应用于多个领域,目前已经形成了等离子生物医学[1]、等离子体农业[2]等多个交叉应用领域。在上述等离子体的实际应用中,研究发现不同强度的CAP处理会导致具有显著差异的实际作用效果。因此,迫切需要引入“等离子体剂量”这一概念来对CAP作用强度进行定量化描述,从而有助于对实际应用中等离子体处理效果的调控和优化,获得符合预期的等离子体材料处理效果。已有研究表明,等离子体物理学和生物医学领域的诸多参数均会对等离子体的作用效果产生显著影响,进而影响对“等离子体剂量”的评估。其中的物理参数包括等离子体发生器的几何结构设计、驱动电源的波形和频率、工作气体化学成分、气体温度、作用距离等[3-11],而从非物理角度出发,被处理生物活体材料的种类、活性与数量、培养基参数[5,6]等同样是重要的影响因素。
尽管等离子体剂量学的研究随着等离子体医学研究的深入而不断深入,但现有研究中仍然主要以物理参数来评估等离子体剂量的大小,其中最常用的是处理时间和放电功率等。例如,2005年,Kieft等的研究结果表明,等离子体短时间作用于哺乳动物细胞并不会对其造成损伤,而延长等离子体处理时间则会导致细胞凋亡[3];Dobrynin等亦采用不同类型的CAP源得到了类似的实验结果[4],即当采用低档功率CAP处理细胞时,细胞几乎不被损伤,而采用中档或者高档功率CAP进行处理后,细胞出现凋亡现象。尽管采用放电功率或处理时间作为等离子体剂量的标度从物理上看来非常直观,但由于实际应用中CAP源的种类丰富,其放电特性与参数范围各不相同。对某一种CAP源的剂量评估方法往往很难适用于其他CAP源,从而使得依赖于作用时间和功率等参数的等离子体剂量评估方法缺乏足够的通用性。近几年来,各国研究者对等离子体剂量学的研究不断深入。比如,Cheng等提出以等离子体的等效总氧化势(Equivalent total oxidation potential,ETOP)作为等离子体剂量的定义方法,并通过实验方法建立了等离子体杀菌效果和ETOP数值的对应关系[5],为等离子体剂量的定义提供了新的思路。此外,由于等离子体与待处理材料间可能存在的物理-化学-生物相互作用十分复杂,为了准确描述等离子体剂量从而调控具体作用效果,有研究者采用机器学习等方法对CAP材料处理效果进行实时控制和优化[8-11]。最近,Li等则结合药学中“半数致死剂量(Median lethal dose,LD50)”的概念和体外细胞培养实验,提出了一种通用、便捷且可操作性强的CAP剂量评估方法,即LD50-等离子体剂量评估方法[12]。综合考虑上述各种表征等离子体剂量的方法,可以看到,等离子体放电功率和处理时间这两个参数无法从本质上反应等离子体剂量,仅能作为适用于特定CAP源的经验参考;基于ETOP的剂量学定义需要对活性粒子种类、浓度、氧化电位及其他可能产生等离子体生物学效应的因素进行精确的计算或实验测量[13];而LD50-等离子体剂量评估方法无需考虑复杂的等离子体活性成分及其与被处理材料间的相互作用,不受限于等离子体参数,而是直接利用体外细胞实验结果对等离子体剂量进行表征,但有关作用于生物体的不同CAP源的有效功率的确定,以及等离子体对不同细胞系的作用剂量等问题,亦需开展深入的研究。总之,一个合理的等离子体剂量定义方法,应该满足通用性强、重复性好、操作简单、成本低等基本要求,从而建立起不同类型CAP源作用效果与其工作参数之间的定量关系,为调控和优化CAP的实际作用效果提供指导。特别地,此处的通用性指的是剂量学的定义方法应该不依赖于具体的CAP源结构设计和工作参数,以及对等离子体-生物体复杂相互作用过程的解析。
本论文基于LD50-等离子体剂量评估方法,采用一种以高纯氦为工作气体的典型CAP源,即大气压射频辉光放电(Radio-frequency atmospheric-pressure glow discharge,RF-APGD)等离子体射流来处理人体胚胎肾293(Human embryoric kidnoy 293,HEK293)细胞,获得对应的LD50数值,并与文献[12]中采用大气压介质阻挡放电(Atmospheric-pressure dielectric-barrier discharge,AP-DBD)等离子体射流的实验结果进行了对比和分析。本论文工作进一步验证了LD50-等离子体剂量评估方法的可靠性和便捷性,也为两种典型CAP源在生物医学等领域的实际应用提供了一定的理论指导和剂量参考。
1 材料与方法
1.1 LD50-等离子体剂量评估方法
在药学中,测量LD50值是评估药物毒性的典型方法之一,其数值代表了某种药物可以杀死半数实验对象(如体外细胞、实验动物等)时对应的剂量数值。对于药物来说,药物的剂量一般取其质量或者体积。LD50数值的测量可为药物毒性的定量测试和评估提供重要的依据[14],该数值越大,说明该药物的毒性越低,即这种药物的安全性越高。Li等受到这一概念的启发[12],提出了通过测量CAP射流处理体外培养细胞的LD50数值来定量化评估等离子体剂量的方法,并取有效注入能量与被处理细胞个数的比值(Weff/N)作为剂量单位(mJ·cell-1),形成了一种操作简单但通用性较强的等离子体剂量评估方法。Li等[12]采用如图1(a)所示的同轴型氦气AP-DBD等离子体发生器对体外培养的HEK293细胞进行不同时长的处理,并将细胞存活率(ξ)拟合成了关于等离子体剂量对数值的“S”型曲线(图2),进而得到了细胞存活率为50%时对应的等离子体剂量为34.67 mJ·cell-1。该数值为AP-DBD在生物医学应用中放电功率、处理时间等的选择提供了一定的参考。
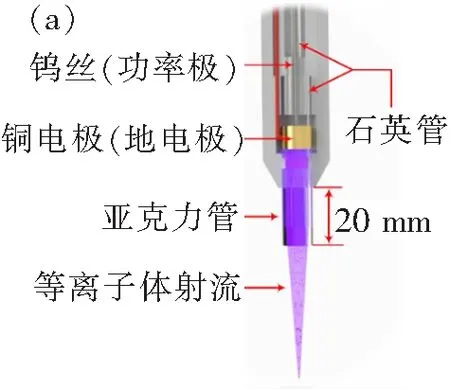
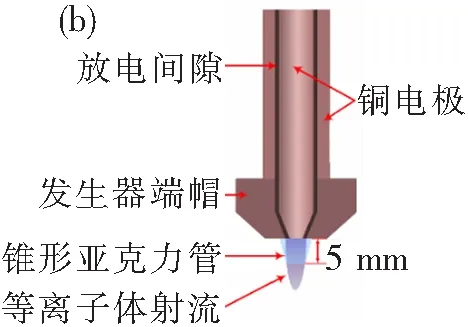
图1 (a) AP-DBD[12]和(b) RF-APGD发生器示意图Fig.1 Schematics of the AP-DBD[12] and RF-APGD plasma generators

log(W/N)/(mJ·cell-1)
1.2 细胞培养
为了使得实验结果具有可对比性,本研究采用的体外培养细胞与Li等相同[12],均为来自北京协和医学院细胞中心的HEK293细胞。经过细胞复苏操作后,在补充10%胎牛血清和1%盘尼西林的DMEM(Dulbecco’s Modified Eagle Medium)培养基(赛默飞世尔科技有限公司)中进行培养。培养基置于37 °C和提供5%CO2的细胞培养箱(赛默飞世尔科技有限公司)中;每隔几个小时在生物倒置荧光显微镜(舜宇集团有限公司,型号:XD)下观察;当观察到细胞达到对数生长期后,将细胞种植到96孔板中,每个细胞培养孔中固定种植5 000个细胞;放入细胞培养箱培养24 h后再进行CAP射流处理。
1.3 实验装置
RF-APGD等离子体具有放电均匀、柔和、稳定性好等特点,是在实际应用中被广泛采用的CAP源之一。本论文采用频率f=13.56 MHz射频电源驱动裸露电极型发生器产生RF-APGD等离子体射流,发生器示意图如图1(b)所示。等离子体发生器具有同轴结构,内外电极材料均为紫铜,内电极直径为12.0 mm,放电间隙为1.6 mm。内电极与射频电源相连,为功率电极;外电极为地电极,在实验中保持接地状态。发生器端帽的作用是调整等离子体流动方向,从而形成类似火焰形状的等离子体射流,便于开展材料处理。为了获得等离子体射流的特性,采用数字示波器(Tektronix,型号:DPO4034)、电压探头(Tektronix,型号:P6015A)和电流探头(Tektronix,型号:TCP0030A)采集了放电过程中的电压-电流波形,采用Z-scan(Advanced Energy Industries,型号:3155135-003)测量放电功率,并采用光纤光谱仪(Avantes多通道光纤光谱仪,型号:AvaSpec-3648)对等离子体的发射光谱特性进行测量。为了避免电路中的分布电感和分布电容对测量结果的影响,电压探头和电流探头的夹持位置要尽可能靠近等离子体发生器的放电区。
本研究采用的等离子体工作气体为高纯氦(含0.5×10-6的氮气杂质),气体流量固定为Q=20 slpm。氦气在内外电极间的环形间隙中沿着发生器的轴向流动,并在外加射频电场的作用下放电形成均匀、稳定的等离子体,随后喷出发生器端帽出口形成等离子体射流,如图1(b)所示。RF-APGD等离子体发生器端帽出口处直径为10 mm,由此喷出的等离子体自由射流直径亦在10 mm量级,大于96孔板中的细胞培养孔直径,从而对自由射流细胞处理的效率产生影响。为了解决这一问题,在发生器出口处外接了长度为5 mm且末端内径与细胞培养孔直径相同(6 mm)的锥形亚克力管,如图1(b)所示。该亚克力管的另一作用是固定实验中等离子体的处理距离为5 mm。这一处理距离与Li等[12]的工作有所不同,将会在后文中给出详细讨论。此处需要说明的是,选择Q=20 slpm这一流量是为了保证发生器出口处气体流速与Li等采用AP-DBD时的气体流速基本一致[12]。
由于RF-APGD的放电电流一般在安培量级,放电过程中的热效应明显,等离子体气体温度会显著高于室温。然而细胞等活体生物材料对外界温度是非常敏感的,当外界温度超过42 ℃时,细胞会发生凋亡[15]。由于Li等采用的AP-DBD发生器产生的等离子体射流温度在20 ℃~24 ℃范围内[12],为了使得实验结果具有可对比性,本研究采用经过液氮冷却的高纯氦气作为工作气体[16],保证得到的等离子体射流温度在20 ℃~24 ℃范围内,避免对细胞产生热损伤。在放电功率Pin=30 W,工作气体流量Q=20 slpm的条件下,将进入发生器的工作气体冷却至THe,in=7 ℃~11 ℃范围内时,在距离发生器出口为5 mm的射流区采用低温温度计(衡水明辉自动化仪器有限公司,型号:DT-180A)测量得到的射流平均气体温度在Tg=20 ℃~24 ℃范围内。此处需要强调的是,本文实验中采用液氮冷却进入发生器的工作气体并不会对射流区的活性粒子的种类和浓度产生明显的影响。这是由于射流区活性粒子主要由电子碰撞的化学反应控制,而仅有部分与重粒子碰撞相关的化学反应速率依赖于气体温度(单位取K)[17],而液氮将气体温度为室温(本文实验中为298 K)的高纯氦冷却至THe,in,平均温差为16 K,相对于室温变化约为5%,对于相关的化学反应速率影响较小。因此,在本文实验中,可近似认为液氮对发生器入口处工作气体的冷却不会对射流区活性粒子的种类和浓度产生显著影响。
RF-APGD等离子体射流细胞处理的完整过程在生物安全柜[海尔,型号:HR30-IIA2(KY)]中完成,其中放置有CAP源支架和三维平移台(米思自动化仪器有限公司,型号:LWX60-1200和LWE4090),分别用于放置图1(b)所示的RF-APGD等离子体射流发生器和种植体外培养细胞的96孔板。
1.4 细胞致死率测量
利用RF-APGD等离子体射流对96孔板中的体外培养细胞进行不同时间的处理,以对比不同剂量等离子体处理对细胞存活率的影响。CAP射流处理完成后,装有HEK293细胞的96孔板被置于细胞培养箱中培养24 h,再利用MTT试剂盒(北京雷根生物技术有限公司)和酶标仪获得每个细胞培养孔中的吸光度,进而计算得到每个孔中的细胞存活率(ξ),即
(1)
其中,A为吸光度数值,Acontrol为对照组对应的吸光度数值,下标t为处理时间,单位为分钟(min)。对照组细胞不进行RF-APGD等离子体射流处理,其他培养条件与实验组细胞完全一致。
1.5 统计学分析方法
细胞存活率实验数据以均数±标准差表示,并采用统计软件Prism进行单因素方差分析(ANOVA),其中,****p<0.000 1代表统计学上有着显著差异。
2 实验结果与分析
2.1 RF-APGD等离子体特性
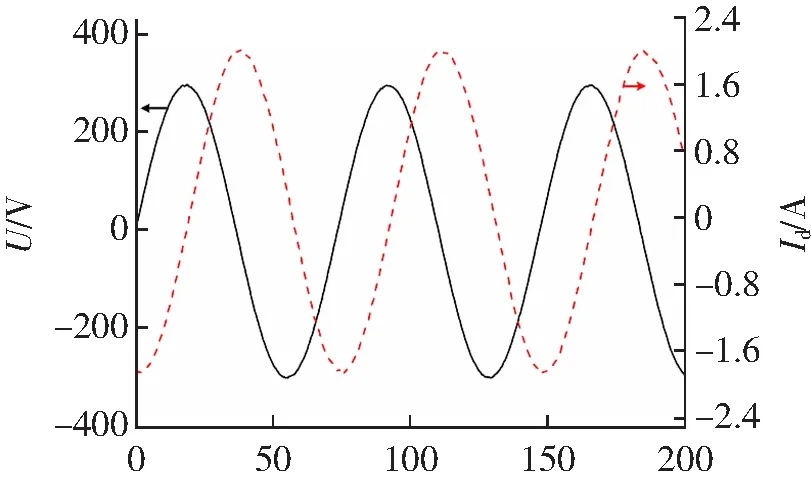
本研究中利用RF-APGD等离子体射流对HEK293细胞进行处理时,对应的放电特性如图3所示。可以看到,实验测量得到的放电电压(U)和电流(Id)波形具有类似正弦波的形状,仅在正负峰值附近存在微小的变形,这说明本研究采用的RF-APGD为均匀、稳定的辉光放电。实验测量得到的放电电压和电流均方根值分别为Urms=211.1 V和Irms=1.36 A。
t/ns
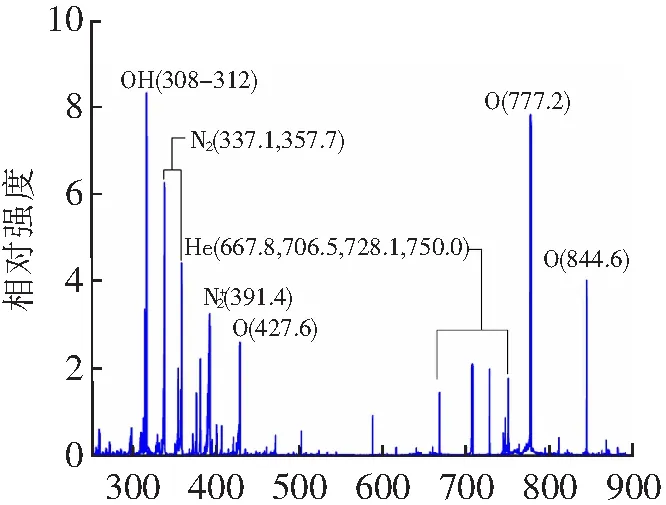
利用光纤光谱仪获得的等离子体射流发射光谱特性如图4所示,采集时光纤探头置于图1(b)中锥形亚克力管的末端侧面处。可以看到,RF-APGD等离子体射流包含种类丰富的活性粒子,除了与工作气体(高纯氦)相关的粒子外,还包含了与空气中的氮、氧相关的粒子,如O、OH、N2等,这与Li等报道的AP-DBD等离子体射流的发射光谱类似[12]。在等离子体生物医学等领域,普遍认为活性氧氮粒子(Reactive oxygen nitrogen species,RONS)在对生物材料的处理过程中起着重要的作用[18-20]。此处需要强调的是,由于发射光谱所给出的是不同波长谱线的相对强度,因此无法通过对比RF-APGD和AP-DBD等离子体射流的光谱相对强度来直接判断两种等离子体射流中活性粒子浓度的相对大小,这也是后续研究中需要进一步深入开展的工作。
2.2 实验参数的初步选择
体外细胞实验从最初的细胞复苏阶段到实验完成,往往需要一周以上时间。为了提高实验效率,在较短时间内获得准确可靠的结果,本研究首先开展实验参数的初步选择实验,以获得有关等离子体射流作用距离和作用时间的参数窗口,从而为提高细胞实验的效率和可靠性提供基础。
λ/nm
首先,考虑到在Li等的工作中,AP-DBD等离子体发生器出口处外接的亚克力管长度为2 cm[12],即等离子体处理距离固定为2 cm,而本研究采用的处于α放电模式的RF-APGD等离子体射流长度一般在毫米量级,若仍采用2 cm的处理距离可能导致实验效果并不显著。因此,本小节首先针对等离子体处理距离和放电功率的选择开展了实验研究。结果表明,在处理距离2 cm、处理时间1~10 min条件下,即使当射频放电的功率达到50 W时,实验组细胞与对照组细胞(无等离子体处理)的存活率均无显著统计学差异。考虑到实际应用中,RF-APGD等离子体的处理距离一般在毫米量级[21],我们将等离子体处理距离缩小为5 mm。在此处理距离下,当放电功率在30~50 W范围内变化时,相应的实验结果表明,在相同的处理时间下,实验组细胞与对照组细胞的存活率具有显著的统计学差异,且随着处理时间增长,细胞存活率下降。因此,在后续实验中,综合考虑等离子体发生器的放电特性,特别是等离子体射流长度以及液氮冷却状态的调控,将RF-APGD的放电功率和等离子体射流的处理距离分别固定为30 W和5 mm。
其次,我们将处理时间在较大的范围内变化以初步确定细胞50%存活率对应的处理时间范围,从而为后续实验中处理时间的选择提供依据。实验结果表明,当等离子体处理时间为0(对照组)、1、3、5、7、10 min时,对应的细胞存活率依次为100%、93.21%、85.12%、54.53%、46.61%和37.40%。由此可以得到初步的结论:体外细胞存活率50%对应的处理时间范围在5~7 min之间。因此,在后续的实验中,采用的等离子体处理时间为t=1、4、5、6、7、8、9、10、12、16、20 min,每个处理时间的实验至少重复3次以获得具有统计学意义的结果。其中,处理时间为5、6和7 min的实验组需要重点关注,重复次数均为5次以上,从而排除偶然因素对实验结果的影响。此外需要说明的是,本论文所采用的RF-APGD等离子体发生器具有良好的放电稳定性,在放电持续至少20 min的过程中,放电模式、放电电压和电流以及等离子体发射光谱均无明显变化,这在很大程度上保证了等离子体生物学效应的可重复性。
2.3 RF-APGD等离子体有效功率的计算
在本文研究中,将有效功率定义为射频放电功率中,被流经发生器的气体吸收、进而转化为等离子体所消耗的功率。对于AP-DBD等离子体,Li等以其放电功率作为有效功率(Peff),并与处理时间(t)相乘得到有效注入能量(Weff)[12]。这是由于AP-DBD等离子体热效应不明显,几乎所有外电路注入的功率都用于等离子体的产生。而对于RF-APGD等离子体来说,需要额外冷却工作气体才能获得气体温度在20 ℃~24 ℃范围内的射流。因此,有效功率的计算必须考虑传热导致的能量损失。一般来说,RF-APGD等离子体体系的能量损失主要包括电极壁面处的对流(Pconv)和导热(Pcond)热损失以及气体宏观流动(Pflow)热损失[17]。因此,有效功率的计算方法为:
Peff=Pin-Pflow-Pconv-Pcond
(2)
其中,Pflow、Pconv和Pcond的推导过程和计算方法见文献[17]。
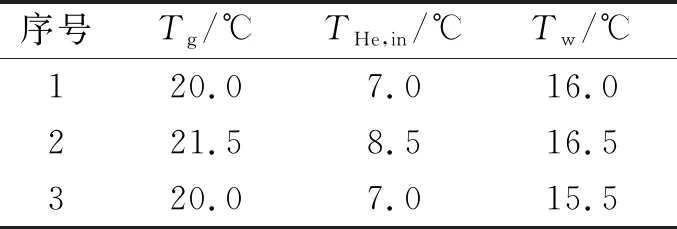
表1 Tg、Tw和THe,in测量结果Tab.1 The measured values of Tg,Tw and THe,in
计算RF-APGD等离子体体系的热量损失还需要确定等离子体气体温度(Tg)、电极壁面温度(Tw)和工作气体的进气温度(THe,in)等参数,在本文实验中采用低温温度计对以上几个参数进行了3次测量,结果如表1所示。由此可以估算得到Pflow、Pconv和Pcond的数值分别为4.03、14.85和10.13 W,即有效功率Peff的数值为0.99 W。该数值相对于放电功率30 W来说要小得多。He等的研究指出,对于射频电源驱动的辉光放电等离子体来说,注入等离子体体系的有效功率为输入功率的5%左右[22],这在一定程度上佐证了本文估算所得到的RF-APGD的有效功率数值是可靠的。另外,从上述数据也可以看到,相对于大气压介质阻挡放电,RF-APGD中用于产生等离子体的有效功率占放电功率的比例非常低,即能量利用效率很低。在今后的研究中,还需要深入研究RF-APGD体系的能量输运机制,进一步提高放电过程中的能量利用效率。
2.4 RF-APGD等离子体剂量评估
不同处理剂量条件下,利用RF-APGD等离子体射流处理体外培养的HEK293细胞的存活率结果如图5所示。对照组细胞不经过等离子体处理,其对应的等离子体剂量为0,对应于等离子体处理时间为1、4、5、6、7、8、9、10、12、16、20 min的等离子体剂量分别为11.94、47.76、59.70、71.64、83.58、95.52、107.46、119.40、143.28、191.04、238.80 mJ·cell-1。其中,每组数据均与对照组进行对比,****p<0.000 1代表两组数据在统计学上有着显著差异。
为了获得RF-APGD等离子体射流处理HEK293细胞的LD50数值,在得到图5所示的实验数据后,可以用统计学软件拟合得到细胞存活率(ξ)随log(Weff/N)数值变化的曲线,如图6所示。该拟合曲线亦呈“S”型,与图2所示的采用AP-DBD等离子体射流条件下的拟合曲线形状类似。图6的实验结果表明,当RF-APGD等离子体射流的作用剂量较小时,其对细胞的损伤作用同样不明显,细胞存活率曲线近似为一条平行于横轴的直线;而随着等离子体剂量的增加,当超过某一数值后,细胞的存活率开始快速下降,这说明RF-APGD等离子体射流对细胞的杀灭作用开始占主导,大量细胞被杀死;而当细胞存活率低于10%后,其下降趋势又变得平缓,形成了“S”形的结构。图6中拟合曲线上对应于存活率ξ=50%的等离子体作用剂量为LD50=75.86 mJ·cell-1,即横坐标log(Weff/N)=1.88的点。

(Weff/N)/(mJ·cell-1)
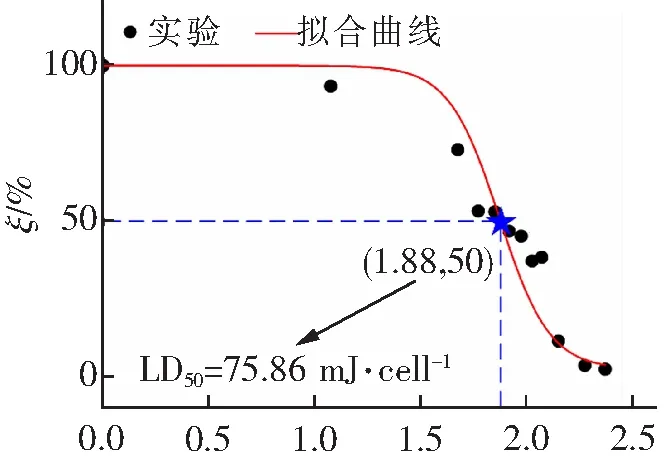
log(Weff/N)/(mJ·cell-1)
2.5 分析与讨论
图6拟合得到的LD50数值可为RF-APGD等离子体射流的实际应用提供剂量参考。例如,在f=13.56 MHz、Pin=30 W、Q=20 slpm、THe,in=7 ℃~11 ℃条件下,LD50数值对应的处理时间为381 s,说明在以等离子体促进作用为目标的RF-APGD等离子体应用中处理时间应低于这一数值,而对于以灭活作用为目标的应用中处理时间则需高于这一数值。而对于不同放电参数下的RF-APGD等离子体射流,则需先估算有效放电功率,再结合75.86 mJ·cell-1这一LD50数值,计算对应的处理时间,从而作为实际应用中处理时间的重要参考。
另一方面,与图2所示的AP-DBD等离子体射流的LD50数值(34.67 mJ·cell-1)相比,对于同一种HEK293细胞,RF-APGD等离子体射流的LD50数值更高,但两者仍在同一数量级范围内。在后续的研究工作中,我们将继续采用LD50-等离子体剂量评估方法开展系统的CAP源剂量研究,如利用这两种典型的CAP射流源处理其他类型的体外培养细胞,并获得对应的LD50数值,探索不同种类细胞对CAP射流处理的耐受性;又如采用其他更多类型的CAP源处理HEK293体外培养细胞,在深入理解等离子体-细胞相互作用机制的基础上,明确不同种类等离子体源对同一种细胞作用剂量间的关系,建立详实可靠的等离子体剂量数据库,为推动等离子体生物医学应用的快速发展提供理论指导。此外,我们还将围绕作用距离对CAP剂量的影响开展更加细致的数值模拟和实验研究工作,以形成适用于不同结构等离子体发生器的作用距离选取原则,进一步完善LD50-等离子体剂量评估方法。
3 结论
本论文基于Li等提出的LD50-等离子体剂量评估方法[12],开展了RF-APGD等离子体射流处理HEK293细胞的剂量学研究,主要得到如下结论:
1)在本论文工作条件下得到的RF-APGD等离子体射流处理HEK293细胞的LD50=75.86 mJ·cell-1。虽然该数值较文献[12]中采用AP-DBD等离子体射流处理HEK293细胞得到的LD50值(34.67 mJ·cell-1)偏大,但二者仍在同一数量级范围内。
2)本论文研究工作进一步证明了LD50-等离子体剂量评估方法的可靠性、便捷性和通用性。而另一方面,在未来的工作中,还应基于LD50-等离子体剂量评估方法,开展多种CAP源处理多种类型体外培养细胞的LD50实验研究,从而形成详实可靠的等离子体剂量学数据库,为推动CAP生物医学应用的发展提供理论指导。
声明:李静,赵潞翔两位作者对本论文贡献一致。
