miR-125a-5p通过黏着斑通路对铝染毒GC2-spd细胞凋亡的影响
2023-06-07黄艳新陈文成彭慧鑫韦光吉庞艳芳元辉雄
黄艳新 陈文成 彭慧鑫 韦光吉 庞艳芳 元辉雄
【摘要】 目的 探討miR-125a-5p在铝染毒小鼠精母细胞系(GC2-spd)模型中对黏着斑信号通路及GC2-spd细胞凋亡的影响。方法 建立铝染毒GC2-spd细胞模型,分为对照组(CG),铝染毒组(ALG),铝染毒组+miR-125a-5p inhibitor阴性对照组(ALG+inhibitor NC)及铝染毒组+miR-125a-5p inhibitor 组(ALG+inhibitor);利用RT-qPCR检测ALG与CG细胞中miR-125a-5p的表达情况;利用Western blot检测CG组、ALG组、ALG+inhibitor NC组及ALG+inhibitor组Itga7、Pak4、Akt1、Bax及Caspase-9的表达情况;利用CCK8实验及流式细胞术实验检测各组GC2-spd细胞的活性和凋亡率。结果 RT-qPCR 结果显示,与对照组比较,ALG组细胞中miR-125a-5p的表达显著升高;Western blot结果显示,抑制miR-125a-5p的表达后,可显著升高铝染毒GC2-spd细胞中Itga7、Pak4和Akt1的表达,降低Bax及Caspase-9的表达;CCK8和流式细胞术实验结果显示,抑制miR-125a-5p的表达后,可显著提高GC2-spd细胞的活性,降低细胞的凋亡率。结论 miR-125a-5p inhibitor可通过提高Itga7、Pak4和Akt1的表达,促进黏着斑信号通路激活,抑制细胞凋亡,提高细胞的活性,从而抑制铝染毒GC2-spd细胞的凋亡作用。
【关键词】 miR-125a-5p;黏着斑通路;铝染毒;小鼠精母细胞系细胞
中图分类号:R114 文献标志码:A DOI:10.3969/j.issn.1003-1383.2023.05.003
【Abstract】 Objective To investigate the effect of miR-125a-5p on focal adhesion signaling pathway and apoptosis of GC2-spd cells in aluminum-exposed mouse spermatocyte cell line (GC2-spd) model.Methods Aluminum-exposed GC2-spd cell model was established, and cells were divided into control group (CG), aluminum exposure group (ALG), ALG + miR-125a-5p inhibitor negative control (ALG+inhibitor NC) group, and ALG+miR-125a-5p inhibitor (ALG + inhibitor) group. The expressions of miR-125a-5p in the ALG and the CG were detected by RT-qPCR; the expressions of Itga7, Pak4, Akt1, Bax and Caspase-9 in the CG, the ALG, the ALG+inhibitor NC group and the ALG + inhibitor group were detected by Western blot; and the activity and apoptosis rate of GC2-spd cells in each group were detected by CCK-8 assay and flow cytometry. Results RT-qPCR results showed that the expression of miR-125a-5p in ALG cells was significantly increased while compared with that of the normal control group; Western blot results showed that inhibiting the expression of miR-125a-5p could significantly increase the expressions of Itga7, Pak4 and Akt1, and decrease the expressions of Bax and Caspase-9 in aluminum-exposed GC2-spd cells; the results of CCK8 and flow cytometry experiments showed that inhibiting the expression of miR-125a-5p could significantly increase the activity of GC2-spd cells and reduce the apoptosis rate of cells.Conclusion miR-125a-5p inhibitor can promote the activation of focal adhesion pathway, inhibit cell apoptosis, and improve cell activity by increasing Itga7, Pak4 and Akt1, thereby inhibiting the apoptosis of GC2-spd cells exposed to aluminum.
【Key words】 miR-125a-5p; focal adhesion pathway; aluminum exposure; GC2-spd cells
据世界卫生组织统计,全世界正常生育的夫妇中,就有10%~15%的夫妇面临不孕不育问题,其中大约有50%的病例是由男性因素引起的[1]。导致男性不育的因素有很多,致病机制尚未完全明确,由于精子发生的过程受到很多遗传和外界环境因素的影响,精液质量低下可能与先天性发育异常、免疫、感染和内分泌等多种因素有关,金属元素暴露过量也是重要原因之一[2]。铝是地壳中含量最丰富的金属元素,由于其具有良好的理化性质,在日常生活中的使用非常广泛,人类主要通过职业性、医源性和生活性接触铝[3]。有研究表明,睾丸中低浓度的铝(3.35 μg/g)足以损害精子发生和精子质量[4]。已有的铝元素对雄性动物生殖功能影响的研究主要集中在生殖毒性作用方面,这些毒性作用主要表现为精液质量下降、精子活力降低、精子线粒体损伤,并可进一步引发精子活力与存活率改变。但是对铝的生殖毒性发生在基因水平的改变研究甚少。
黏着斑通路在维持细胞的正常结构和功能中起着重要作用,其通过调节细胞内蛋白磷酸化、pH值和钙水平来调节细胞的存活、增殖、分化和迁移[5]。黏着斑通路中的蛋白包括整合素(integrin alpha-7,Itga7)、P21(RAC1)活化激酶4[P21(RAC1) activated kinase 4,Pak4]以及丝氨酸/苏氨酸激酶1(serine-threonine protein kinase 1,Akt1)等,这些蛋白相互之间或与细胞骨架之间均可相连,也称为整合素信号通路。有实验研究表明,黏着斑通路中的Pak4和ELK1的低表达,显著增加猪颗粒细胞的凋亡[6],Pak4的表达增加了凋亡蛋白Bad的磷酸化,并抑制了Caspase的激活,从而保护细胞免受凋亡[7]。miR-125a-5p参与雄性繁殖, miR-125a-5p敲低促进细胞增殖,而miR-125a-5p过表达抑制细胞增殖,促进细胞凋亡[8]。miR-125a-5p是否通过黏着斑信号通路调控铝染毒生精细胞凋亡还未见有报道。本研究以GC2-spd细胞为研究对象,建立铝染毒细胞模型,检测miR-125a-5p与黏着斑信号通路及细胞凋亡的关系,将为铝暴露导致的男性生殖功能损伤的防治提供理论依据。
1 材料与方法
1.1 实验细胞
小鼠精母细胞系(GC2-spd)细胞株购于中国科学院细胞库。
1.2 主要试剂
六水合三氯化铝(AlCl3·6H2O),购于上海阿拉丁生化科技股份有限公司;CCK-8细胞活力检测试剂盒购于日本同仁公司,Annexin V-FITC双凋亡试剂盒购于赛默飞生物有限公司;miRNA第一链cDNA(茎环法)逆转录试剂盒、miR-125a-5p inhibitor、转染试剂体LipofectamineTM 2000购于上海吉玛制药技术有限公司;Itga7抗体购于SANTA Cruz公司,Pak4抗体购于CST公司,Akt1抗体购于Invitrogen公司,Bax、Caspase-9及GAPDH抗体购于Sigma公司。
1.3 细胞培养
GC2细胞培养于含10%胎牛血清的高糖DMEM培养基中(含100 U/mL青霉素及0.1 mg/mL链霉素),置于37 ℃、5%CO2的恒温培养箱中,培养2~3 d进行传代一次,将对数生长期细胞作为实验对象。
1.4 铝染毒细胞模型的建立及实验细胞分组
将培养瓶中的GC2-spd细胞以合适密度接种于六孔板中,正常培养(37 ℃、5%CO2的恒温培养)24 h后,将GC2-spd细胞按以下模型进行分组,对照组(CG):GC2-spd细胞不作任何处理;铝染毒组(ALG):将培养24 h后六孔板中的GC2-spd细胞更换成含2 mmol/L浓度铝的完全培养基继续培养24 h;铝染毒组+miR-125a-5p inhibitor阴性对照组(ALG+inhibitor NC):六孔板中的GC2-spd细胞培养24 h后转染miR-125a-5p inhibitor NC,培养6 h后更换成含2 mmol/L浓度铝的完全培养基继续培养24 h;铝染毒组+miR-125a-5p inhibitor(ALG+inhibitor)组:六孔板中的GC2-spd细胞培养24 h后转染miR-125a-5p inhibitor,培养6 h后更换成含2 mmol/L浓度铝的完全培养基继续培养24 h。
1.5 RT-qPCR检测miR-125a-5p的表达
分别提取对照组与铝染毒组GC2-spd细胞总RNA,按照miRNA第一链cDNA(茎环法)逆转录试剂盒的操作说明将RNA逆转录成cDNA(miRNA125a-5p-RT GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCATCACAA,U6-F GCTTCGGCACATATACTAAAAT,U6-R CGCTTCACGAATTTGCGTGTCAT)。利用RT-qPCR检测两组细胞中miR-125a-5p的表达变化,以cDNA为模板进行扩增(miR-125a-5p-F GCTCCTGAGACCCTAAC;miR-125a-5p-R GTGCAGGGTCCGAGGT),RT-qPCR 反应条件:预变性94 ℃ 30 s,变性94 ℃ 5 s、退火56 ℃ 30 s、延伸72 ℃ 30 s,共40個循环。以U6为内参,数据采用2-ΔΔCt法进行分析。
1.6 GC2-spd细胞转染
将培养瓶中的GC2-spd以1×105个/mL密度的细胞接种在六孔培养板上,培养24 h后用无菌的PBS洗涤,加入1.5 mL opti-MEM的培养基,同时将miRNA试剂各5 μL/孔与250 μL/孔opti-MEM混匀,室温静置5 min,与5 μL/孔脂质体(Lipofectamine2000)与250 μL/孔opti-MEM混匀,室温静置 5 min,然后将上述两种液体混合静置20 min,将混合液加入6孔板中,每孔500 μL。培养6 h后换成含2 mmol/L浓度铝的完全培养基继续培养24 h,最后收集细胞进行分析。
1.7 Western blot检测细胞中Itga7、Pak4、Akt1、Bax及Caspase-9的表达变化
收集对照组、铝染毒组、铝染毒组+miR-125a-5p inhibitor 阴性对照组及铝染毒组+miR-125a-5p inhibitor组的细胞,利用RIPA裂解液裂解细胞,提取总蛋白,用BCA法检测总蛋白的浓度。常规SDS-PAGE电泳、转膜、5%脱脂奶粉室温封闭1 h,Itga7抗体(1∶500)、Pak4抗体(1∶500)、Akt1抗体(1∶500)、Caspase-9 抗体(1∶1000)及β-Actin 抗体(1∶10 000)4 ℃孵育过夜,荧光Ⅱ抗(1∶1000)室温孵育2 h后,Odyssey曝光,用Termo Fisher Science的ECL化学发光系统检测蛋白质信号,用Image J软件分析蛋白质条带的灰度值。
1.8 细胞活力的检测
将GC2-spd细胞按照5×103的密度接种于96孔板中,培养24 h后按照上述方法将细胞分为4组,再继续培养24 h后检测各组活性,每孔加入10 μL CCK8溶液,正常培养条件下继续孵育4 h,酶标仪450 nm处测OD值。
1.9 GC2-spd细胞凋亡的检测
将GC2-spd细胞以1×105个/mL密度接种于六孔板,培养24 h后按照上述分组处理,细胞培养完成后按照Annexin V-FITC和PI凋亡试剂盒操作说明对细胞进行处理,用流式分析仪分析细胞凋亡情况。
1.10 统计学方法
所有实验数据均采用SPSS 17.0软件进行统计分析,实验数据均进行正态性检验和方差齐性检验,符合正态分布和方差齐性的两样本数据比较采用t检验,否则采用t检验。多样本数据比较采用单因素方差(one-way ANOVA)分析,进行组间两两比较时,方差齐者采用SNK检验,方差不齐者采用Games-Howell检验。数据以均数±标准差(±s)表示。检验水准:α=0.05,双侧检验。
2 结 果
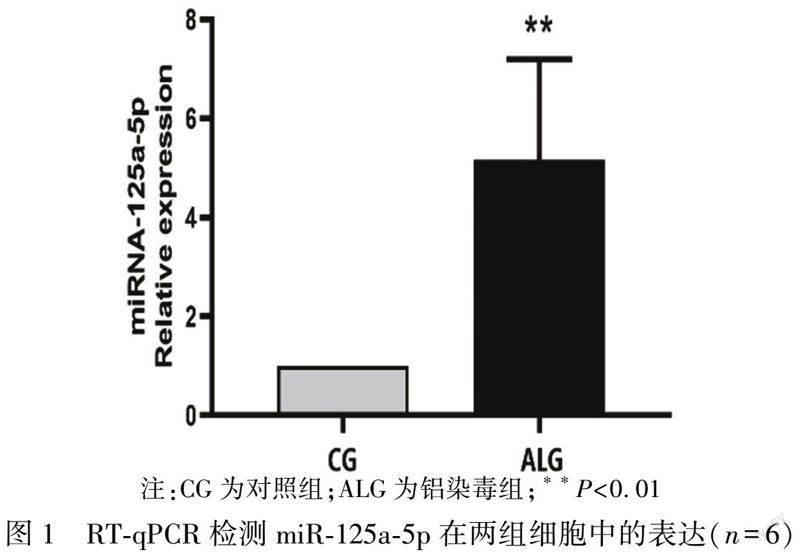
2.1 对照组与铝染毒组GC2-spd细胞中miR-125a-5p的表达变化
利用RT-qPCR检测两组细胞中miR-125a-5p的表达情况,结果如图1所示,与对照组比较,铝染毒组GC2-spd细胞中miR-125a-5p的表达显著升高(P<0.01)。
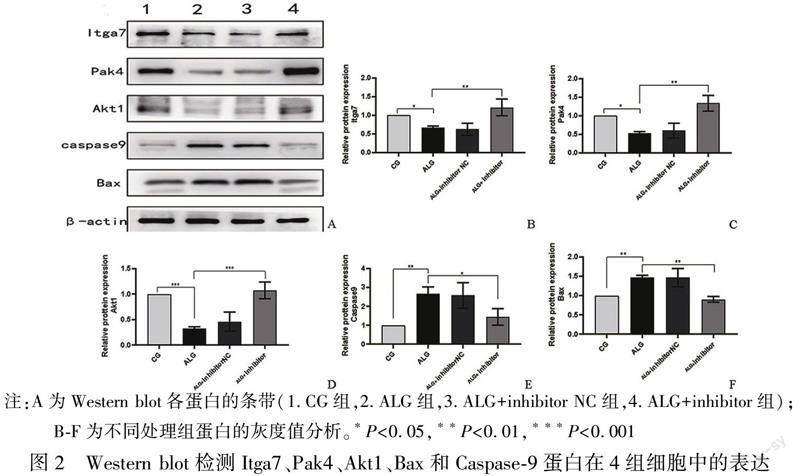
2.2 Itga7、Pak4、Akt1、Bax及Caspase-9在各组细胞中的表达情况
利用Western blot检测对照组、铝染毒组、铝染毒组+miR-125a-5p inhibitor NC组及铝染毒组+miR-125a-5p inhibitor组Itga7、Pak4、Akt1、Bax及Caspase-9蛋白的表达情况,图2A是各组细胞中各蛋白表达量的Western blot图,图2B-F是各组细胞蛋白表达量的灰度值分析。从图2B-F我们可以看出,铝染毒组细胞中的Itga7、Pak4、Akt1蛋白的表达量低于对照组(P<0.05),而Bax及Caspase-9蛋白的表达量显著高于对照组(P<0.01);转染miR-125a-5p inhibitor后,GC2-spd细胞中的Itga7、Pak4、Akt1蛋白的表达量高于铝染毒组(P<0.05),而Bax和Caspase-9蛋白的表达量低于铝染毒组(P<0.05)。表明铝染毒通过miR-125a-5p负向调节黏着斑信号通路,促进细胞凋亡,从而影响生精细胞的增殖。
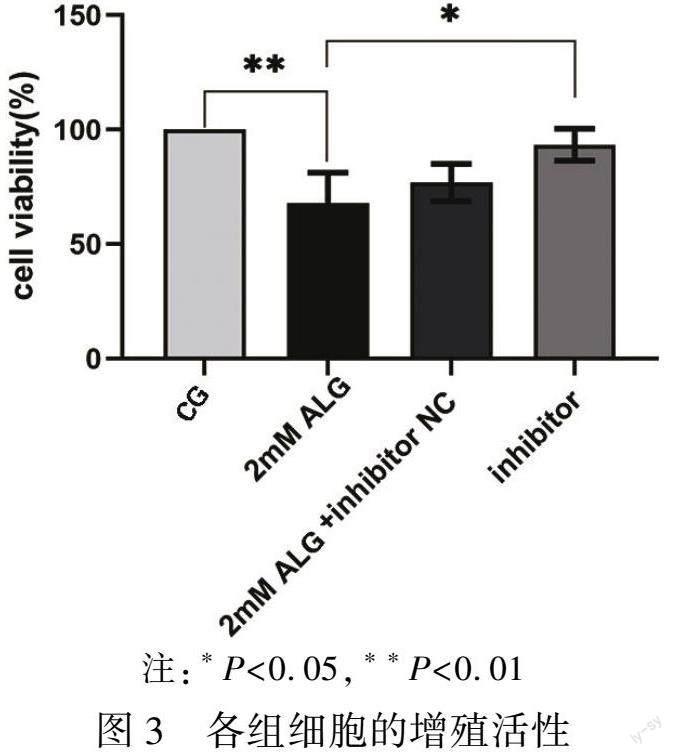
2.3 CCK8实验检测各组GC2-spd细胞的活性
CCK8实验结果显示,与对照组比较,铝染毒组细胞的活性显著降低(P<0.01);而转染miR-125a-5p inhibitor后,细胞的活性显著升高(P<0.05)。見图3。这表明在铝染毒的情况下,抑制miR-125a-5p后,细胞凋亡减少,活力增高。
2.4 流式细胞仪检测各组GC2-spd细胞凋亡率的变化
流式双荧光凋亡实验结果显示,与正常对照组比较,铝染毒组细胞的凋亡率显著增加(P<0.01);而转染miR-125a-5p inhibitor后,细胞的凋亡率显著降低。见图4。这表明在铝染毒的情况下,抑制miR-125a-5p后,细胞凋亡减少(P<0.01)。
3 讨 论
精子的发生是睾丸生精小管内的精原干细胞经历有丝分裂和减数分裂并经过初级精母细胞、次级精母细胞和精细胞发展演变而成的,在产精的过程中,细微的内部或者外部环境的变化都会引起精子质量的变化。生精细胞在精子的发生过程中起着重要作用,而外部环境在生精细胞分化发育阶段尤为关键。金属过量暴露是外部环境因素影响男性不育的原因之一,有研究显示,金属过量暴露会导致生精细胞凋亡信号通路的激活[9],人们可能直接或间接地通过工业接触、受污染的食物或水接触到这些金属。铝是一种对男性生殖系统有不利影响的金属元素之一,长期暴露于较高剂量的铝会对精子的活力、存活率、计数和形态产生有害影响[10]。睾丸中铝的积累会导致精子细胞坏死,并通过多种机制触发其他生殖毒性,例如氧化应激、生精细胞凋亡等,最终使精子浓度降低和精子活力下降,但是具体的分子机制不明[11]。miRNAs作为重要的转录调控因子,在睾丸生精过程中发挥重要作用,特别是在生精细胞的增殖、分化和凋亡中起了关键性的作用。miR-125a-5p在肿瘤细胞中研究比较多,在细胞的增殖分化与凋亡中发挥重要作用,有多篇文献报道,miR-125a-5p的靶基因是抗凋亡基因Bcl-2,miR-125a-5p与 Bcl-2 3′UTR结合,使Bcl-2表达量显著降低,Bax、细胞色素C的释放和Caspase-3表达量显著升高,从而诱导细胞凋亡[12];miR-125a-5p还可通过作用于PI3K/Akt通路,调控Akt、Bax、Bcl-2、PI3K蛋白表达量,抑制肝癌细胞增殖,同时促进肝癌细胞凋亡[13];在垂体瘤细胞中,miR-125a-5p表达降低,miR-125a-5p过表达抑制垂体瘤AtT20细胞增殖能力并促进细胞凋亡[14]。这些研究都表明miR-125a-5p具有抑制肿瘤细胞增殖,并促进细胞凋亡的作用。在脑源性神经营养因子(BDNF)作用下,睾丸间质细胞中miR-125a-5p的表达具有明显的差异[15]。还有研究发现miR-125a-5p在晚发性性腺功能减退症患者中表达下调[16]。这些研究结果表明miR-125a-5p可能与男性生殖有关。LIANG等人[17]研究发现miR-125a-5p能够抑制GC2细胞中线粒体功能,减少细胞ATP产生,并增加细胞活性氧和DNA损伤水平,参与精子衰老的过程;TENG等人[18]还在研究睾丸支持细胞(Sertoli)中发现,miR-125a-5p通过PI3K/Akt通路来调控Sertoli的增殖和凋亡,miR-125a-5p基因敲除促进Sertoli细胞增殖,抑制细胞凋亡,而过表达则抑制Sertoli细胞增殖,促进细胞凋亡。这些研究结果表明miR-125a-5p升高可能预示男性生殖细胞发展的不良结局。本研究结果与前人的报道是一致的,我们通过建立铝染毒GC2-spd细胞模型,检测miR-125a-5p在GC2-spd细胞中的表达变化,结果显示,与对照组相比,铝染毒细胞中的miR-125a-5p表达显著升高,GC2-spd细胞生长明显受到抑制,细胞凋亡明显,而转染miR-125a-5p inhibitor后,细胞的凋亡率明显减少。我们的结果表明铝染毒可促进生精细胞凋亡,miR-125a-5p可能在其中发挥重要的作用。
黏着斑是细胞骨架的重要结构,由细胞膜上的整合素和细胞内的细胞骨架蛋白组成,可以通过协助跨膜信号的传导来驱动细胞骨架的组装与解聚,从而控制细胞的生长、分化、扩散、黏附、迁移以及凋亡等行为[19]。黏着斑通路中的Itga7、Pak4及Akt1等蛋白在细胞骨架之间都可以相连,并参与了精子细胞的形成和分化[20]。Itga7属于整合素家族的黏附分子,在多个细胞过程中的细胞-细胞和细胞-细胞外基质相互作用中发挥作用[21]。Itga7在癌细胞中表达增高,具有促进癌细胞增殖的作用[22]。Pak4属于丝氨酸/苏氨酸激酶,对细胞运动、存活、细胞周期和增殖至关重要,有研究表明,抑制Pak4通过诱导异常的微丝和微管的动力学导致减数分裂停滞,从而影响生殖细胞的增殖[23]。Akt信号通路在调控生精细胞增殖、分化和精子发生过程中具有重要的作用,大鼠睾丸生精受损、生精细胞增殖分化减弱与Akt表达受到抑制有关[24]。在我们的研究当中,作为黏着斑通路中的关键蛋白Itga7、Pak4及Akt1在铝染毒后的GC2-spd细胞中被显著下调,抑制miR-125a-5p的表达后,铝染毒的GC2-spd细胞中Itga7、Pak4及Akt1显著提高,凋亡相关蛋白Caspase-9和Bax显著下降;CCK8实验结果显示,与铝染毒组相比较,抑制miR-125a-5p的表达后,GC2-spd细胞的活性显著升高;流式双荧光检测细胞凋亡率也印证了我们的结果,抑制miR-125a-5p的表达后铝染毒的GC2-spd细胞凋亡率明显下降。我们的结果表明铝染毒后通过上调miR-125a-5p抑制黏着斑通路,使通路中的相关蛋白表达降低而凋亡蛋白表达增高,促进细胞凋亡。然而,miR-125a-5p是否与黏着斑通路中的某些蛋白具有相互作用还有待进一步研究,此前有多篇文献报道miR-125a-5p与抗凋亡蛋白BCL-2的关系,有没有可能miR-125a-5p直接调控BCL-2促进生精细胞凋亡,或者是miR-125a-5p引起GC2线粒体损伤,通过线粒体途径促进生精细胞凋亡,或者miR-125a-5p是否与黏着斑通路中的某些蛋白具有靶向的相互作用,这些都有待进一步的研究。
综上所述,铝染毒促进GC2-spd细胞凋亡增加,使GC2-spd细胞中miR-125a-5p表达上调,抑制miR-125a-5p的表达,激活黏着斑信号通路,促进GC2-spd细胞增殖,减少细胞凋亡,提高细胞的活性,从而抑制铝染毒GC2-spd细胞的凋亡作用。总之,铝染毒有可能通过上调miR-125a-5p负性调控黏着斑信号通路,影响生精细胞的增殖与凋亡。
参 考 文 献
[1] DE MOUZON J,CHAMBERS G M,ZEGERS-HOCHSCHILD F, et al. International Committee for Monitoring Assisted Reproductive Technologies world report: assisted reproductive technology 2012[J].Human Reproduction, 2020,35(8): 1900-1913.
[2] 孫自学,李鹏超,何鑫,等.益肾通络补气方治疗无症状性弱精子症不育患者的疗效评价[J].中华中医药杂志,2021,36(9):5660-5663.
[3] 元辉雄,陈文成.铝的雄性生殖毒性研究进展[J].医学综述,2019,25(15): 2993-2997.
[4] MARTINEZ C S, ESCOBAR A G, URANGA-OCIO J A, et al.Aluminum exposure for 60days at human dietary levels impairs spermatogenesis and sperm quality in rats[J]. Reprod Toxicol, 2017,73: 128-141.
[5] WINOGRAD-KATZ S E,FSSLER R,GEIGER B, et al. The integrin adhesome: from genes and proteins to human disease[J]. Nat Rev Mol Cell Biol, 2014,15(4): 273-288.
[6] TIAN Y,ZHANG M Y,LI N,et al.Zearalenone exposure triggered porcine granulosa cells apoptosis via microRNAs-mediated focal adhesion pathway[J]. Toxicol Lett, 2020,330: 80-89.
[7] GNESUTTA N, QU J, MINDEN A. The serine/threonine kinase PAK4 prevents caspase activation and protects cells from apoptosis[J].Journal of Biological Chemistry, 2001,276(17): 14414-14419.
[8] TENG F M, HU F, ZHANG M S.MicroRNA-125a-5p modulates the proliferation and apoptosis of TM4 Sertoli cells by targeting RAB3D and regulating the PI3K/AKT signaling pathway[J]. Mol Hum Reprod, 2021,27(9): gaab049.
[9] 熊英,王芙蓉,陈卿,等.重庆市环境气态污染物暴露与男性精液质量及性激素水平的关联研究[J].第三军医大学学报, 2021,43(1):10-16.
[10] 元辉雄,庞艳芳,王俊利,等.铝对大鼠精子质量及精子线粒体的影响[J].中华男科学杂志,2019,25(7):579-585.
[11] CHERAGHI E,GOLKAR A,ROSHANAEI K,et al.Aluminium-induced oxidative stress,apoptosis and alterations in testicular tissue and sperm quality in Wistar rats:ameliorative effects of curcumin[J].Int J Fertil Steril, 2017,11(3):166-175.
[12] 段滇宁,沈华伟,潘艳敏,等.猪圆环病毒2型通过外泌体miR-125a-5p靶向Bcl-2诱导淋巴细胞凋亡[J].生物工程学报,2022,38(8):2891-2901.
[13] 郭婧芸,张征,袁琦,等.miR-125a-5p转染对肝癌细胞增殖、侵袭、迁移的影响及相关机制研究[J].现代生物医学进展,2020,20(19):3639-3643.
[14] 陈亮,秦军,魏德胜,等.miR-125a-5p靶向MEIS2基因对垂体瘤AtT20细胞增殖、凋亡的影响[J].临床神经外科杂志, 2022,19(1): 64-69.
[15] GAO S,LI C J,XU Y,et al.Differential expression of microRNAs in TM3 Leydig cells of mice treated with brain-derived neurotrophic factor[J].Cell Biochem Funct, 2017,35(7):364-371.
[16] LIU Y L, HUANG F J, DU P J, et al.Long noncoding RNA MIR22HG promotes Leydig cell apoptosis by acting as a competing endogenous RNA for microRNA-125a-5p that targets N-Myc downstream-regulated gene 2 in late-onset hypogonadism[J].Lab Invest,2021,101(11):1484-1493.
[17] LIANG K,YAO L Y, WANG S X,et al.miR-125a-5p increases cellular DNA damage of aging males and perturbs stage-specific embryo development via Rbm38-p53 signaling[J].Aging Cell,2021,20(12): e13508.
[18] TENG F M,HU F,ZHANG M S.MicroRNA-125a-5p modulates the proliferation and apoptosis of TM4 Sertoli cells by targeting RAB3D and regulating the PI3K/AKT signaling pathway[J].Mol Hum Reprod,2021,27(9): gaab049.
[19] 张冠华,智发朝.黏着斑的结构、功能及在肿瘤转移中作用[J].现代消化及介入诊疗,2015,20(2):174-177.
[20] YANG T, YANG W X.The dynamics and regulation of microfilament during spermatogenesis[J].Gene,2020,744:144635.
[21] WU Z Y,KONG X Y,WANG Z H.Integrin α7 knockdown suppresses cell proliferation,migration,invasion and EMT in hepatocellular carcinoma[J].Exp Ther Med,2021,21(4):309.
[22] 喻隼鋒,倪芳,耿爽,等.整合素α7在非小细胞肺癌组织中的表达及临床意义[J]. 临床肿瘤学杂志,2020,25(4):296-300.
[23] HE Y T,YANG L L,LUO S M, et al.PAK4 regulates actin and microtubule dynamics during meiotic maturation in mouse oocyte[J].Int J Biol Sci, 2019,15(11):2408-2418.
[24] 陆海旺,宾彬,林思伟,等.强精煎介导PI3K/Akt/mTOR通路调控少精子症大鼠精子发生的实验研究[J].中医药信息, 2022,39(7): 33-40.
(收稿日期:2022-10-29 修回日期:2022-12-22)
(编辑:王琳葵 潘明志)
基金项目:广西自然科学基金(2020GXNSFAA297257);广西高校中青年教师科研基础能力提升项目(2020KY13017);广西壮族自治区中医药管理局自筹经费科研课题(GZZC2020248);广西壮族自治区卫生健康委员会自筹经费科研课题(Z20201416)
作者简介:黄艳新,女,主管技师,医学学士,在读硕士研究生,研究方向:生殖免疫的临床及基础研究。E-mail:44842478@qq.com
通信作者:陈文成。E-mail:cwcch3268@163.com
