急性前循环大血管闭塞性脑卒中患者梗死核心体积的影响因素及其与临床预后的相关性
2023-06-06刘亚飞吴亭亭武一平张忠波张英段新飞房娉平
刘亚飞 吴亭亭 武一平 张忠波 张英 段新飞 房娉平
急性前循环大血管闭塞性脑卒中(acute anterior circulation large vessel occlusive stroke,ALVOS)患者在时间窗内进行血管内治疗(endovascular treatment,EVT)安全、有效[1-2]。2018年DAWN[3]和 DEFUSE-3[4]两项研究表明,通过影像学的“组织窗”评估可将机械取栓(mechanical thrombectomy,MT)的时间窗拓展至16~24 h,提高了患者接受MT治疗的比例,改善了患者预后,但上述研究分别把梗死核心体积(ischemia core volume,ICV)≥50 mL[3]和≥70 mL[4]的患者排除在外。大梗死核心体积(large-ischemia core volume,L-ICV)一般以50 mL或70 mL来界定,也有学者以Alberta卒中项目早期 CT 评分(Alberta Stroke Program Early CT Score,ASPECTS)<6分或梗死体积>1/3大脑中动脉供血区来定义[3-5]。目前针对L-ICV的研究相对较少,且结论尚不统一。有研究结果显示L-ICV患者行EVT后90 d改良Rankin量表评分(modified Rankin scale,mRS)显著优于药物治疗组[6-7]。但亦有研究显示经EVT治疗后患者转归不良[8]。因此,揭示发生L-ICV的相关危险因素对ALVOS患者的治疗和预防具有重要临床意义。本研究通过回顾性分析发病24 h内ALVOS患者的临床资料,旨在探讨ICV的影响因素及其对临床功能转归的影响,进一步探讨L-ICV患者发生死亡的危险因素。
1 对象和方法
1.1 对象连续回顾性纳入2022年1月至2022年9月邯郸市中心医院收治的ALVOS患者62例。急性缺血性脑卒中的诊断标准符合2018年版《中国急性缺血性脑卒中诊治指南》[9]。入组标准:(1)年龄>18岁;(2)入院时美国国立卫生研究院卒中量表(NIHSS)评分>6分;(3)发病时间在24 h内;(4)通过急诊绿色通道完善一站式脑CT平扫、CT血管造影(CT angiography,CTA)及CT灌注成像检查(CT perfusion imaging,CTP);(5)颅脑病变经CTA证实是前循环大血管闭塞;(6)发病前mRS≤1分。 排除标准:(1)颅内或蛛网膜下腔出血、其他部位活动性出血或有明显出血倾向者;(2)合并重要脏器功能障碍或衰竭;(3)临床资料不能完整获取者。本研究获得邯郸市中心医院伦理委员会批准,所有受试者或家属签署知情同意书。
1.2 方法
1.2.1一般基线资料收集:收集患者性别、年龄、既往病史(冠心病、糖尿病、陈旧性脑梗死、心房颤动、高血压)、实验室检查(D-二聚体、维蛋白原含量、急性血糖、糖化血红蛋白、血小板计数、血红蛋白、尿酸、肌酐)、发病至灌注成像时间(onset-to-CTP time)、NIHSS评分、治疗方法(包括静脉溶栓、直接取栓、桥接治疗和保守治疗)、卒中TOAST病因分型等。
1.2.2侧支循环评分:采用CTA显示的区域软脑膜侧支循环(regional leptomeningeal collateral,rLMC)评分系统[10]进行评分。0分:动脉未显影,无侧支代偿;1分:较对侧动脉显影不良,侧支代偿低于对侧;2分:显影区域等于或者大于对侧动脉显影区域,侧支代偿高于或等于对侧。评估区域包括外侧裂区、基底节区域、大脑前动脉区域和ASPECTS评分中的6个区域(大脑中动脉M1~M6段),共9个区域,共计20分。每一区域的最高分为2分,最低分为0分。其中外侧裂区软脑膜动脉评分采用0、2和4分的计算方法进行评分。根据评分结果分为侧支循环良好(≥17~≤20分)、侧支循环中等(≥11~≤16分)、侧支循环不佳(≤10分)。
1.2.3ICV大小定量分析及分组:将患者的CTP数据结果导入Rapid自动化处理软件得出相关参数,其中ICV定义为相对脑血流量(relative cerebral blood flow,rCBF)≤30%的区域,ICV以50 mL为界分为小梗死核心(small-ischemia core volume,S-ICV)组和L-ICV组。
1.2.4治疗:所有患者治疗启动时间均需在发病24 h内完成,治疗方案按照《中国急性缺血性脑卒中诊治指南2018》[9]和《中国急性缺血性脑卒中早期血管内介入诊疗指南2018》[11]选择。针对拒绝行EVT者采取内科保守(双联抗血小板+强化他汀)治疗。
1.2.5生存分析:患者生存期是指从患者住院结束治疗起至死亡的时间或者末次随访时间的总天数。采用Kaplan-Meier生存分析法分析患者的生存期。
1.2.6随访:记录患者治疗24 h内症状性颅内出血(symptomatic intracranial hemorrhage,sICH)、90 d mRS评分。sICH是指在治疗24 h内患者头颅CT复查出现出血灶,且基线NIHSS评分增加≥4分。治疗后90 d mRS≤2分表示预后良好,mRS>2分表示预后不良。
1.3 统计学处理采用SPSS 21.0软件进行统计学分析。符合正态分布的计量资料采用均数±标准差表示,两均数间比较采用两独立样本t检验;非正态分布的计量资料采用中位数(四分位数间距)表示,采用Mann-WhitneyU检验;计数资料采用卡方检验;将单因素分析中P<0.05的变量作为自变量纳入多因素Logistic回归分析;采用受试者工作特征曲线(ROC)评价ICV大小对临床转归的预测价值;采用Kaplan-Meir生存分析法分析ICV对ALVOS患者生存的影响;采用多因素Cox风险回归模型分析影响L-ICV患者生存的独立危险因素。以P<0.05表示差异具有统计学意义。
2 结果
2.1 患者临床资料比较62例患者中男性40例,女性22例,平均年龄65.55岁。其中S-ICV组38例(61.3%),L-ICV组24例(38.7%)。S-ICV组和L-ICV组患者间高血压比例、基线NIHSS评分、rLMC评分、血红蛋白水平比较差异均有统计学意义(均P<0.05),余临床资料比较差异无统计学意义(均P>0.05)。结果见表1。

表1 两组ALVOS患者临床基线资料比较
2.2 Logistic回归分析将单因素分析中P<0.05的变量作为自变量(高血压:无=0,有=1),以是否发生L-ICV(S-ICV=0,L-ICV=1)作为因变量,进行多因素Logistic回归分析,结果显示血红蛋白是发生L-ICV的独立危险因素,而rLMC是发生L-ICV的保护性因素。结果见表2。
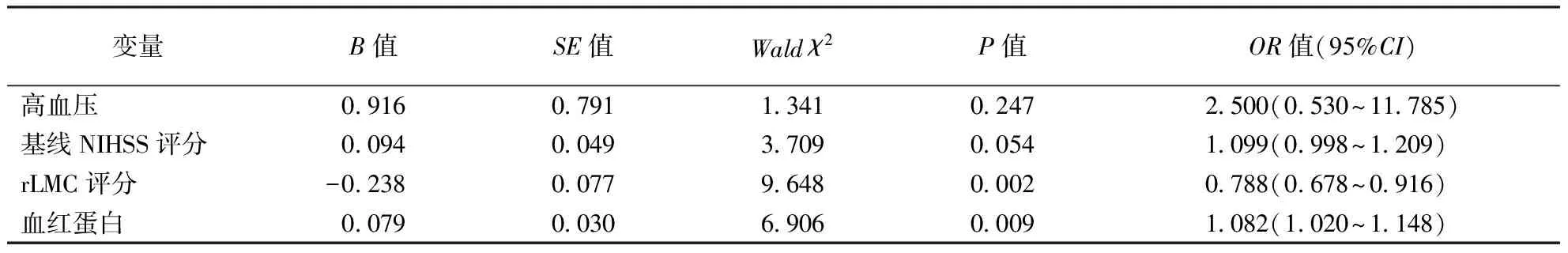
表2 ALVOS患者发生L-ICV危险因素的Logistic回归分析
2.3 临床治疗和转归情况S-ICV组静脉溶栓5例,直接取栓8例,桥接治疗3例,L-ICV组分别为1例、4例、2例,两组患者接受治疗方法的构成比较差异无统计学意义(P>0.05)。与S-ICV组比较,L-ICV组90 d预后良好率低,死亡率高(均P<0.05),而两组患者sICH发生率比较无统计学差异(P>0.05)。结果见表3。

表3 ALVOS患者治疗方法及临床转归的比较〔n(%)〕
2.4 ROC曲线分析ICV大小预测临床预后不良的曲线下面积为0.730(95%CI:0.599~0.862;P=0.006),最佳截断值是52.55 mL,敏感度及特异度分别为47.8%、93.8%。
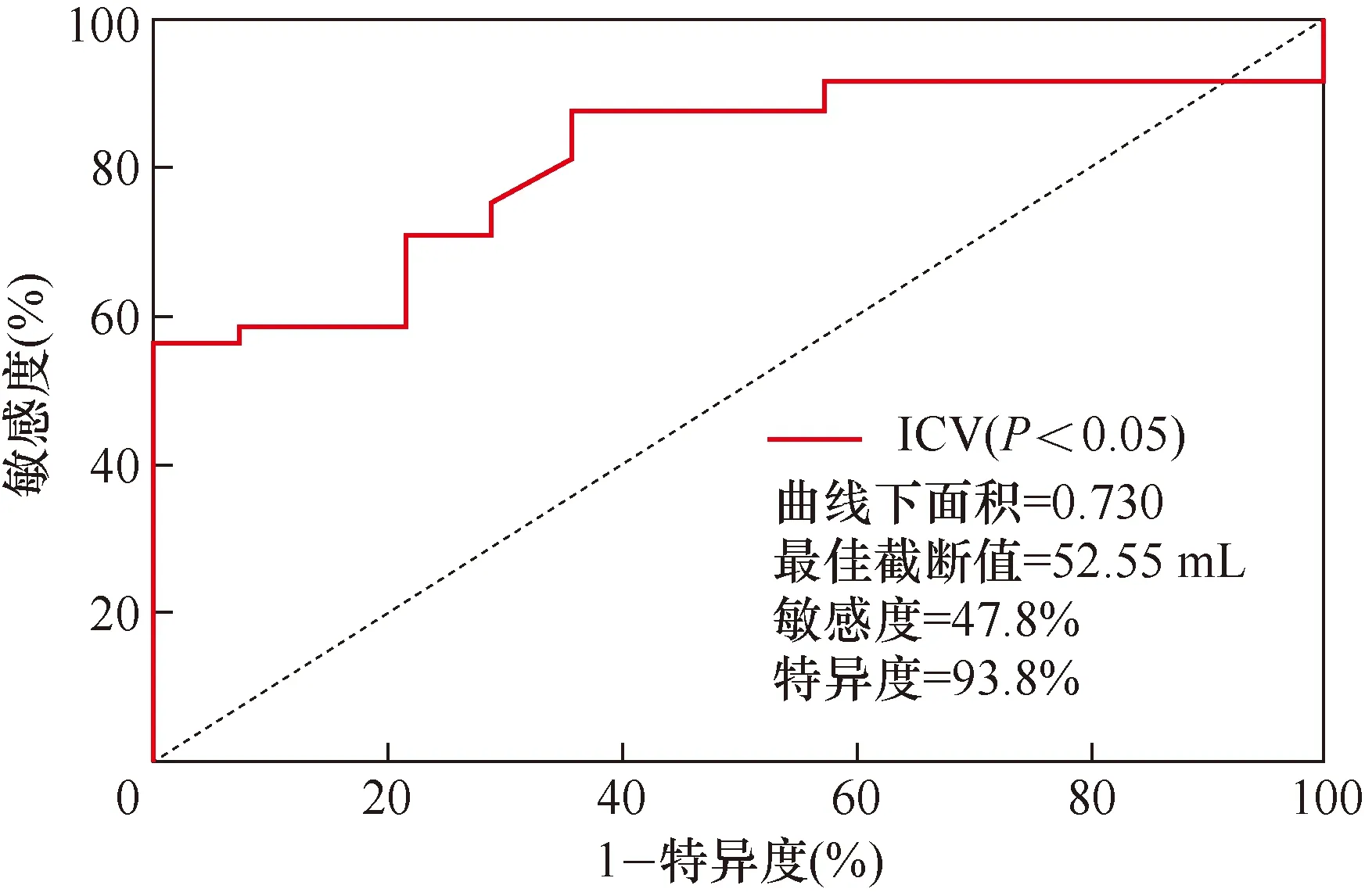
注:ALVOS:急性前循环大血管闭塞性脑卒中;ICV:梗死核心体积
2.5 生存分析Kaplan-Meir生存分析显示,L-ICV患者的生存期低于S-ICV组(P<0.05),结果见图2。进一步对L-ICV组进行多因素Cox风险回归分析显示:糖尿病(HR=1.3832,95%CI:1.040~183.320;P=0.047)和sICH(HR=28.855,95%CI:2.975~279.849;P=0.004)是影响L-ICV脑卒中患者生存的独立因素。

注:ALVOS:急性前循环大血管闭塞性脑卒中;S-ICV:小梗死核心体积;L-ICV:大梗死核心体积
3 讨论
ALVOS患者由于颅内大血管闭塞而容易形成大面积梗死灶,保守治疗预后较差。部分患者经严格的影像学筛选可从EVT治疗中获益。因此早期识别可受益于EVT治疗的ALVOS患者具有重要意义。
侧支循环是挽救缺血半暗带、限制梗死核心增长的保护性因素,侧支良好的ALVOS患者梗死核心形成需要较长的时间,反之亦然[12-13]。相关研究将侧支按等级评分分为良好、中等、不良时发现,相应脑组织ICV将按2.93 mL/h、8.65 mL/h、25.41 mL/h的速度增长,无侧支血流的脑组织每增加1%,梗死核心增长速度在此基线上增加0.57 mL[14]。ALVOS患者早期ICV增长按每5 mL/h的速率增加,其良好率降低14%,是功能预后的独立危险因素[15],但ICV增长速率对死亡率预测不佳[16]。针对发病6~24 h的脑卒中患者分析发现,CTA侧支良好者有着更小的ICV及更大的错配比[17-18]。ALVOS患者侧支血流良好一般指向小的梗死核心和良好预后[19]。不良侧支对静脉溶栓患者的梗死核心增长起到促进作用[20],也象征着大面积梗死灶和不良预后[21]。也有研究认为相对于“时间窗”而言,侧支循环对预后的影响更重要[22]。本研究同样显示,rLMC评分高是抑制L-ICV形成的保护性因素。此外,本研究还显示血红蛋白浓度高是L-ICV形成的独立危险因素,血红蛋白偏高的原因可能与患者感染、血液黏稠度高、脱水等因素相关,进而促使血栓形成。
EVT治疗ALVOS患者可提高血管再通率、有效恢复脑灌注率[2]。准确设定ICV阈值是实施EVT前的关键,既往认为ICV≥50 mL是EVT的禁忌[3]。2022年,一项临床荟萃分析结果显示EVT治疗ASPECTS≤7分且ICV≥50 mL的患者安全、有效[23]。另一项研究对比观察了发病24 h内ICV≥70 mL的ALVOS患者行EVT和非EVT治疗的预后,结果显示ICV在70~100 mL时经EVT治疗的患者3个月的预后较非EVT组好,ICV≥100 mL患者EVT治疗组和非EVT治疗组间预后无统计学差异[24]。由此可见,伴L-ICV的ALVOS患者血管再通治疗可使部分患者获益。本研究显示L-ICV组患者预后差,考虑可能与EVT治疗率低相关。
ROC曲线分析显示ICV预测预后不良的最佳截断值是52.55 mL,这与本研究以ICV=50 mL作为分组依据相一致。有研究显示,ICV与临床预后相关性最强,ICV>130.3 mL的ALVOS患者死亡率高(70%)[25]。本研究结果亦显示L-ICV组患者死亡率高,可能与高血糖、侧支血流、脑疝、出血转化等因素相关[26]。Kim等[27]对发病6 h内进行EVT的ALVOS患者研究发现,ICV≥70 mL是发生sICH的独立危险因素。sICH是EVT治疗后常见的并发症,严重影响患者预后,甚至导致死亡[28]。糖尿病患者,因血糖水平升高而增加梗死灶体积,加重脑组织损伤,增加sICH[29]及死亡[30]风险。因此,针对L-ICV合并糖尿病的ALVOS患者应慎重选择EVT治疗。
综上所述,血红蛋白浓度高、侧支循环差的患者容易形成大梗死核心病灶,且预后差、死亡率高,EVT治疗可能改善预后,而对于合并糖尿病的患者应谨慎实施EVT。由于本研究为回顾性研究,存在病例选择偏倚,且样本量小,有关ALVOS患者ICV的确切影响因素及其与临床预后的确切关系,尚需进一步研究。
