低共熔溶剂提取连翘不同部位总黄酮及抗炎抗氧化活性研究
2023-06-05赵慧杜会枝
赵慧,杜会枝
(山西大学 分子科学研究所,山西 太原 030006)
0 引言
低共熔溶剂(Deep eutectic solvents,DESs)是一种快速兴起的替代传统有机溶剂和离子液体(Ionic liquids,ILs)的新型绿色溶剂,具有生物兼容性、可回收性、可生物降解性、低毒或无毒的特点,因此是当今公认的五类绿色溶剂(水、超临界液体、ILs、DESs 和生物质溶剂)之一[1-2]。DESs 的概念由Abbott 等[3]于2003 年首次提出,是由多种组分间多种分子间相互作用形成的,主要是分子间的氢键相互作用。DESs由氢键供体和氢键受体[4]组成。氢键供体主要是酰胺、羧酸、多元醇等物质,氢键受体有含卤离子的季胺、季鏻盐等,氯化胆碱(ChCl)是最常用的氢键受体。DESs 在气体吸收[5]、酶催化[6]、有机合成[7]等诸多领域展现出良好的发展前景。近年来,DESs 已被广泛用于黄酮、皂苷、多糖、生物碱、酚酸、醌类及挥发油等中药活性成分的提取[8]。
连翘(Forsythiasuspensa(Thunb.) Vahl)为木犀科连翘属植物,传统的应用集中在解热、抗炎等方面[9]。连翘是大宗中药材之一,也是山西省道地药材之一。连翘叶为连翘的叶片,《中华本草》记载“连翘茎叶,性寒,主治心肺积热”[10]。连翘每年的花期为3-4 月份,花期长、花量大,花色鲜黄且长时间不褪色,是一类极其丰富的资源。现代药理研究发现连翘不同部位具有抗菌[11]、抗病毒[12]、抗炎[13]、抗氧化[14]等多种药理作用。连翘不同部位,包括连翘果实、花、叶、茎等的化学成分相似,含量略有不同,主要包括苯乙醇苷类、木脂素类、酚酸类、黄酮类、萜类及挥发油、C6-C2 天然醇及其苷类等[15]。黄酮类化合物是广泛存在于自然界的一大类化合物,其基本母核为2-苯基原色酮。中药材中存在较多黄酮类化合物,目前已知的黄酮种类近万种[16],具有抗氧化和抗炎等生物活性[17]。黄酮类化合物也是连翘中主要成分之一[18],从连翘中分离的黄酮类化合物主要有芦丁、山柰酚、紫云英苷、橙皮苷、槲皮素、异槲皮素、异鼠李素、黄芩苷、金丝桃苷、木犀草素、木犀草苷、橙皮苷等[19]。黄酮类物质的提取有许多方法,如超声波提取法[20]、纤维素酶解法[21]、有机溶剂回流提取法、索氏提取法[22]等。超声波辅助低共熔溶剂提取具有安全环保且不受热破坏等优点。本研究筛选出对连翘总黄酮提取率高的低共熔溶剂,并对连翘不同部位总黄酮进行抗炎和抗氧化活性研究,为研究和开发绿色的总黄酮提取技术提供理论依据和技术参考。
1 材料与方法
1.1 主要试剂与仪器
连翘叶、花和果均于山西省陵川县古郊乡采集,张立伟教授鉴定为连翘植物的叶、花和果。氯化胆碱(ChCl,质量分数为98%)购于上海源叶生物科技有限公司;乙醇、乙二醇、丙三醇、1,2-丙二醇均为分析纯(质量分数为99.7%)购于天津市风船化学试剂科技有限公司;芦丁标准品购于成都曼思特生物科技有限公司(MUST-21011510,质量分数大于98%);1,1-二苯基-2-三硝基苯肼(DPPH,Sigma-Aldrich)购于上海阿拉丁生化科技股份有限公司;FeCl3购于天津市北辰方正试剂厂;2,4,6-三吡啶基三嗪(TPTZ)购于北京索莱宝科技有限公司;醋酸钠购于天津光复化学试剂厂;FeSO4·7H2O 购于天津市科密欧化学试剂有限公司;NaNO2、Al(NO3)3、NaOH 均购于天津市恒兴化学试剂制造有限公司;DMEM 高糖培养基购于博士德生物工程有限公司;青霉素和链霉素混合液购于北京索莱宝科技有限公司;胎牛血清购于杭州四季青生物材料公司;脂多糖(LPS,质量分数大于98%)购于北京索莱宝科技有限公司;过氧化氢(H2O2,质量分数为3%)购于博士德生物工程有限公司;CCK-8 试剂盒购于MedChemExpress;一氧化氮(NO)、丙二醛(MDA)试剂盒购于南京建成生物工程研究所;小鼠肿瘤坏死因子-α(TNF-α)试剂盒购于上海西唐生物科技有限公司;超氧化物歧化酶(SOD)试剂盒购于上海碧云天生物技术有限公司;BCA 蛋白浓度测定试剂盒购于博士德生物工程有限公司。
超声波清洗器:SK2200HP,上海科导超声仪器有限公司;集热式恒温磁力搅拌器:DF101-S,河南省巩义市予华仪器有限责任公司;酶标仪:MD Spectra Max 190,美国Molecular devices 公司;紫外可见分光光度计:珀金埃尔默仪器有限公司;倒置荧光显微镜:上海尼康公司;扫描电子显微镜:JEOL-JSM-6701F,日本电子公司。
1.2 DESs的制备
按一定摩尔比将ChCl 和氢键供体(乙二醇,1,2-丙二醇,丙三醇)置于烧杯中,90 ℃水浴加热搅拌6 h~12 h,直至形成透明无色的液体,室温放置一段时间后性状不会改变。见表1。

表1 DESs,其中ChCl是氢键受体Table 1 DESs, where ChCl is a hydrogen bond receptor
1.3 不同溶剂对连翘叶、花、果中总黄酮的提取
把连翘叶、花、果研磨粉碎,过40 目筛后低温密封避光保存。按照液固比15 mL/g 的比例将DESs 和连翘粉末混匀,超声波辅助提取:提取功率200 W,提取时间1 h,用相应溶剂补重,摇匀,离心后得到连翘不同部位的DESs 提取液。同时用水和体积分数为60%乙醇进行提取,方法同上。
做细胞实验前连翘不同部位提取液需用无菌0.22 μm 微孔滤膜过滤。
1.4 绘制芦丁标准曲线
用体积分数95% 乙醇溶解芦丁标准品得0.2 mg/mL 芦丁溶液,分别吸取0.0、2.0、4.0、6.0、8.0、10.0 mL 芦丁溶液于25 mL 容量瓶中,分别加入1.0 mL 质量分数5%的NaNO2溶液,静置6 min 后加入1.0 mL 质量分数10%的Al(NO3)3溶液,再静置6 min;最后加10.0 mL质量分数4%的NaOH 溶液,用体积分数60%乙醇(下同)定容,摇匀,室温静置15 min,最后用紫外分光光度计测定510 nm 处各组溶液的吸光度值[23]。横坐标(X)为溶液质量浓度,纵坐标(Y)为吸光度值,绘制标准曲线,芦丁浓度在0~0.08 mg/mL 范围有较好的线性关系,标准曲线如图1 所示,Y=12.802X+ 0.042,R2=0.999 8。
1.5 连翘总黄酮提取率计算
取适量提取液,稀释后按照1.4 的方法测定其吸光度,重复3 次,吸光度值代入回归方程,求出提取液中总黄酮的质量浓度C,然后根据公式计算总黄酮提取率:Y=(C×V0×V1)/(m×V2),其中Y为总黄酮提取率,V0为定容后体积,V1为提取液总体积,V2为测定用的体积,m为药材的质量。
1.6 DPPH·法测定连翘提取液的抗氧化活性
配制100 μmol/L 的DPPH 乙醇溶液。将连翘提取液以每孔100 μL 加入96 孔板中(空白对照组中加入100 μL DES-3),再加入100 μL DPPH 乙醇溶液,于25 ℃避光孵育30 min,520 nm 处检测吸光度值。根据公式计算清除率:清除率(%)=(1-A1/A2)×100%,其中A1为样品吸光度,A2为空白对照吸光度。
1.7 FRAP法检测连翘提取液的总抗氧化能力
采用改良的Benzie 等的方法检测连翘不同部位提取液的总抗氧化能力[24-25]。配制pH 为3.6 的300 mmol/L 醋酸钠缓冲液、10 mmol/L 的TPTZ 溶液、20 mmol/L FeCl3溶液,按照10∶1∶1的体积比将上述溶液混合得到FRAP 工作液。13.9 mg FeSO4·7H2O 溶于50 mL 去离子水中,再将其稀释为不同浓度的FeSO4溶液。取20 μL FeSO4溶液,加入180 μL FRAP 工作液,混匀后37 ℃孵育10 min,用酶标仪在593 nm 处测吸光度值,FeSO4浓度为横坐标,吸光度值为纵坐标,建立FeSO4当量标准曲线,标准曲线方程为:Y=1.164X+0.110,R2=0.998 9,如图2所示。

图2 硫酸亚铁标准曲线Fig.2 The standard curve of FeSO4
样品总抗氧化能力测定:取20 μL 样品溶液,加入180 μL FRAP 工作液,混匀后在37 ℃孵育10 min,593 nm 处测吸光度值,根据吸光度值在标准曲线上求得相应FeSO4的浓度,定义为FRAP 值,FRAP 值越大,抗氧化能力越强。
1.8 细胞活力、炎症因子、氧化因子的测定
RAW264.7 细胞在DMEM 高糖培养基中培养,待细胞长到对数期进行传代或用于实验。将细胞分为对照组、模型组、给药组。对照组为正常培养的细胞;模型组用LPS(2 μg/mL)或H2O2(800 μmol/L)诱导24 h;给药组用相应提取液预处理2 h 后,再用LPS 或H2O2诱导24 h。
CCK-8 法检测细胞存活率:避光条件下每孔加入10 μL CCK-8,培养箱中放置1 h 后450 nm 处测吸光度值。NO 和TNF-α 含量测定:收集细胞上清液,根据相应说明书进行操作,分别在540 nm 和450 nm 测定吸光度值,根据公式计算出NO 和TNF-α 的含量。MDA 和SOD 试剂盒:收集各组细胞,裂解,利用BCA 试剂盒建立标准曲线,根据标准曲线计算各组细胞蛋白浓度,参照MDA 试剂盒和SOD 试剂盒的说明书分别检测样品中MDA 含量和SOD 酶活力。
1.9 统计学分析
采用统计学方法进行数据分析,文中的数据都是以平均值±标准差表示,n= 3,用Origin 2018 对所得数据进行显著性差异分析。P<0.05 具有统计学意义。
2 结果与讨论
2.1 筛选DESs
本文使用三种多元醇与ChCl 以不同比例成功制备了7 种DESs,列于表1。用DESs、水和60%乙醇在相同条件下超声波辅助提取连翘不同部位总黄酮。不同溶剂对连翘不同部位总黄酮的提取率如图3 所示。不同溶剂对连翘叶总黄酮提取率顺序为:DES-3 > DES-4 >> DES-1 > DES-7 > DES-6 >> 60%乙醇 > DES-2 > DES-5 > 水。在DES-3 条件下,超声波辅助提取连翘叶总黄酮提取率达到最大,为481.33 mg/g。不同溶剂中连翘花总黄酮提取率顺序为:DES-3 >> DES-5 >DES-7 > DES-6 > DES-1 > DES-2 > 60%
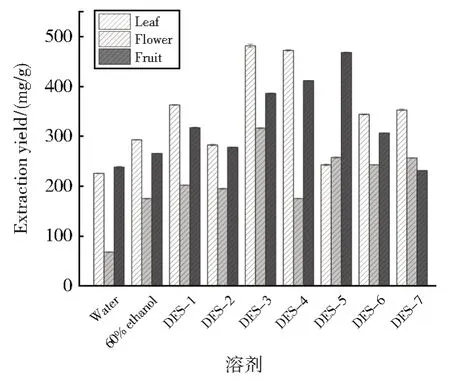
图3 不同溶剂中连翘不同部位的总黄酮提取率Fig.3 Extraction rate of total flavonoids from different parts of Forsythia suspensa in different solvents
乙醇 > DES-4 >> 水。在DES-3 条件下,超声波辅助提取连翘花总黄酮提取效果最佳,提取率达到361.35 mg/g。不同溶剂中连翘果实总黄酮提取率顺序为:DES-5 > DES-4 >DES-3 >> DES-1 > DES-6 > DES-2 >60% 乙醇 > 水 > DES-7,连翘果总黄酮在DES-5 的提取率最高,为467.84 mg/g。60%乙醇、DES-1、DES-2、DES-3、DES-4 及DES-6中连翘不同部位总黄酮提取率顺序为:叶 >果 > 花;水作为溶剂时,连翘不同部位总黄酮提取率顺序为:叶 ≈ 果 > 花;DES-5 中连翘不同部位总黄酮提取率顺序为:果 >> 花 ≈叶;DES-7 中连翘不同部位总黄酮提取率顺序为:叶 > 花 > 果;总体来说DESs 的提取效果好于乙醇和水,本文所用的溶剂中,大部分溶剂对连翘不同部位总黄酮的提取率顺序为:叶 > 果 > 花。在保证提取率高且使用同一溶剂的情况下,选取DES-3 作为后续实验中的提取溶剂。
2.2 连翘不同部位提取前后的扫描电镜观察
扫描电镜是一种观察样品表面形态的重要检测技术手段,有较高的分辨率和放大倍数,能使物质的图像呈现立体感,而且样品制备简单[26],甚至还可直接观察一些新鲜药材和粉末[27]。本文中,我们利用扫描电子显微镜观察DES-3 超声波辅助提取前后连翘不同部位微观结构的变化(图4,×3000),以此来探索植物细胞破碎程度与植物细胞中化合物释放率之间的关系。从图中我们不难发现,提取前后连翘细胞表面的完整性有较大的变化,提取后连翘不同部位细胞出现明显的破裂和塌陷。其破碎程度与提取率表现出了明显的正相关,连翘叶破损程度最大,其次是连翘果实,最后是连翘花。

图4 DES-3提取连翘不同部位前后的扫描电子显微镜图DES-3超声波辅助提取前(a)和后(b)的连翘叶粉末,DES-3超声波辅助提取前(c)和后(d)的连翘花粉末,DES-3超声波辅助提取前(e)和后(f)的连翘果实粉末Fig.4 SEM images of different parts of Forsythia suspensa before and after extraction in DES-3Forsythia suspensa leaf powder before (a) and after (b) extraction in DES-3, Forsythia suspensa flower powder before (c) and after(d) extraction in DES-3, Forsythia suspensa fruit powder before (e) and after (f) extraction in DES-3
2.3 化学水平评估连翘不同部位提取液的抗氧化活性
DPPH·多用于测定化合物、提取物等的体外抗氧化能力。采用DES-3 对连翘不同部位提取,通过DPPH·自由基清除实验进行抗氧化活性分析。如图5(a)所示,连翘叶、花、果提取液均有一定的抗氧化作用,其中连翘叶提取液对DPPH·自由基清除率为72.81%,连翘花提取液对DPPH·自由基清除率为63.64%,连翘果提取液对DPPH·自由基清除率为67.86%。连翘叶提取液的抗氧化活性大于连翘果提取液的抗氧化活性,连翘花提取液的抗氧化活性较弱。连翘不同部位提取液的自由基清除率与其总黄酮含量呈正相关,即总黄酮含量越高,对DPPH·自由基的清除率越高。抗氧化物在酸性条件下,可将Fe3+-TPTZ(橘黄色)还原成Fe2+-TPTZ(蓝紫色),根据FRAP 值大小可以衡量样品的总抗氧化能力[27]。根据标准曲线计算连翘不同部位提取液的FRAP 值,如图5(b)所示,连翘叶组的FRAP 值为1.13 mmol/L,连翘花组的FRAP 值为0.89 mmol/L,连翘果组的FRAP 值为1.11 mmol/L,与DPPH·结果一致,连翘叶组的FRAP 值略大于连翘果组,连翘花组的FRAP值最小。连翘不同部位提取液的FRAP 值与总黄酮含量呈正相关,即总黄酮含量越高,FRAP值越大。结合DPPH·自由基清除率和FRAP值,说明连翘不同部位提取液的抗氧化活性与其总黄酮含量呈正相关,即总黄酮含量越高,抗氧化活性越强。
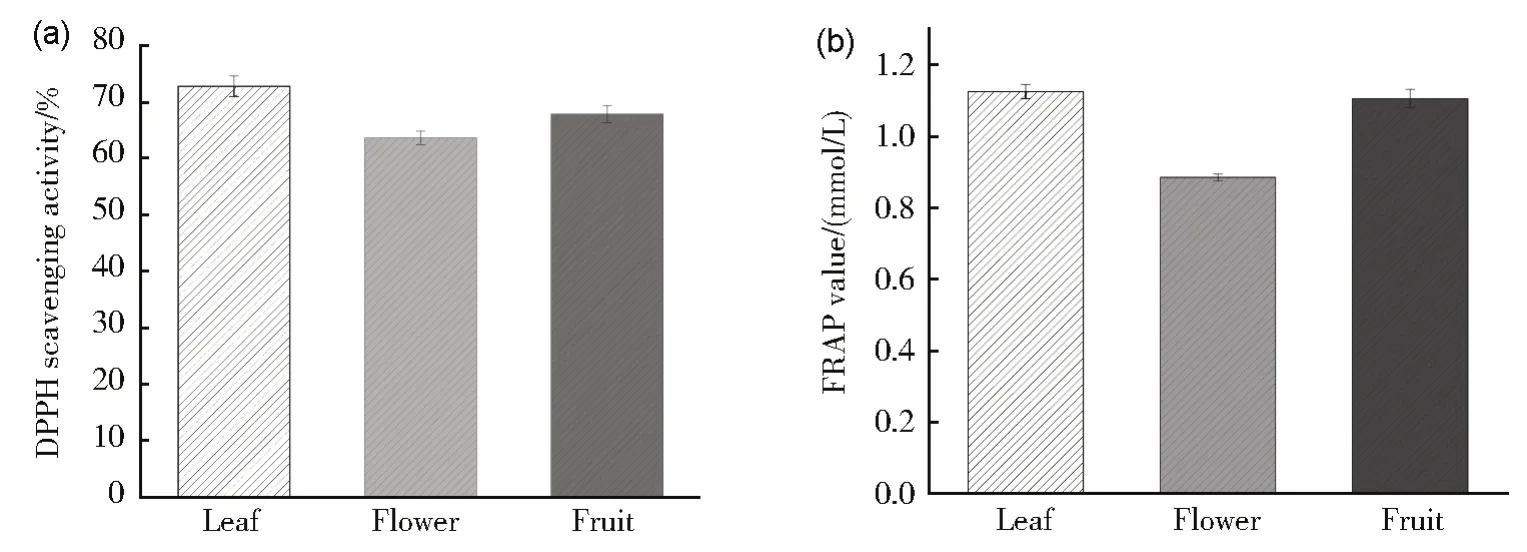
图5 连翘不同部位提取液在化学水平的抗氧化活性评估(a)连翘不同部位提取液对DPPH·自由基清除率;(b)连翘不同部位提取液的总抗氧化能力测定Fig.5 Antioxidant activity of extracts of different parts of Forsythia suspensa at chemical level(a) Comparison of DPPH· free radical scavenging rate among extracts of different parts of Forsythia suspensa; (b) Determination of total antioxidant capacity of extracts of different parts of Forsythia suspensa
2.4 连翘不同部位提取液在细胞水平的抗氧化活性评价
H2O2诱导的RAW264.7 巨噬细胞氧化损伤模型,常用于物质的抗氧化活性研究。MDA 含量是反映机体抗氧化潜能的重要参数,间接反映细胞损伤的程度[28]。SOD 是一种抗氧化金属酶,在机体氧化与抗氧化平衡中起到至关重要的作用[29]。在H2O2诱导的RAW264.7 巨噬细胞氧化损伤模型上,本文研究了DES-3 中连翘不同部位提取液的抗氧化能力。图6(a)表明H2O2模型组的MDA 含量显著高于空白对照组;与H2O2模型组相比,连翘不同部位提取液均降低了MDA 的含量,模型组MDA 含量为1.26 nmol/mg,连翘叶组的MDA 含量为0.65 nmol/mg,降低了48.41%;连翘花组的MDA 含量0.84 nmol/mg,降低了33.33%;连翘果组的MDA 含量为0.81 nmol/mg,降低了35.71%。连翘叶组MDA 值的降低幅度大于连翘果组,连翘花组的最小。从图6(b)中得出H2O2模型组的SOD 活力(0.47 U)显著低于空白对照组(1.11 U);与H2O2模型组相比,连翘不同部位提取液不同程度地提高了SOD 的活力,连翘叶组的SOD 活力为0.75 U,提高了59.57%,连翘花组的SOD 活力为0.49 U,提高了4.26%;连翘果组的SOD活力为0.60 U,提高了27.66%;连翘叶组的SOD 活力大于连翘果组的,连翘花组的最弱。总之,连翘叶提取液的抗氧化活性大于连翘果提取液的,连翘花提取液的抗氧化活性最弱。连翘不同部位提取液的抗氧化活性与其总黄酮含量呈正相关,总黄酮含量越高,抗氧化活性越强。

图6 连翘不同部位提取液对细胞水平的抗氧化活性评价(a)连翘不同部位提取液对MDA含量的影响;(b)连翘不同部位提取液对SOD活力的影响。相比于对照组,### P <0.001,## P <0.01;相比于H2O2组,*** P < 0.001,** P < 0.01,* P < 0.05。NS为无差异Fig.6 Antioxidant activity of extract from different parts of Forsythia suspensa at cell level(a) Effects of extracts from different parts of Forsythia suspensa on MDA content; (b) Effects of extracts from different parts of Forsythia suspensa on SOD activity.### P < 0.001 and ## P <0.01 vs.the control group, *** P < 0.001 and **P < 0.01,* P < 0.05 vs.H2O2 group.NS means no significant difference
2.5 连翘不同部位提取液在细胞水平的抗炎活性评估
LPS 诱导的RAW264.7 细胞体外炎症模型常用于物质的抗炎活性研究。NO 是炎症反应中发挥重要作用的促炎因子,过量的NO 可导致DNA 损伤,诱导凋亡和氧化应激,其分泌量可间接反映炎症程度[30]。TNF-α 是一种多向性的促炎性细胞因子,也是一种单核因子(炎症因子),具有广泛的生物学效应,参与炎症反应,介导休克、组织损伤的过程[31]。利用LPS诱导RAW264.7 巨噬细胞炎症模型,本文评估了DES-3 中连翘不同部位提取液的抗炎活性。首先用CCK-8 检测各组的细胞活力,如图7a 如示,提取液具有减轻细胞损伤和增加细胞活力的作用。与对照比相比,LPS 模型组细胞存活率为58.98%,加入连翘叶提取液,细胞存活率恢复至79.50%,连翘花组的细胞存活率为64.27%,连翘果组的细胞存活率为72.00%。连翘叶对LPS 诱导的RAW264.7 细胞活力回调效果最好,连翘果组次之,连翘花组较弱。图7(b)表明与LPS 组相比,连翘叶、花、果均降低了NO 的含量,模型组的NO 含量为36.53 μmol/L,连翘叶组的NO 含量为6.07 μmol/L,降低了83.38%;连翘果组的NO 含量为12.47 μmol/L,降低了65.86%;连翘花组的NO 含量为14.59 μmol/L,降低了60.06%。连翘叶组的NO 含量小于连翘果组,连翘花组的NO 含量最高。图7(c)显示,与LPS 模型组相比,连翘不同部位提取液降低了炎症因子TNF-α 的含量;模型组TNF-α 含量为809.16 pg/mL,连翘叶组的TNF- α 含量为538.91 pg/mL,降低了33.40%;连翘果组的TNF-α 含量为671.83 pg/mL,降低了16.97%;连翘花组的TNF-α 含量含为805.93 pg/mL,降低了3.99%。连翘叶组的TNF-α 含量降低最多,连翘果组次之,连翘花组最弱。总之,连翘叶提取液的抗炎活性大于连翘果提取液,连翘花提取液的抗炎活性最弱。连翘不同部位提取液的抗炎活性与其总黄酮含量呈正相关,总黄酮含量越高,抗炎活性越高。
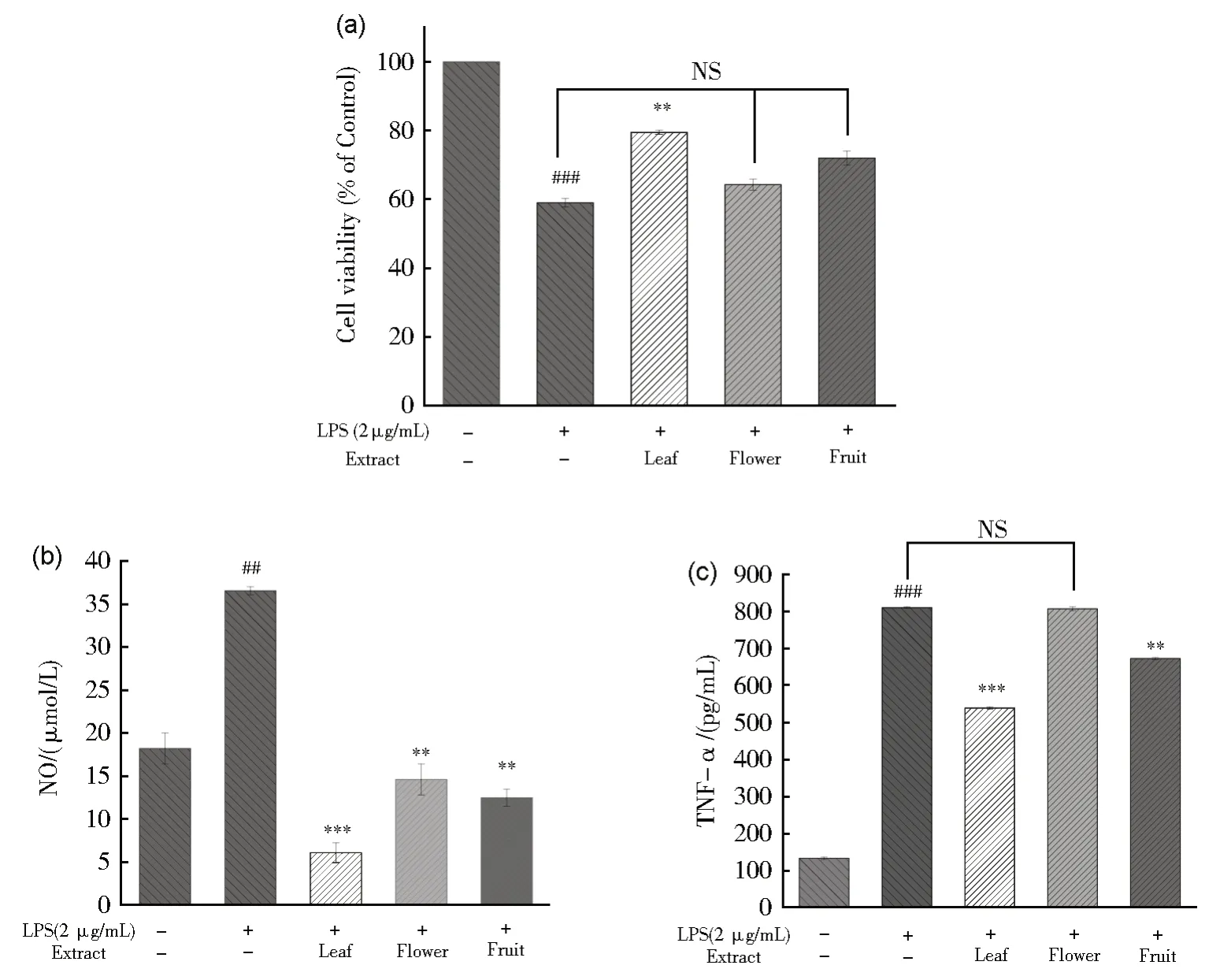
图7 连翘不同部位提取液的抗炎活性评价(a)CCK-8法检测细胞活力;(b)连翘不同部位提取液对NO含量的影响;(c)连翘不同部位提取液对TNF-α含量的影响。相比于对照组,### P <0.001,## P <0.01;相比于LPS组,*** P < 0.001,** P < 0.01。NS为无差异Fig.7 Anti-inflammatory activity evaluation of extracts from different parts of Forsythia suspensa(a) Cell viability was detected by CCK-8 method; (b) Effects of extracts from different parts of Forsythia suspensa on NO content; (c) Effects of extracts from different parts of Forsythia suspensa on TNF-α content in LPS-induced inflammatory model.### P < 0.001, ## P <0.01 vs.the control group, *** P < 0.001 and **P < 0.01 vs.LPS group.NS means no significant difference
3 结论
本文采用超声波辅助低共熔溶剂提取连翘不同部位总黄酮,并研究了其抗炎抗氧化活性。提取条件为液固比15 mL/g,提取功率200 W,提取温度60 ℃,时间1 h。通过含量测定得出,同种溶剂中总黄酮含量顺序大致为:连翘叶 > 连翘果 > 连翘花;不同溶剂中连翘叶总黄酮提取率顺序为:DES-3 > DES-4 >>DES-1 > DES-7 > DES-6 >> 60% 乙醇 >DES-2 > DES-5 > 水。筛选出最优提取溶剂为DES-3,即氯化胆碱(Cholinechloride,ChCl)∶丙三醇=1∶1。扫描电镜观察发现超声波辅助DES-3 提取对连翘不同部位均有较好的破壁效果,其中,对连翘叶的破损程度最大,连翘果次之,连翘花的破损程度较差。化学水平上分别用DPPH·法和FRAP 法测定连翘不同部位DES-3 提取液的抗氧化活性,结果显示,连翘叶的抗氧化活性大于连翘果,连翘花的抗氧化活性最弱。用LPS 和H2O2分别建立RAW264.7 细胞炎症和氧化损伤模型,CCK-8 法检测细胞存活率,结果显示连翘不同部位DES-3 提取液具有增强细胞活力的作用。用NO 和TNF-α 试剂盒分别检测细胞培养液中NO 和TNF-α 含量,实验结果表明,连翘不同部位DES-3 提取液均降低了NO 和TNF-α 含量,且提取液中的总黄酮含量越高,抗炎活性越强,即连翘叶的抗炎活性大于连翘果,连翘花的抗炎活性较低。用MDA 和SOD 试剂盒检测细胞中MDA 含量和SOD 活力,结果发现连翘不同部位提取液降低了MDA 含量,提高了SOD 的活力,且提取液中总黄酮含量越高,抗氧化活性越强,即连翘叶的抗氧化活性大于连翘果,连翘花的抗氧化活性较弱。综上所述,基于超声波辅助低共熔溶剂提取的连翘不同部位总黄酮具有一定的抗炎和抗氧化活性,且总黄酮含量越高,抗炎和抗氧化活性越强。
