Gitelman 综合征合并2 型糖尿病1 例
2023-06-05黄春华曾庆华赵新闻
黄春华, 曾庆华, 赵新闻
(1.中山大学孙逸仙纪念医院呼吸与危重症医学科,广州 510120; 2.沧州市中心医院急诊医学部,沧州 061000;3. 青岛市市立医院西院区心内科,青岛 266000)
GS 是由编码肾脏远曲小管钠-氯协同转运蛋白的SLC12A3 基因突变所致的常染色体隐性遗传病,典型GS 患者表现为低血钾、低血镁、低尿钙、低血压和继发性醛固酮激活状态[1-2]。2 型糖尿病主要是由胰岛素抵抗和胰岛素分泌不足引起。GS 是一种罕见的常染色体隐性遗传病,发病率为1/50 000,杂合体携带者约1/100,其中亚洲人群发病率高于欧美人群,日本杂合体携带者高达6.4%[3]。GS 是我国首批121 种罕见病之一,常见的临床表现多为非特异性,常累及骨骼肌、肾脏、胃肠道、心血管和神经系统,出现如肢体乏力、麻木、肌肉痉挛、抽搐、口渴、多饮、多尿、蛋白尿、嗜盐、血压偏低、低钾血症、关节痛、生长发育迟缓等症状[4]。本例患者全身阵发性乏力、麻木伴低钾血症、低镁血症,通过SLC12A3 基因Sanger测序诊断明确。具体情况报道如下。
1 病历资料
1.1 一般资料 患者,女,62 岁,因“乏力7 年,全身不适2 周”入院。患者于7 年前无明显诱因出现阵发性全身乏力、麻木,累及四肢,伴有多饮、多食、多尿及体质量减轻的症状。在外院反复就诊,检验结果提示低钾血症、低镁血症、高血糖,曾行口服葡萄糖耐量试验(OGTT),测得空腹、0.5 h、1 h、2 h 血糖分别为7.83 mmol·L-1、16.05 mmol·L-1、13.34 mmol·L-1、12.28 mmol·L-1;糖尿病自身抗体检测:胰岛细胞抗体(ICA)、胰岛素抗体(IAA)、谷氨酸脱羧酶抗体(GADA)均为阴性,诊断为2 型糖尿病。通过SLC12A3 基因Sanger 测序(图1),诊断为Gitelman 综合征(GS)。口服氯化钾4 片、门冬氨酸钾镁2 片、螺内酯1片,均为3 次/d,患者乏力逐渐减轻,血钾控制欠佳。2 周前,患者感全身不适、肌肉酸痛,自测空腹血糖为7~16 mmol·L-1,间断口服瑞格列奈,空腹及餐后血糖控制差,胃纳可,尿量约2 000 mL·d-1。未使用利尿剂、胰岛素及其他药物,无慢性腹泻、呕吐病史,无类似疾病家族史。
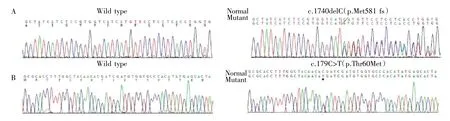
图1 突变的SLC12A3 基因测序图谱
1.2 体格检查及实验室检查 体温:36.8 ℃,脉搏:88 次/min,呼吸:15 次/min,血压:107/62 mmHg,身高:150 cm,体质量:51 kg,身体质量指数(BMI):22.67 kg·m-2。发育正常,无突眼及满月脸,甲状腺正常,心肺及腹部无异常,双下肢无水肿,四肢肌力5 级,肌张力无异常。入院检验:糖化血红蛋白6.70%;生化检查:钾2.77 mmol·L-1,镁0.51 mmol·L-1,钠136.00 mmol·L-1,氯93.00 mmol·L-1,钙 1.98 mmol·L-1,24 h 尿钙:0.25 mmol·L-1。OGTT测得空腹、0.5 h、1 h、2 h 血糖分别为5.06、9.95、9.35、8.74 和8.00 mmol·L-1;C 肽释放试验测得空腹、0.5 h、1 h、2 h、3 h 的C 肽分别为1.69、4.70、6.24、6.95 和5.76 ng·mL-1。OGTT 及C 肽释放试验提示患者高峰稍延迟。予以氯化钾2.0 g、门冬氨酸钾镁1.2 g、螺内酯20 mg,均为3 次/d;1 周后患者乏力症状明显改善,复查血清钾4.05 mmol·L-1,钙2.27 mmol·L-1,镁0.60 mmol·L-1,钠133.66 mmol·L-1。治疗期间及出院后3 个月,未予降糖药,患者测空腹血糖为5.4~7.0 mmol·L-1,餐后血糖为7~13 mmol·L-1。
2 讨论
研究[5]表明,低钾血症和低镁血症是GS 中主要损害胰岛素分泌的两种电解质异常。胰岛素分泌的主要调节因子是葡萄糖,它能增加细胞ATP,并使细胞膜上依赖ATP 的钾通道失活。低钾血症被认为是胰岛素分泌障碍的原因之一,低钾饮食会导致机体胰岛素分泌缺陷和对胰岛素敏感性下降。胰岛素通过胰岛素受体利用葡萄糖,诱导镁离子从细胞外转运到细胞内。低镁血症时降低了胰岛素的敏感性。当细胞内镁离子浓度降低,细胞利用葡萄糖的能力降低,发生胰岛素抵抗[6]。此外,胰岛素是肾Mg2+通道TRMP6 的重要调节因子,胰岛素分泌抑制或敏感性降低反过来会促进低镁血症的发生。心率和胰岛素抵抗指数之间存在相关性,表明交感神经活动的增加对胰岛素抵抗有影响。14%~60% 的GS 患者可出现糖代谢异常[7-8]。GS 与2 型糖尿病相互影响的确切机制还有待进一步研究。在临床上遇到糖尿病或糖尿病酮症酸中毒(DKA)的患者同时伴有单纯补钾和降糖治疗无效时,要考虑患者是否合并GS 疾病,可考虑基因检测,低镁血症时可尝试补充镁离子治疗。
本例患者糖尿病史多年,未规范诊治,此次行OGTT 和C 肽释放试验,结果显示,患者在低钾血症、低镁血症时,C 肽高峰延迟,血糖控制欠佳,说明患者在未规律补充钾和镁时存在血糖代谢异常和胰岛素抵抗。目前,国内外对于本病的共识为推荐患者血钾维持在3.0 mmol·L-1以上,血镁维持在0.6 mmol·L-1以上[9-10]。GS 患者在接受规律补钾和补镁期间,空腹血糖波动在5.4~7 mmol·L-1,在血钾、血镁改善后,最终停用降糖药物后血糖水平正常,说明了钾和镁在机体糖代谢中具有重要作用。患者本次入院前长期口服大量氯化钾,血钾控制不佳。住院后调整治疗方案,补钾的同时予增加补镁治疗,复查血钾基本稳定且在正常范围。因此,患者同时存在钾、镁缺乏时,不能忽视补镁。有研究[11-12]表明,醛固酮受体拮抗剂螺内酯可将部分GS 患者的血钾水平恢复至正常,但其不良反应较多,不适合临床长期应用。其他保钾利尿剂及前列腺素合成酶抑制剂也可应用于GS 的治疗,但目前缺乏大型的临床应用研究提供参考依据。Blanchard 等[13]发现,GS 组胰岛素抵抗与BMI 相关,BMI 在正常范围内更有利于改善胰岛素抵抗。因此,饮食控制是预防GS 患者合并糖尿病的重要因素。
综上所述,胰岛素抵抗使糖耐量正常者发生胰岛β 细胞功能损害并进一步衰竭,进而导致糖尿病。GS 患者可能较非GS 人群糖尿病发病风险更高。在临床上遇到疑似GS 合并高血糖或糖尿病患者时,应尽量完善患者及家族的基因测序以明确诊断。
