泌乳高峰期娟犏牛和牦牛乳汁差异蛋白分析
2023-06-05潘阳阳王立斌邱山桐余四九徐庚全
高 娜 潘阳阳 王 萌 王立斌 邱山桐 余 震 余四九 徐庚全
(甘肃农业大学动物医学院,甘肃 兰州 730070)
牦牛(Bos grunniens)是高海拔高寒地区重要的生物物种[1]。牦牛奶具有天然浓缩乳之称,易消化吸收,奶中蛋白质具有提高机体免疫力、预防心脑血管疾病和促进婴幼儿生长发育等功效[2]。随着我国国民生活水平的提高,人们对奶及奶制品的需求急剧增加,但牦牛生产性能较差,品种原始,泌乳量较其他牛低,不能满足人们对高品质牦牛奶日益增长的需求。为提高牦牛奶产量,甘肃农业大学余四九团队成功利用娟姗牛及其冻精杂交改良甘南牦牛,繁育生产出优质娟犏牛(Bos taurus)[3],其耐粗饲料、生长发育快,对环境的适应性强。对娟犏牛乳的营养成分进行测定,发现其乳蛋白质、乳脂率和非乳脂固体等乳成分高于当地黄犏牛乳,接近优质牦牛乳品质[4],且娟犏牛初胎的挤奶量是牦牛的4~5 倍[5]。然而,娟犏牛乳品质与牦牛乳是否有差异还需进一步研究。
牛奶均能够为机体提供酶、激素和免疫成分等,这些营养成分均对婴幼儿的生长发育有着极其重要的功能。近年来,随着蛋白质组学技术的不断发展,在牦牛[6]、人[7]、山羊[8]、驴[9]和奶牛[10]等物种的乳汁中鉴定到了多种蛋白质。Li 等[11]采用串联质谱(tandem mass tag,TMT)标记蛋白质组学方法在Murrah、Nili Ravi 和Mediterranean 水牛乳清蛋白中共鉴定到580 种蛋白质。Yang 等[6]基于同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ)技术,采用蛋白质组学方法分析了牛、牦牛、水牛、山羊和骆驼的乳汁中的乳清蛋白质组。Jin 等[7]利用数据独立采集(data-independent acquisition,DIA)方法确定了母乳乳清蛋白组的差异,并评估了哺乳期对母乳的影响。但鲜见利用TMT 标记蛋白质组学方法分析泌乳高峰期娟犏牛奶和牦牛奶乳清与乳脂球膜(milk fat globule membrane,MFGM)蛋白的研究报道。
鉴于此,本试验运用TMT 标记蛋白质组学的方法,通过基因本体(gene ontology,GO)分析差异表达蛋白(differentially expressed proreins,DEPs)的细胞组成、分子功能及其参与的生物过程,通过京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)分析DEPs 参与的主要信号通路,通过蛋白质-蛋白质相互作用网络(protein-protein interaction,PPI)探究DEPs间的功能相关性,比较泌乳高峰期娟犏牛奶与牦牛奶乳清和MFGM 蛋白表达的差异,旨在为高原奶制品的开发提供帮助,为生产接近母乳的功能性婴幼儿配方乳粉提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 样品采集 于2022 年8 月采集处于泌乳高峰期娟犏牛奶和牦牛奶各30 份,均采自甘肃省甘南州夏河县阿木去乎镇牙力吉乡。娟犏牛和牦牛两者属于草原散养。采集样本每份均来自不同奶牛,每只牛采集200 mL 奶样。所采泌乳高峰期娟犏牛奶样与牦牛奶样各随机平均分为3 组,每组10 份样本,3 组间互为重复。所有样本低温运回实验室,-80 ℃超低温冰箱保存备用。具体采样信息见电子附表1。
1.1.2 主要试剂 TMTpro 16 标记试剂盒、二喹啉甲酸(bicinchonininc acid,BCA)试剂盒、质谱级与色谱级乙腈(acetonitrile,ACN)、甲酸(formic acid,FA)、未染色蛋白分子量标记和质谱(mass spectrum,MS)级水,上海ThermoScientific 公司;氯化钠、三(羟甲基)氨基甲烷盐酸盐(tris hydrochloride,Tris-HCl)、苯甲基磺酰氟(phenylmethyl sulfonyl fluoride,PMSF)、二硫苏糖醇(dithiothreitol,DTT)、甘油、3-吲哚乙酸(3-indole acetic acid,IAA),上海生工生物工程股份有限公司;十二烷基磺酸钠(sodium dodecyl sulfate,SDS)裂解液,上海碧云天生物技术有限公司;预制胶,南京金斯瑞生物科技股份有限公司提供;胰酶,上海华利世科技有限公司;四乙基溴化铵(tetraethylammonium bromide,TEAB),美国Sigma公司;丙酮(色谱纯),北京沃凯生物科技有限公司。
1.1.3 仪器与设备 Q Exactive HF 质谱仪、EasynLC 1000 液相系统,上海ThermoFisher 公司;TGL-16A台式冷冻离心机,上海卢湘仪离心机仪器有限公司;SDS-PAGE 凝胶电泳仪,北京市六一仪器厂;ST-360酶标仪,上海科华实验系统有限公司;JXH-100恒温混匀仪,上海净信实业发展有限公司;Tanon-1600 数码凝胶图像分析仪器,上海天能科技有限公司;SCIENTZ-10N 冻干机,宁波新芝生物科技有限公司;高pH 分离液相色谱仪,上海Agilent 公司;MCCW V1乳成分分析仪,郑州兆为仪器设备有限公司。
1.2 奶品TMT定量蛋白质组学试验方法
参照邱山桐等[12]营养成分测定、乳清与乳脂的分离、乳清蛋白和MFGM 蛋白的提取、胰蛋白酶酶解与肽段标记、MS分析、数据库检索方法。
1.3 泌乳高峰期娟犏牛奶与牦牛奶乳清和MFGM 蛋白质差异分析
在定量结果的显著性差异分析中,本试验筛选样本组内3 次重复数据进行统计分析,在1.2 差异倍数(fold change,FC)且P<0.05 条件下进行DEPs 筛选(即FC≥1.2 为上调,FC≤0.8 为下调,0.8<FC<1.2 无明显变化)。采用两组样本间的蛋白质表达差异倍数和t-检验(t-test)得到的P两个因素,利用ggplot2 绘图软件共同绘制火山图。
1.4 泌乳高峰期娟犏牛奶与牦牛奶乳清和MFGM 蛋白生物信息学分析
利用数据库检索得到原始数据后,按照Score Sequest HT>0且unique peptide≥1,并去除空白值的标准筛选得到可信蛋白。利用可信蛋白的表达量进行主成分分析(principal component analysis,PCA)。用Cluster 3.0软件对已鉴定的蛋白进行分层聚类。运用生物信息学在线资源[13](http://www.genome.jp)对DEPs进行GO[14]注释,筛选生物过程、分子功能和细胞组成3种分类中对应差异蛋白数目大于1的GO条目。利用在线资源(http://www.genome.jp/kegg/pathway.html)对差异蛋白进行KEGG[15]路径分析,以深入了解蛋白质生物学功能,从而找到富集的代谢通路条目。将乳清和MFGM DEPs提交到STRING(https://cn.string-db.org/)在线数据库进行分析,获得PPI[16]数据。利用ggplot2绘图软件绘制聚类图、GO富集图和KEGG通路图。
2 结果与分析
2.1 泌乳高峰期娟犏牛与牦牛乳汁成分分析
2.1.1 泌乳高峰期娟犏牛奶与牦牛奶的主要乳成分含量 由表1 可知,娟犏牛乳和牦牛乳的乳脂、乳蛋白和乳糖含量均存在显著差异。

表1 娟犏牛奶与牦牛奶的主要乳成分含量Table 1 Comparison of main milk components between jersey yak crossbreeds milk and yak milk/%
2.1.2 娟犏牛奶与牦牛奶乳清和MFGM 蛋白质鉴定结果 泌乳高峰期娟犏牛奶与牦牛奶乳清蛋白中共鉴定出肽段2 991 个,MFGM 蛋白中共鉴定出肽段4 470个。娟犏牛奶与牦牛奶中共鉴定到651个乳清蛋白,获得613个乳清可信蛋白,根据FC≥1.2为上调,FC≤0.8 为下调,从可信蛋白中筛选出145 个乳清DEPs,相比于牦牛奶乳清DEPs,娟犏牛奶乳清DEPs 中71 个上调,74 个下调。泌乳高峰期娟犏牛奶和牦牛奶中共鉴定到990 个MFGM 蛋白,获得956 个MFGM 可信蛋白,根据FC≥1.2 为上调,FC≤0.8 为下调,从可信蛋白中筛选出160 个DEPs,相比于牦牛奶MFGM DEPs,娟犏牛奶MFGM DEPs中78个上调,82个下调。
2.1.3 泌乳高峰期娟犏牛奶与牦牛奶定量乳清和MFGM可信白PCA分析 在泌乳高峰期娟犏牛奶与牦牛奶中共筛选出613个乳清可信蛋白,956个MFGM 可信蛋白。从图1-A 可知,乳清中第1主坐标(PC1)对于区分样品的贡献率为61.11%,第2 主坐标(PC2)对于区分样品的贡献率为14.48%;从图1-B可知,MFGM中第1 主坐标(PC1)对于区分样品的贡献率为59.37%,第2 主坐标(PC2)对于区分样品的贡献率为16.64%。综合上述结果可知,两组奶样同组间的分离度较低,重复性较好;同时两种奶样间分离度较高,说明两种奶样蛋白质间具有一定差异性。
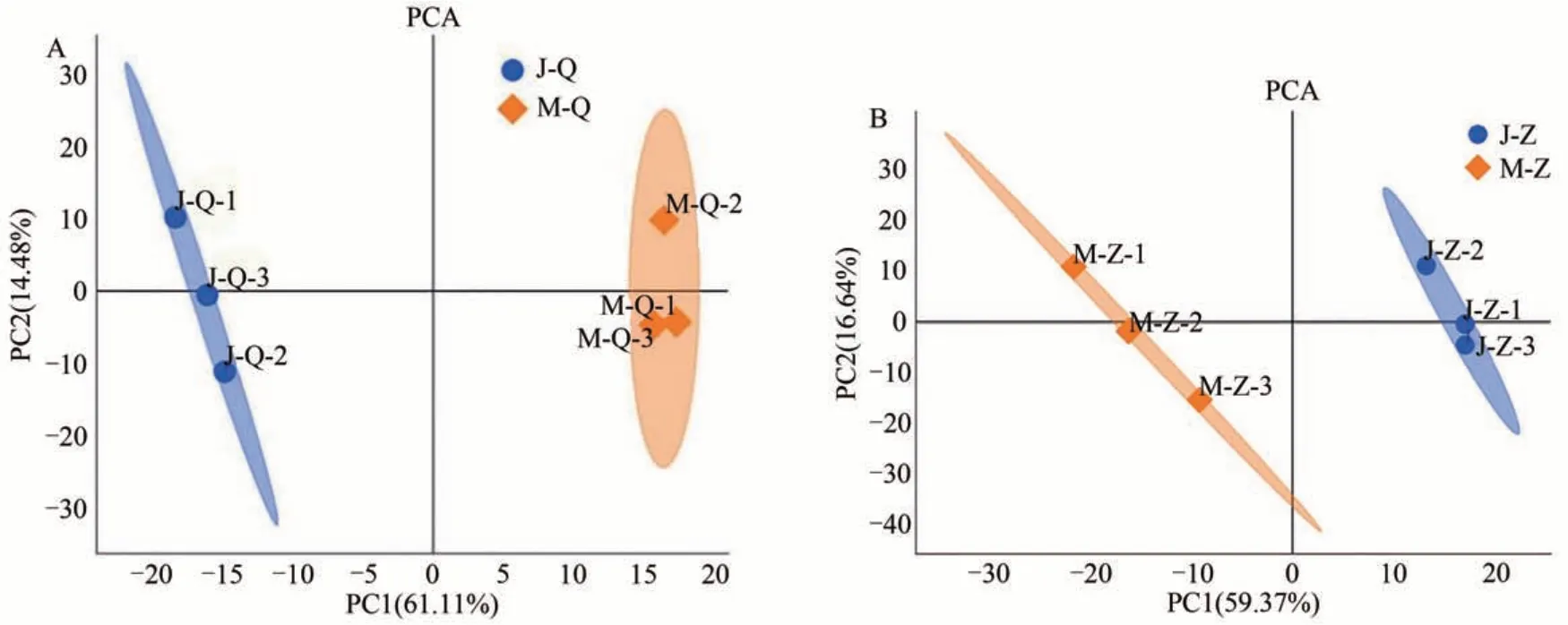
图1 娟犏牛奶与牦牛奶样本可信蛋白PCA分析图Fig.1 PCA analysis diagram of credible protein in jersey yak crossbreeds milk and yak milk samples
2.1.4 泌乳高峰期娟犏牛奶与牦牛奶主要乳清和MFGM DEPs
2.1.4.1 泌乳高峰期娟犏牛奶与牦牛奶主要乳清DEPs 相比于牦牛奶,娟犏牛奶乳清中上调的高丰度DEPs主要包括骨桥蛋白(osteopontin,OPN)、纤溶酶原(plasminogen,PLG)、补体C7(complement component 7,C7)、甘露糖结合蛋白C(mannose-binding protein C,MBP-C)和补体C4A(complement component 4A,C4A)等;乳清中下调的高丰度DEPs 主要包括热休克同源71 kDa 蛋白(heat shock cognate 71 kDa protein,HSP7C)、CD59 糖蛋白(CD59 glycoprotein,CD59)和黄嘌呤脱氢酶(xanthine dehydrogenase,XDH)等,详细信息见表2。
2.1.4.2 泌乳高峰期娟犏牛奶与牦牛奶主要MFGM DEPs 相比于牦牛奶,娟犏牛奶MFGM 中上调的高丰度DEPs 主要包括OPN、C7 和α1-酸性糖蛋白(alpha-1-acid glycoprotein,AGP),MFGM 中下调的高丰度DEPs 主要包括HSP7C、XDH 和E1A 激活基因阻遏子1(cellular repressor of E1A-stimulated genes 1,CREG1),详细信息见表3。

表3 娟犏牛奶与牦牛奶主要MFGM DEPs鉴定信息Table 3 Identification information of main MFGM DEPs in jersey yak crossbreeds milk and yak milk
2.2 泌乳高峰期娟犏牛奶与牦牛奶乳清DEPs 生物信息学分析
2.2.1 泌乳高峰期娟犏牛奶与牦牛奶乳清DEPs GO功能注释 对泌乳高峰期娟犏牛奶与牦牛奶中的145种乳清DEPs进行富集分析,发现只有119种参与GO功能注释,乳清DEPs共富集482个生物过程,上调与下调DEPs参与最多的生物过程是免疫反应;共富集132个细胞成分,上调与下调DEPs参与最多的细胞成分是细胞外区域与细胞外间隙;共富集179 个分子功能,上调与下调DEPs 参与最多的分子功能是蛋白质同二聚体活性。由图2 可知,生物过程功能分类中,泌乳高峰期娟犏牛奶与牦牛奶乳清DEPs在固有免疫应答、补体激活,经典途径和革兰氏阳性菌的防御反应中富集度较高,各有9、4和4个娟犏牛奶乳清差异表达上调蛋白富集,2、1和1个下调DEPs。细胞组分功能分类中,细胞外间隙和细胞外区域DEPs占比最多。分子功能分类中,蛋白质同源二聚体活性和丝氨酸型内肽酶抑制剂活性DEPs富集度较高。本研究分析发现娟犏牛奶中的上调乳清核心DEPs主要集中在细胞外间隙的固有免疫应答。
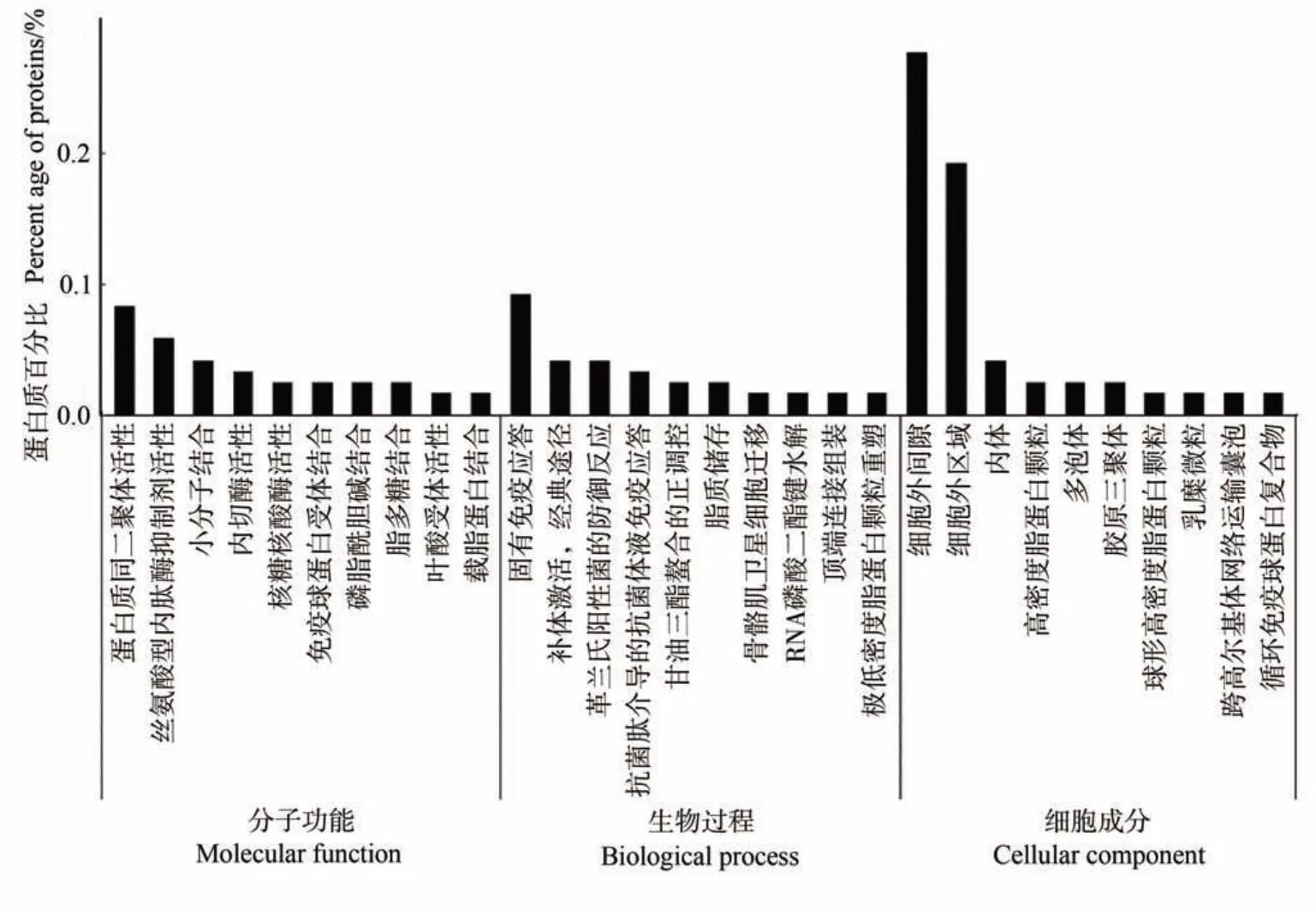
图2 娟犏牛奶与牦牛奶乳清DEPs的GO注释Fig.2 Go annotation of DEPs whey between jersey yak crossbreeds milk and yak milk
GO富集结果说明,泌乳高峰期娟犏牛奶与牦牛奶乳清DEPs具有不同免疫功能的原因,可能是由于娟犏牛奶与牦牛奶在细胞外间隙和细胞外区域等细胞组分的结合能力不同,通过催化蛋白质同源二聚体活性和丝氨酸型内肽酶抑制剂活性等,造成对固有免疫应答、补体激活,经典途径和革兰氏阳性菌的防御反应等途径的不同反应,从而导致免疫功能不同。
2.2.2 泌乳高峰期娟犏牛奶与牦牛奶乳清DEPs KEGG 代谢通路分析 泌乳高峰期娟犏牛奶与牦牛奶乳清DEPs 有71 种参与KEGG 通路富集分析。KEGG富集分析将泌乳高峰期娟犏牛奶与牦牛奶乳清DEPs分为细胞过程、环境信息处理、人类疾病、组织系统和新陈代谢5个部分,共富集到156条通路。细胞过程富集11 条、新陈代谢富集26 条、环境信息处理富集19条、人类疾病富集50 条和组织系统富集50 条,其中DEPs富集的50条组织系统中有17条是免疫系统。娟犏牛奶与牦牛奶乳清DEPs 富集最多的前20 条通路如图3 所示。娟犏牛奶与牦牛奶乳清DEPs 主要富集的途径包括金黄色葡萄球菌感染、PI3K-Akt 信号通路、肺结核和补体与凝血级联,各有12、10、10 和9 个娟犏牛奶乳清DEPs富集。

图3 娟犏牛奶与牦牛奶乳清DEPs的KEGG途径分析(前20条)Fig.3 KEGG pathway analysis of DEPs whey between jersey yak crossbreeds milk and yak milk (top 20)
娟犏牛奶乳清DEPs上调的29种里有16种富集在免疫系统,占55.2%,下调42 种里有7 种参与免疫系统,占16.7%,且免疫系统中上调DEPs 总丰度高于下调的,说明娟犏牛奶乳清比牦牛奶拥有更多参与免疫的DEPs。除S100A8 外,其余上调的17 种娟犏牛奶乳清DEPs 均极显著表达;除GNG12 和PIGR 外,其余下调的7 种均极显著表达(P<0.01)(表4)。17 条免疫系统中蛋白富集最多的通路是补体和凝血级联(图4),此途径中上调的DEPs 有8 种,分别是C4A、MBP-C、C7、补体因子I(complement factor I,CFI)、从生蛋白(clusterin,CLU)、α2-巨球蛋白(alpha-2-macroglobulin,A2M)、纤维蛋白原α链(fibrinogen alpha chain,FGA)和PLG,占富集在免疫系统上调DEPs 的44.4%,下调的DEPs 是CD59,占富集在免疫系统下调DEPs 的11.1%,对娟犏牛奶中的乳清核心DEPs 进行富集分析,发现在补体和凝血级联通路富集的上调乳清核心DEPs最多,主要是FGA、C4A、PLG、A2M和CLU。
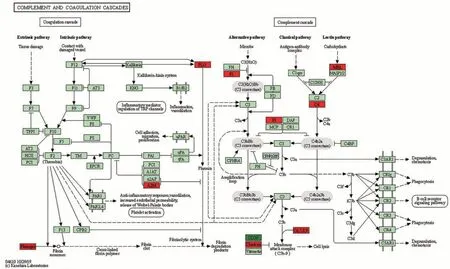
图4 娟犏牛奶与牦牛奶乳清DEPs补体和凝血级联代谢通路图Fig.4 Metabolic pathway diagram of complement and coagulation cascade of jerseyyak crossbreeds milk and yak milk whey DEPs
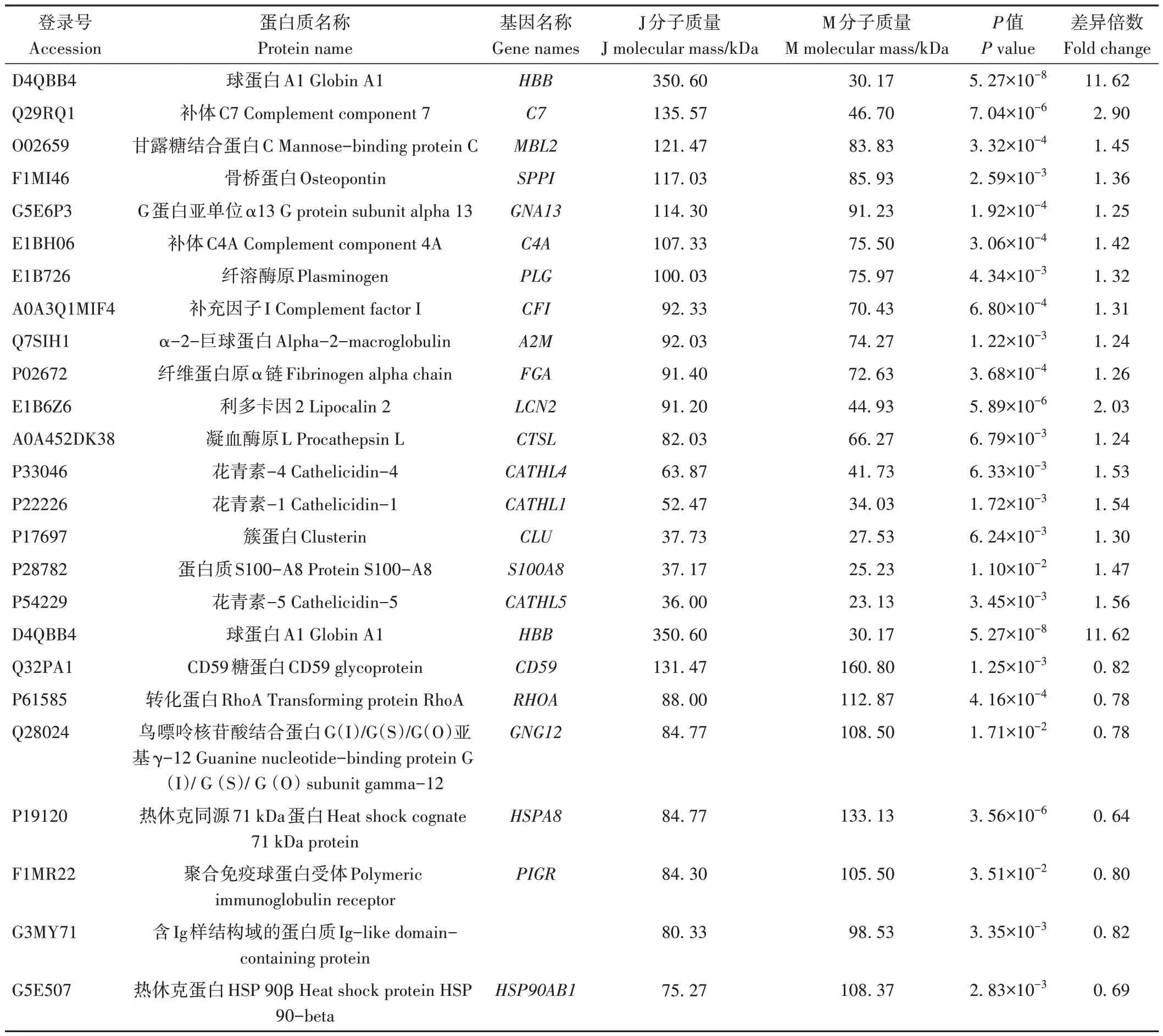
表4 参与免疫系统的娟犏牛奶与牦牛奶乳清DEPs鉴定信息Table 4 Identification information of DEPs whey between jersey yak crossbreeds milk and yak milk involved in immune system
2.2.3 泌乳高峰期娟犏牛奶与牦牛奶乳清DEPs PPI分析 泌乳高峰期娟犏牛奶与牦牛奶乳清DEPs PPI分析得到145 个节点和882 个互作边,连接度排名前25 的乳清DEPs 得到结果如图5 所示。与牦牛奶乳清DEPs相比,娟犏牛奶乳清中连接度靠前且表达上调的CLU、PLG、A2M、FGA、C4A 和免疫球蛋白J 链(immunoglobulin J chain,JCHAIN)等DEPs 与多种蛋白相互关联;连接度靠前且表达下调的HSP7C、转化蛋白RhoA(transforming protein RhoA,RHOA)和CD59 等DEPs 与多种蛋白相互关联,推测这些DEPs 可能是泌乳高峰期娟犏牛奶乳清的核心DEPs。
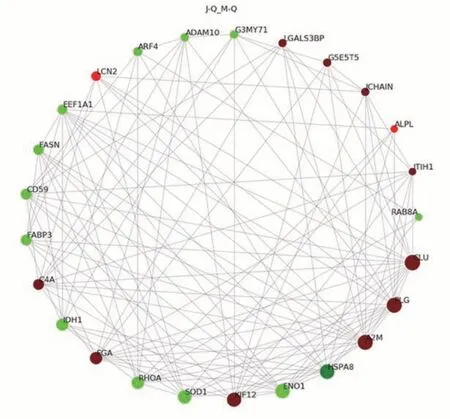
图5 娟犏牛奶与牦牛奶乳清DEPs STRING相互作用网络分析Fig.5 STRING interaction network analysis of DEPs whey between jersey yak crossbreeds milk and yak milk
2.3 泌乳高峰期娟犏牛奶与牦牛奶MFGM DEPs 生物信息学分析
2.3.1 泌乳高峰期娟犏牛奶与牦牛奶MFGM 显著DEPs GO 功能注释 对泌乳高峰期娟犏牛奶与牦牛奶中的160 种MFGM DEPs 进行富集分析,发现只有131种参与GO 功能注释,MFGM DEPs 共富集507个生物过程,上调与下调DEPs 参与最多的生物过程主要是免疫反应;共富集132 个细胞成分,上调与下调DEPs 参与最多的细胞成分是细胞外区域与细胞外间隙;共富集207个分子功能,上调与下调DEPs参与最多的分子功能是鸟苷-5′-三磷酸酶(guanosine 5′-triphosphatase,GTPase)活性与GTP 结合。由图6 可知,生物过程功能分类中,泌乳高峰期娟犏牛奶与牦牛奶MFGM DEPs在固有免疫应答、补体激活,经典途径和革兰氏阳性菌的防御反应中富集度较高,各有8、4和1个娟犏牛奶MFGM 差异表达上调蛋白富集,2、2和1个下调DEPs。细胞组分功能分类中,细胞外间隙和细胞外区域DEPs极显著富集,且占比最高。分子功能分类中,GTPase活性、GTP结合和丝氨酸型内肽酶抑制剂活性DEPs富集度较高。综上,娟犏牛奶中的上调MFGM核心DEPs主要集中在细胞外间隙的固有免疫应答。

图6 娟犏牛奶与牦牛奶的MFGM DEPs的GO注释Fig.6 Go annotation of DEPs MFGM between jersey yak crossbreeds milk and yak milk
2.3.2 泌乳高峰期娟犏牛奶与牦牛奶MFGM DEPs KEGG 代谢通路分析 泌乳高峰期娟犏牛奶与牦牛奶MFGM DEPs 有74 种参与KEGG 通路富集分析。KEGG 途径分析将娟犏牛奶与牦牛奶MFGM DEPs 分为细胞过程、环境信息处理、人类疾病、新陈代谢和组织系统5 个部分,共富集到181 条通路。细胞过程富集16 条、环境信息处理富集21 条、人类疾病富集55 条、新陈代谢富集32 条和组织系统富集57 条,其中富集到组织系统的57 条中有15 条是免疫系统。娟犏牛奶与牦牛奶MFGM DEPs 富集最多的前20 条通路结果如图7 所示。娟犏牛奶与牦牛奶MFGM DEPs 富集的途径主要是金黄色葡萄球菌感染、补体与凝血级联反应、肌动蛋白细胞骨架的调节和肺结核,各有11、10、9和8个DEPs富集。
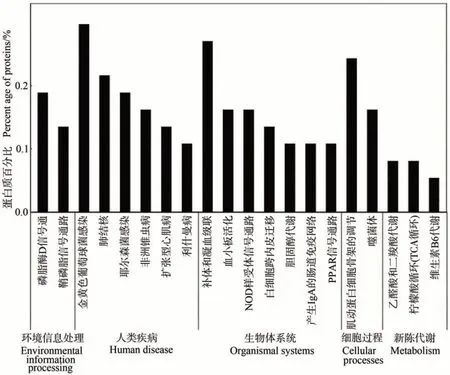
图7 娟犏牛奶与牦牛奶的MFGM DEPs的KEGG途径分析(前20条)Fig.7 KEGG pathway analysis of DEPs MFGM between jersey yak crossbreeds milk and yak milk (top 20)
娟犏牛奶MFGM DEPs 上调的31 种中,有14 种富集在免疫系统,占45.1%;下调的43种中,有11种参与免疫系统,占25.5%,且免疫系统中上调DEPs 总丰度高于下调DEPs(表5),说明娟犏牛奶MFGM 比牦牛奶拥有更多参与免疫的DEPs。16 条免疫系统中蛋白富集最多的通路是补体和凝血级联,此途径中上调的DEPs 有10 种,分别是C4A、MBP-C、C7、CFI、CLU、A2M、FGA、激肽原-1(kininogen-1,KNG1)、补体因子H(complement factor H,CFH)和PLG,占富集在免疫系统上调DEPs 的62.5%,对娟犏牛奶中的MFGM 核心DEPs 进行分析,发现在补体和凝血级联通路富集的上调MFGM 核心DEPs 最多,主要是FGA、C4A、PLG、A2M和CLU。
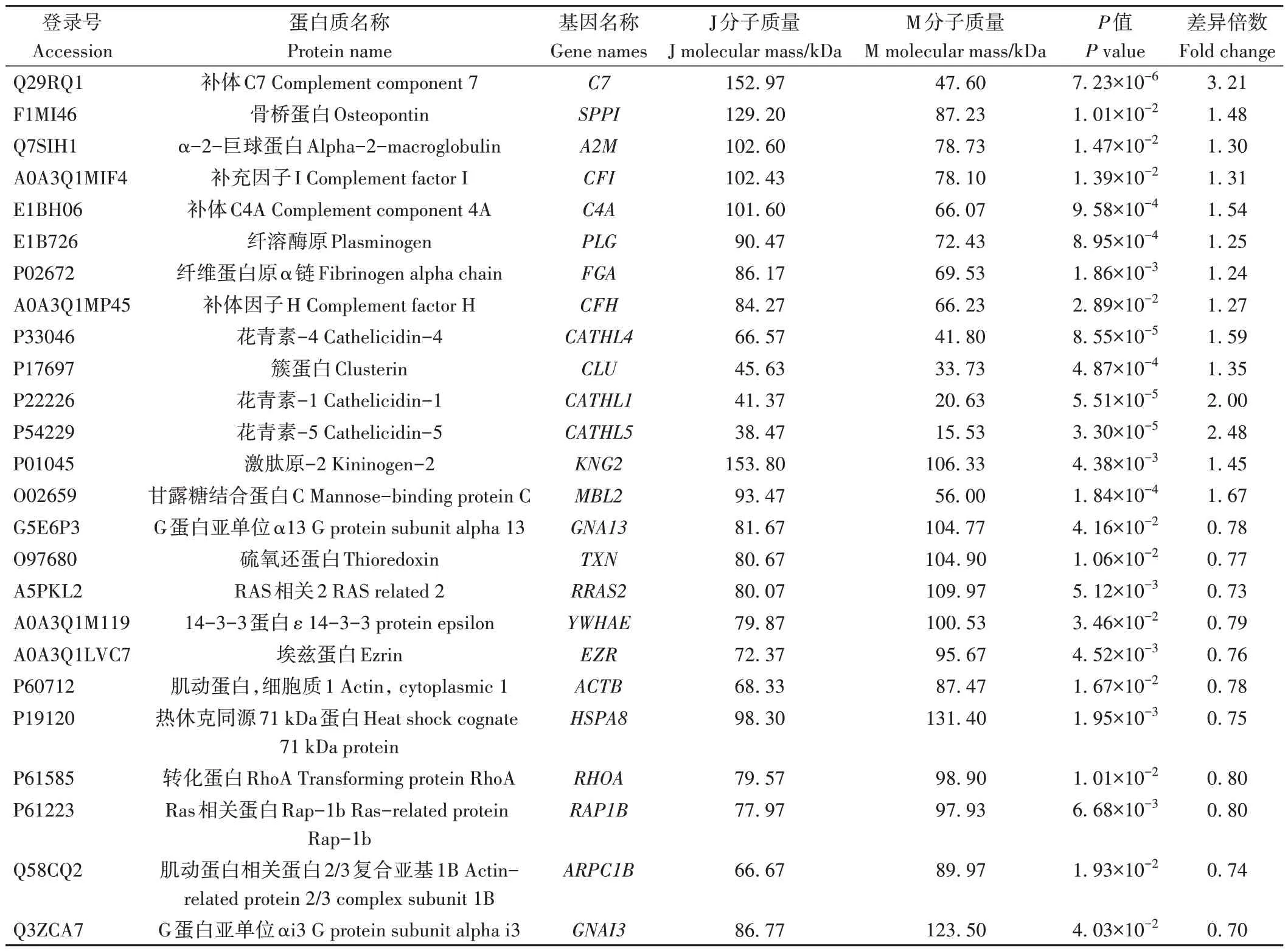
表5 参与免疫系统的娟犏牛奶与牦牛奶的MFGM DEPs鉴定信息Table 5 Identification information of DEPs MFGM between jersey yak crossbreeds milk and yak milk involved in immune system
2.3.3 泌乳高峰期娟犏牛奶与牦牛奶MFGM 显著DEPs PPI 分析 泌乳高峰期娟犏牛奶与牦牛奶MFGM DEPs PPI 分析后得到160 个节点和1 232 个互作边,连接度排名前25的DEPs如图8所示。与牦牛奶MFGM DEPs 相比,娟犏牛奶MFGM 中连接度靠前且表达上调的结合珠蛋白(haptoglobin,HP)、A2M、CLU、PLG和AGP等DEPs与多种蛋白相互关联;连接度靠前且表达下调的HSP7C 和RHOA 等DEPs 与多种蛋白相互关联,推测这些DEPs 可能是泌乳高峰期娟犏牛奶MGFM的核心DEPs。
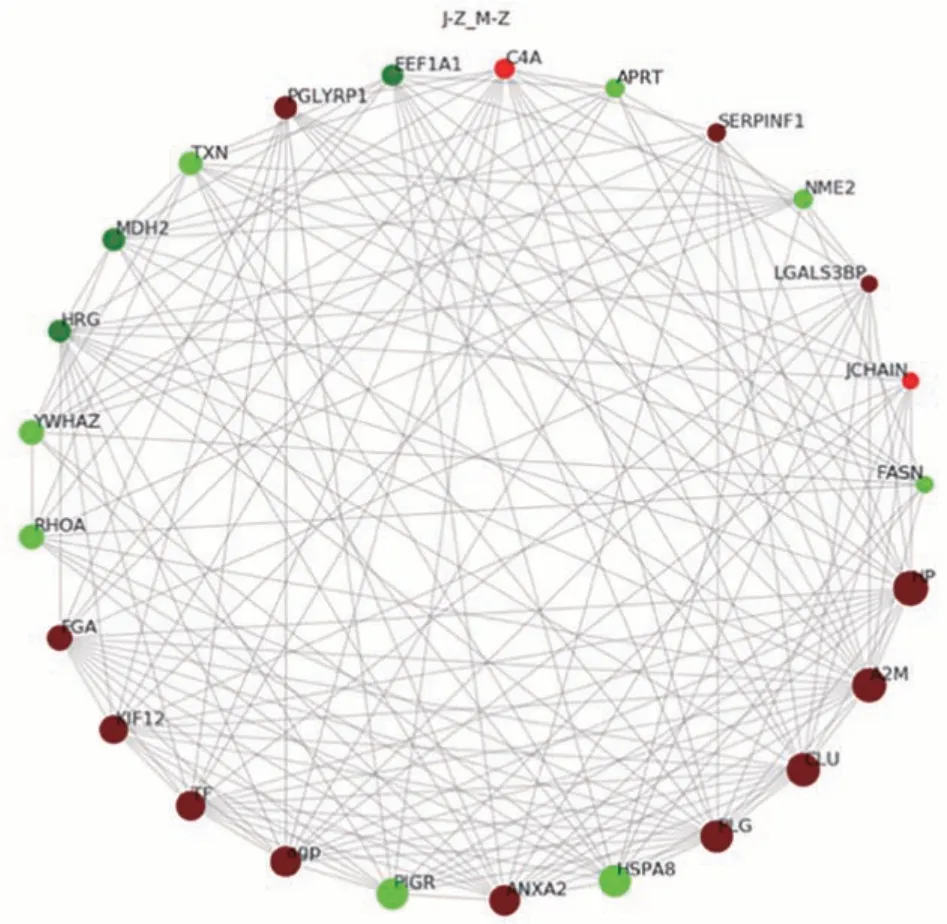
图8 娟犏牛奶与牦牛奶的MFGM DEPs STRING 相互作用网络分析Fig.8 STRING interaction network analysis of DEPs MFGM between jersey yak crossbreeds milk and yak milk
3 讨论
对娟犏牛乳营养成分测定,发现乳成分接近优质牦牛乳品质[4],且娟犏雌牛的挤奶量7.5~10 kg,是当地牦雌牛(平均1.4 kg)的4~5倍[5],娟犏牛的产奶量远高于牦牛。但泌乳高峰期娟犏牛奶与牦牛奶乳成分测定结果表明,娟犏牛奶的乳糖率、乳脂率和乳蛋白率均比牦牛奶低。这与吴富鑫等[17]研究的高产奶牛由于“稀释作用”的影响,乳糖率、乳脂率和乳蛋白率可能更低的结果相一致。
目前,通过蛋白质组学方法对牦牛奶乳清蛋白[18]和MFGM 蛋白[19]已有相关报道,而对娟犏牛奶乳清蛋白和MFGM 蛋白鲜有研究。本研究中,娟犏牛奶与牦牛奶相比,主要乳清与MFGM 高丰度上调DEPs 包括MBP-C、C4A、C7、PLG、OPN 和AGP 等,娟犏牛奶乳清与MFGM 中的上调核心DEPs 包括HP、CLU、PLG、A2M、FGA、AGP 和C4A 等。对这些DEPs 分析发现MBP-C、C4A、C7、A2M 和PLG 都富集在补体与凝血级联通路。C7 是补体与凝血级联反应的终末产物,作为补体系统固有成分之一,是形成攻膜复合物(membrace attack complex,MAC)的主要限速因子[20]。MBP-C、C4A 和C7富集的甘露糖结合凝集素通道最终会聚合生成MAC,MAC 在抗炎中发挥重要作用,具有免疫保护功能,并在感染细胞膜内形成跨膜通道,分别导致肿瘤细胞及细菌溶解[21]。A2M 通过抑制侵入机体病原体释放的多种蛋白酶与毒素,减少其对宿主的破坏,增强宿主的抗病力。纤溶系统在血栓、止血和伤口愈合中扮演重要角色,而PLG 是纤溶酶的酶原形式,能够降解纤维蛋白,在纤溶系统中起关键作用[22]。OPN参与人体多种生理和病理过程,如骨重塑、伤口愈合和免疫调节等[23],也可能通过改变免疫反应来促进病原防御,可以抵御细菌和病毒感染[24]。CLU 参与免疫调节、细胞黏附、细胞分化及转化调控等多项重要的机体活动。AGP 是免疫调节蛋白,通过调节细胞因子参与免疫调节功能[25]。本研究对主要DEPs 的分析发现,娟犏牛奶中丰度较高的主要乳清和MFGM DEPs在免疫保护和免疫调节等方面表现优异,且娟犏牛奶乳清和MFGM 中上调的免疫相关蛋白数量和总丰度都高于牦牛奶,说明娟犏牛奶较牦牛奶在免疫保护和免疫调节等生物过程中发挥更重要的作用。
娟犏牛奶与牦牛奶相比,主要乳清和MFGM 高丰度下调DEPs 包括HSP7C、CD59、XDH 和CREG1 等。娟犏牛奶乳清与MFGM 中的下调核心DEPs 包括HSP7C、PIGR、RHOA和CD59等。对这些DEPs分析发现热休克蛋白家族是一组对于维持细胞功能至关重要的分子伴侣,HSP7C是热休克蛋白家族的组成成员,也是高度保守的伴侣蛋白[26],还具有促凋亡和抗凋亡的特性,对细胞活力起保护作用[27]。CD59 分子可参与免疫反应的调节过程,诱导T淋巴细胞的激活,并且促进T 淋巴细胞增殖[28]。XDH 能够抑制金黄色葡萄球菌、大肠杆菌和沙门氏菌的生长[29],在胃肠道内发挥抗菌作用,具有免疫保护功能[30]。CREG1是维持组织细胞成熟稳态的重要分子,具有对抗细胞缺血缺氧损伤、抗凋亡和抗增殖等多种作用[31],CREG1 也可能在发挥对抗细胞/组织损伤,保证细胞稳定性方面具有十分重要的临床药用价值。本研究对主要DEPs 的分析发现娟犏牛奶下调的主要乳清和MFGM 高丰度DEPs在保证细胞稳定性、促进T 淋巴细胞增殖和抗菌等方面发挥作用,说明牦牛奶中丰度较高的主要乳清和MFGM 差异蛋白在保证细胞稳定性、促进T 淋巴细胞增殖和抗菌等方面表现优异。
4 结论
本试验利用TMT 定量蛋白组学技术成功获得了娟犏牛与牦牛的乳清蛋白、MFGM 蛋白的差异表达谱。研究发现,娟犏牛乳较牦牛乳在免疫保护和免疫调节等生物过程中发挥更重要作用,推测娟犏牛奶更有助于新生儿建立抗微生物感染的免疫系统。
