发展学生证据推理与模型认知素养的教学实践
2023-05-30单奔翔徐欣娴王福中王方阔
单奔翔 徐欣娴 王福中 王方阔

摘 要 培养学生的化学学科核心素养成为新课改背景下学科教学的研究热点。以“铁及其化合物”教学为例,通过魔术导入,激发学生学习兴趣和思考,引导学生自主选择化学试剂等,设计实验方案,探究Fe2+与Fe3+之间转化的方法,并建构“铁三角”模型。在探究过程中引导学生从价态变化的角度,学习铁及其重要化合物互相转化的原理和条件。通过以小组为单位进行探究培养学生合作意识与沟通能力,建立变价金属化合价转化的模型,感受化学的学科价值,发展“证据推理与模型认知”素养。
关键词 高中化学 证据推理与模型认知 铁及其化合物 教学实践
在生活中,学生能够切身感受到铁及其化合物在生产、生活中的广泛应用,但不能利用所学的相关化学知识解决实际问题,即不能将所学知识迁移到生活中。利用铁及其化合物的转化原理作为魔术素材,让学生在探究活动中更新知识结构,感受化学变化的魅力,发展化学学科核心素养。《普通高中化学课程标准(2017年版2020年修订)》[1]在必修模块有关“元素化合物知识”内容中,铁元素占据了“金属及其化合物”的半壁江山,同时铁是学生在高中阶段学习的第一个变价金属,掌握其学习的一般思路有利于后面其他变价元素(如硫、氮)的学习,因此帮助学生建立铁元素的综合知识网络至关重要。
在教学过程中,“铁及其化合物”的教学重点和难点是掌握铁离子与亚铁离子相互转化途径,并构建“铁三角”认知模型。本节课的教学思路是:首先利用魔术“茶水的一生”引入教学,激发学生的求知欲,并提供资料卡片为铁离子与亚铁离子的互相轉化提供理论基础。其次,为学生创造半开放的实验环境,学生自主选择实验试剂或药品,设计能够实现Fe2+与Fe3+互相转化的实验方案,进行实验探究,结合实验现象进行推理,建构“铁三角”模型。通过实验现象直观感受Fe2+与Fe3+之间的转化路径,深刻理解物质价态变化的原理和发生条件,培养学生“证据推理与模型认知”的化学学科核心素养。最后利用“铁三角”模型解释生活中的现象,感受化学知识的价值。
一、教学设计
(一)教材分析
本节教学内容是在“物质分类”“离子反应”“氧化还原反应”基础上的学习内容,是新课标要求学习的金属元素之一。利用学生已有的知识,分析铁盐与亚铁盐相互转化关系,并结合元素价态和物质类别,建立铁及其化合物的相互转化关系模型,加深学生对铁及其化合物的认识。
(二)学情分析
学生在初中阶段已经初步学习了铁的基本性质,如铁的颜色、状态、水溶性等,能够与氧气、酸和金属盐溶液等发生化学反应;高中阶段已经学习了离子反应、氧化还原反应等原理知识。因此学生对本节课的学习有一定的知识基础。但是在思维的严密性、科学性以及逻辑推理等方面仍需进一步发展。本节课以魔术揭秘为线索,引导学生从元素价态的角度认识物质的化学性质,并建立铁及其重要化合物相互转化的认知模型,初步形成变价金属学习的一般思路。
(三)教学目标
1.能够从元素价态和物质类别的角度设计铁离子与亚铁离子相互转化的实验方案,并能够根据实验现象推导出实验结论,培养证据推理能力。
2.能够对实验结论进行分析、归纳,建构“铁三角”模型,利用“铁三角”模型解决实际问题,感受化学的应用价值,培养归纳与演绎思维,发展模型认知素养。
3.通过对铁及其化合物性质的探究过程,初步形成研究金属元素及其化合物的一般思路和方法。
(四)评价目标
1.根据学生设计的实验方案的严密性和科学性,诊断学生从微观角度看待化学反应本质的能力;根据学生基于实验现象的推理过程,诊断并发展学生证据推理能力。
2.根据学生对实验结论的归纳与演绎程度,诊断并发展学生的批判性思维、归纳与演绎思维等高阶思维;观察学生建构的“铁三角”模型的完善程度,诊断并发展学生“证据推理与模型认知”素养。
3.根据学生对“铁三角”模型的掌握程度与应用能力,诊断并发展学生对化学知识价值的认知程度,培养学生化学源于生活、化学服务生活的意识。
二、教学过程
(一)教学活动设计
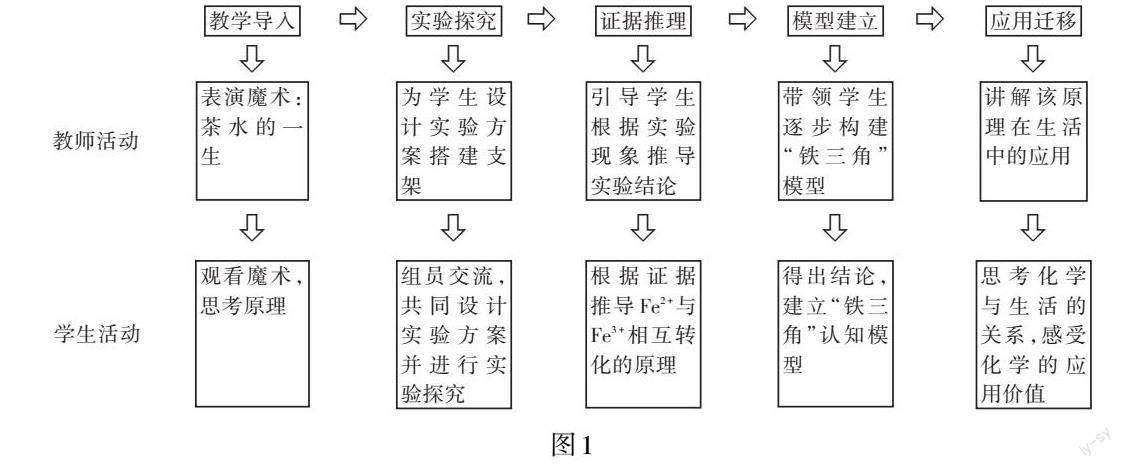
(二)教学流程
环节一:教学导入
【教师】表演魔术“茶水的一生”,用茶包在烧杯中泡20 ml茶水,这是“少年期的茶”,如图2中试管a所示;将茶水倒入试管b后,茶水变黑,这是“叛逆期的茶”;最后将茶水倒入试管c,茶水又变回原来的颜色,这是叛逆期以后重新“懂事的茶”。
【学生】观察实验现象,思考并讨论产生该现象的原因。
【教师】魔术虽假,知识是真,大家想知道魔术的原理吗?请同学们阅读资料卡片。
【资料卡片】试管b中有少量FeSO4溶液,试管c中有维生素C。茶水中含有鞣酸,鞣酸能够与二价铁离子反应生成鞣酸亚铁,鞣酸亚铁的性质不稳定,很快被氧化成鞣酸铁络合物而呈蓝黑色,因此茶水在试管b中显黑色;维生素C又称抗坏血酸,具有还原性,能够将三价铁离子变回二价铁离子,因此茶水在试管c中又重显原来的颜色。
【教师】还有哪些二价铁离子与三价铁离子之间转换的方法呢?
【教师小结】生活中不缺少化学,但是缺少发现化学的“眼睛”。许多看起来不可思议的现象,却可以用化学知识“一招击破”。
设计意图:通过表演魔术激发学生的求知欲。知识学习对学生来说非常枯燥且繁琐,利用他们已有的知识、概念原理作为魔术素材激发学生的学习欲望。魔术解开的过程也是证据推理的过程,资料卡片能够帮助学生初步思考,回忆氧化还原反应相关知识,为下面学习铁盐与亚铁盐的相互转化奠定基础。
环节二:实验探究
【教师】在只有FeSO4溶液的情况下,如何设计实验方案来证明二价铁离子、三价铁离子与铁单质之间的相互转化?
【学生】从Fe2+转变到Fe3+价态升高,发生氧化反应,需要氧化剂;同理推导Fe2+转化为Fe单质所需的反应条件。
【教师】提供酸性高锰酸钾、过氧化氢、锌粉、铁粉、铜片、淀粉-KI试纸、氯水等试剂,请各小组在上述材料中选择合适的试剂设计实验方案。
【学生】根据教师提供的参考试剂设计实验方案,以小组为单位进行实验探究,观察实验现象,并记录在实验手册。
【甲组同学】向FeSO4溶液中加入还原剂如锌片,若溶液由浅绿色变为无色,且锌片表面覆着一层黑色固体,则证明Fe2+转化为Fe。
【乙组同学】向FeSO4溶液中先加入KSCN溶液,溶液无变化;再加入双氧水,溶液变为红色,则证明Fe2+转变成了Fe3+;这时再向溶液中加入铁粉,若溶液由血红色变为浅绿色,则证明Fe3+转变成了Fe2+。
【丙组同学】向FeSO4溶液中加入氯水,观察溶液颜色是否变化,若由浅绿色变为黄色,则证明Fe2+转化为Fe3+;将得到的Fe2(SO4)3溶液滴在淀粉-KI试纸上,若淀粉-KI试纸变蓝,证明Fe3+转化为Fe2+。
【教师小结】可以选择不同的氧化剂或还原剂,实现Fe单质、Fe2+与Fe3+之间的相互转化,关键是要抓住价态变化的原理,再选择合适的氧化剂或还原剂进行反应,就可以得到想要的物质了。
设计意图:提供多种供学生选择的试剂,为学生留下充足的发展空间。学生在选择氧化剂或还原剂时能够进行有效思考,深度辨别氧化剂与还原剂的概念及其作用。以小组为单位设计实验方案,完成探究过程,每個学生都能够参与其中。既能够让学生整合知识点,初步建立氧化还原反应与不同态铁元素间转化的关联,又能够培养学生合作与沟通的能力。
环节三:证据推理
【教师】同学们,根据实验现象,能得出哪些结论呢?
【学生】绿色的FeSO4溶液非常容易被氧化为黄色的Fe2(SO4)3溶液,说明Fe2+非常不稳定,容易被氧化为Fe3+,因此要在FeSO4溶液中加入少量Fe粉,防止FeSO4被氧化。
【教师】非常细致,那你们的实验方案进行的如何?
【甲组学生】我们组选择在FeSO4溶液中加入Zn片来验证Fe2+的氧化性。加入Zn片后,发现试管中溶液颜色逐渐由浅绿色变为无色,Zn片表面覆着一层黑色物质,说明铁单质被置换出来了。这个现象可以用金属的活泼性顺序来解释,Zn比Fe活泼,所以置换出了Fe单质;另外,铁能够从+2价转变为0价,体现了Fe2+的氧化性。
【教师】这组同学非常机智,能将初中阶段学的金属活泼性顺序与高中的氧化还原反应结合起来解决新问题,实现从亚铁离子到铁单质的转化。
【乙组同学】首先,在FeSO4溶液中加入KSCN溶液,溶液并没有显血红色,说明此时Fe2+还没有氧化;接着,选择双氧水作为氧化剂氧化Fe2+,这时溶液变为血红色,说明Fe2+已被氧化为Fe3+;最后,再选择铁粉作为还原剂,溶液由血红色变为最开始的浅绿色,说明此时Fe3+已被还原为Fe2+。
【教师】这组同学已经掌握了价态变化的规律,并且将宏观现象与微观本质相结合,通过观察溶液颜色变化来判断微观反应的进行,该组学生有很强的推理能力。
【丙组同学】选择酸性高锰酸钾作为氧化剂,将酸性高锰酸钾滴入FeSO4溶液直到紫色不再褪去,此时Fe2+全部被氧化为Fe3+;选择淀粉-KI试纸作为还原剂,将得到的Fe2(SO4)3溶液滴在淀粉-KI试纸上,发现淀粉-KI试纸变蓝,证明此时碘离子被氧化为碘单质,淀粉遇碘变蓝,说明Fe3+被还原为Fe2+。
【教师】这组同学思维非常活跃,能够想到用淀粉-KI试纸作为还原剂,巧妙地利用宏观现象判断微观反应,而且能够想到将溶液滴在淀粉-KI试纸上实现转化,在节约实验用品的同时,还能放大实验现象,体现了绿色化学思想。
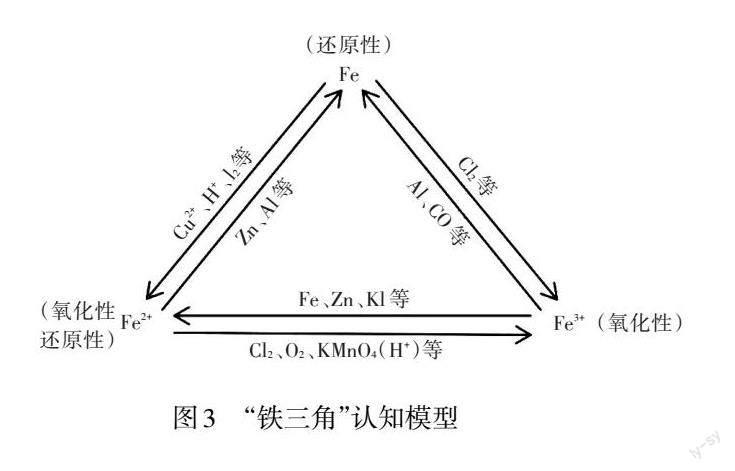
【教师小结】单质铁只具有还原性,铁离子只具有氧化性,而亚铁离子处于中间价态,既具有氧化性,又具有还原性。利用不同的氧化剂或还原剂,能实现三者的相互转化。
设计意图:学生设计好实验方案并进行实验探究后,通过观察实验现象获得证据,并进行推理。准确理解待证实原理是实践的起点[2],引导学生根据实验现象推理反应过程,实现宏微结合视角看问题,培养学生的证据推理能力。
环节四:模型建立
【教师】请同学们对实验结果进行交流讨论,并结合之前所学进行总结。
【学生A】二价铁离子既有氧化性,又有还原性。
【学生B】亚铁离子常温下加入强氧化剂能够被氧化成三价铁,显示其还原性;加入锌等金属能够被还原成铁单质,显示其弱氧化性;所以亚铁离子兼有还原性和弱氧化性。
【教师小结】铁在自然界中主要以化合物的形式存在,如赤铁矿、磁铁矿,通过加入相应的氧化剂或还原剂,能够实现Fe单质、Fe2+与Fe3+之间互相转化。其中二价铁离子的还原性较强,氧化性较弱,主要表现为还原性;三价铁加入还原剂,如铁粉、锌粉,能够被还原为二价铁。
学生在教师的带领下对实验结论进行演绎,画出铁单质、二价铁与三价铁之间转化关系,即“铁三角”认知模型,如图3所示。
设计意图:引导学生在观察实验现象过程中获得证据,并进行推理,得出实验结论。再将实验结论进行归纳和演绎,最终形成有关铁及其重要化合物价态转化的综合知识网络,即“铁三角”认知模型,在这个过程中培养学生“证据推理与模型认知”素养。在推理的过程中,归纳不同价态铁之间的转化条件,建立不同价态铁之间转化的认知模型。
环节五:应用迁移
【教师】展示材料,在人体内,铁的吸收主要是在十二指肠及空肠,一般是以二价铁离子的形式被吸收,三价铁离子很难被吸收[3]。提问:贫血在生活中是很常见的,医生给贫血病人开硫酸亚铁片时,同时会开一瓶维生素C,并且告知患者,这两种药要一起服用,但不能和浓茶一起服用。大家知道这是为什么吗?
【学生】通过上面的探究,我们知道了二价铁很容易被氧化,和维生素C一起吃,可能将被氧化的三价铁还原为二价铁,浓茶可能会将二价铁氧化为三价铁。
【教师】再次进行演示实验并配合讲解,其实这就是开始给大家表演的魔术,其原理如图4所示。
【教师】大家可以想想生活中还有哪些常见的补铁食品。根据今天所学,能不能用简单的方法检验食物中是否含有铁元素?如果有,那含有的是什么价态的铁元素呢?如何验证猜想?大家回去想一想。化学来源于生活,最终也要服务于生活,从而改善我们的生活。虽然书上学到的知识“零碎、繁琐”,许多同学觉得枯燥无味,但是它们都是真实存在于生活中,可以提高我们的生活质量,帮助我们过更健康的生活。
设计意图:将之前所学的知识进行迁移应用,引导学生运用化学知识解释生活现象,让学生认识到化学是揭示元素到生命奥秘的核心力量,激发学生对化学的持久热情。
三、教学反思
本教学案例以促进学生发展为中心,指向“证据推理与模型认知”素养的培养。在开展化学探究性实验的教学过程中,从学生感兴趣的活动入手,将需要学习的知识转化为学生感兴趣的魔术,激发学生的探究热情;在具有挑战性的任务前,教师为学生搭建支架辅助知识学习,支架搭建好后给学生充足的发挥空间,调动学生对实验设计的积极性;在探究过程中,在保证安全的前提下适当“放权”,让学生有足够的选择余地与发展空间;探究结束后,引导学生对实验现象进行分析,对实验结果进行总结,教师在此过程中要进行适度引导,鼓励学生进行大胆地推理和分析,并将实验结论可视化,形成综合知识网络——“铁三角”认知模型。利用“铁三角”认知模型解释生活中的问题:为什么贫血病人吃药时需要和维生素C一起服用?在解释过程中配合演示实验,即重现开始时的魔术,为学生解惑的同时,加深对“铁三角”认知模型的理解,做到首尾呼应,引导学生思考化学与生活的关系,感受化学知识的价值。
通过逐步深入的实验探究,学生不仅提高了动手操作能力,还进行了深度思考。通过给他们足够的权利,让他们将理想实验方案现实化,直观地感受氧化剂和还原剂的作用,从而加深对常见氧化剂、还原剂的认识。
除了实验探究过程,对实验现象的记录和分析也是本节课的重点。引导学生基于证据进行分析推理,利用宏观现象推理微观本质,在不同的宏观现象中找到共同的微观本质,归纳实验结论;接着引导学生利用實验结论逐步建立模型,形成便于学生记忆的知识网络,即“铁三角”模型。学生参与了知识的获得和应用过程,模型建构又是促进思维提升的重要手段[4],因此既能够促进学生进行深度记忆,又有利于学生对核心知识的掌握,最终指向学生的“证据推理与模型认知”学科核心素养的培养。
最后引导学生了解这次探究的社会价值,培养学生“健康化学”“化学来源于生活,最终服务于生活”的意识,感受化学知识的价值,体会化学与生活的关系。
综上所述,立足于学科核心素养、重视探究性实验教学并紧密结合时代特点和实际生活的教学设计,是能够有效培养学生化学学科核心素养的教学方式,能够更加充分地实现高中化学教学的育人价值。
[参 考 文 献]
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020.
[2]杨菲菲,邹标.聚焦模型建构的高三化学复习课例研析:以“化学工艺流程”为例[J].中小学教学研究,2022,23(06):12-19.
[3]林文弢,杨玲.铁营养与运动能力[J].中国体育教练员,2021,29(01):16-18.
[4]陈嫦.基于证据推理素养培养的高中化学课堂研究[J].中小学教学研究,2022,23(03):83-88.
(责任编辑:姜显光)
