雷帕霉素对脱氢表雄酮诱导PCOS大鼠卵巢组织的影响及作用机制探讨
2023-05-30陈文莉王慧玲杨君
陈文莉?王慧玲?杨君


【摘要】目的 探討雷帕霉素对脱氢表雄酮(DHEA)诱导的多囊卵巢综合征(PCOS)大鼠卵巢组织的影响及作用机制。方法 55只SD雌性大鼠适应性喂养1周后随机分为空白组(13只)、对照组(13只)及PCOS组(29只),其中PCOS组大鼠皮下注射DHEA诱导建立PCOS大鼠模型,对照组大鼠给予皮下注射大豆油,空白组全程不做任何处理。造模成功后分为空白组、对照组(腹腔注射等体积生理盐水),将PCOS大鼠分为模型对照组(腹腔注射等体积生理盐水)、低剂量组(腹腔注射雷帕霉素1 mg/kg)及高剂量组(腹腔注射雷帕霉素10 mg/kg),每组各8只大鼠,共干预28 d,给药结束后检测各组大鼠血糖、性激素水平,并进行HE、Masson、免疫组织化学染色,检测并比较组间mTOR、p-mTOR及p-P70S6蛋白表达,TUNEL法检测卵巢组织凋亡情况。结果 PCOS大鼠动情周期出现紊乱,卵巢组织中卵泡呈现多囊样变化,PCOS大鼠体重、卵巢质量、体积、相对质量、性激素水平、纤维化阳性范围均高于对照组(P均< 0.05),而低剂量组和高剂量组大鼠的上述指标均低于模型对照组(P均< 0.05),且卵巢组织多囊样变化明显减轻。低剂量组与高剂量组的纤维化阳性范围较空白组及对照组增加、高剂量组较模型对照组增加(P均< 0.05)。模型对照组大鼠卵巢中p-mTOR蛋白的光密度(OD)值高于其他4组(P均< 0.05)、卵巢中p-P70S6蛋白的OD值与对照组相近(P > 0.05),而高剂量组低于空白组、对照组及低剂量组(P均< 0.05)。卵巢组织TUNEL染色结果分析,模型对照组高于空白组、对照组和高剂量组(P均< 0.005),空白组低于低剂量组(P < 0.005)。结论 雷帕霉素使DHEA诱导的PCOS大鼠模型体重、卵巢质量减轻,卵巢体积减少,性激素水平降低,卵泡组织中多囊样改变减轻及卵巢组织细胞凋亡减少,这可能与雷帕霉素抑制mTOR信号通路的异常激活有关;但其也可能导致PCOS大鼠卵巢间质纤维化增加,大鼠体重、卵巢质量与体积低于正常水平。
【关键词】多囊卵巢综合征;大鼠卵巢;脱氢表雄酮;雷帕霉素;丝氨酸/苏氨酸激酶
The effect and mechanism of rapamycin on the ovarian tissue of rats with PCOS induced by dehydroepiandrosteroneChen Wenli△, Wang Huiling, Yang Jun. △Obstetrics and Gynecology, the First Affiliated Hospital of Xinxiang Medical College, Weihui 453100, China
Corresponding author,Yang Jun,E-mail: 13937335562@163.com
【Abstract】Objective To evaluate the effect and unravel the mechanism of rapamycin on the ovarian tissues in rat models with polycystic ovary syndrome (PCOS) induced by dehydroepiandrosterone (DHEA). Methods After 1-week accustomed feeding, 55 rats were randomly divided into the blank (n=13), control (n=13) and model groups (n=29). PCOS rat models were established by subcutaneous injection of DHEA solution. In the control group, rats were subcutaneously injected with soybean oil, while those in the blank group were not treated throughout the whole experiment. After the model was successfully established, all rats were divided into the blank group, control group (intraperitoneal injection of an equivalent volume of normal saline), the model group, low-dose group (intraperitoneal injection of 1 mg/kg rapamycin) and high-dose group (intraperitoneal injection of 10 mg/kg rapamycin) for 28 d,
8 rats in each group. Blood glucose and hormone levels were detected, and HE, Masson and immunohistochemical staining was performed after corresponding interventions. The changes of the expression levels of mTOR, p-mTOR and p-P70S6 were assessed among different groups. TUNEL assay was used to detect the apoptosis of ovarian tissues among different groups. Results PCOS rats showed irregular estrous cycle, and the follicles were manifested with polycystic changes. The body weight, ovarian weight, volume, relative weight, sex hormone levels and positive area of ovarian fibrosis of PCOS rats were all higher than those in the control group (all P < 0.05), whereas these parameters in the low- and high-dose groups were lower than those in the model control group (all P < 0.05), and the polycystic changes of ovarian tissues were significantly mitigated. The positive area of ovarian fibrosis in the low- and high-dose groups was increased than those in the blank and control groups (all P < 0.05). The positive area of ovarian fibrosis in the high-dose group was increased than that in the control group (P < 0.05). No significant difference was noted in the OD value of mTOR protein among five groups (all P > 0.05). The OD value of mTOR protein in the model control group was higher compared with those in the remaining four groups (all P < 0.05). The OD value of mp-P70S6 protein in the model control group was similar to that in the control group (P > 0.05), whereas the OD value of mp-P70S6 protein in the high-dose group was lower compared with those in the blank, control and low-dose groups (all P < 0.05). TUNEL staining revealed that the apoptosis rate of ovarian tissues in the model control group was higher than those in the blank, control and high-dose groups (all P < 0.005), whereas the apoptosis rate in the blank group was lower than that in the low-dose group (P < 0.005). Conclusions Rapamycin can reduce body weight, decrease ovarian mass and volume, lower hormone levels, mitigate polycystic changes in follicular tissues and alleviate apoptosis of ovarian tissues in DHEA-induced PCOS rat models, which may be related to the inhibition of abnormal activation of mTOR signaling pathway by rapamycin. However, rapamycin may aggravate ovarian interstitial fibrosis in PCOS rats. The body weight, ovarian mass and volume of PCOS rats are lower than the normal levels.
【Key words】PCOS; Ovary of rat; DHEA; Rapamycin; mTOR; Serine/threonine kinase
多囊卵巢综合征(PCOS)是妇科最常见的生殖内分泌代谢性疾病之一,临床表现各不相同,其主要特征为高雄激素血症、肥胖、月经稀发、月经紊乱、不孕或彩色多普勒超声(彩超)下呈多囊卵巢等[1]。PCOS可增加糖尿病、心血管疾病及子宫内膜癌等疾病的风险[2]。目前PCOS的病因及发病机制尚未阐明,近年有研究表明PCOS的发生可能与mTOR信号通路有关[3]。哺乳动物雷帕霉素靶标(mTOR)是一种丝氨酸/苏氨酸激酶,参与控制不同的应激源、激素、营养物质和生长因子,并在细胞增殖、代谢、生长和分化过程中发挥重要作用。Roa等(2009年)研究表明,mTOR信号在控制雌性大鼠青春期开始、减少黄体生成素分泌和促性腺激素分泌等方面起着重要作用。近年来,有报道雷帕霉素可能通过抑制mTOR信号通路异常激活,抑制始基卵泡的激活,从而保护卵泡储备功能[4]。但目前有关雷帕霉素对PCOS大鼠模型的影响鲜有报道,故本研究构建PCOS大鼠模型,并给予不同剂量雷帕霉素处理,探讨雷帕霉素对PCOS大鼠模型卵巢组织的影响及作用机制。
材料与方法
一、实验对象
清洁级SD雌性大鼠,6周龄,体重(180±10)g,购自山西医科大学实验动物中心。根据预实验模型构建及实验所需标本量的情况,确定样本量为55。大鼠分笼饲养,自由饮水、自由进食,饲养温度为20~24 ℃,饲养环境湿度为40%~60%,每日光照及黑暗时间各12 h。本研究经新乡医学院第一附属医院伦理委员会批准(批件号:2021009),并根据国家卫生研究院实验动物使用指南进行相关操作。
二、试剂与仪器
脱氢表雄酮(DHEA)和雷帕霉素购自上海麦克林生化科技股份有限公司,医用大豆油购自浙江田雨山药用油有限公司,生理盐水购自石家庄四药有限公司,血糖仪购自三诺生物传感股份有限公司,血清睾酮、雌二醇、孕激素ELISA试剂盒购自上海酶联生物科技有限公司,革兰染色试剂(快速法)购自珠海贝索生物技术有限公司,HE和Masson染色剂试剂盒购自北京索莱宝科技有限公司,一抗mTOR抗体、二抗辣根过氧化物酶(HRP)标记的山羊抗兔购自武汉赛维尔生物科技有限公司,p-mTOR抗体购自英国Abcam公司,p-P70S6抗体购自美国Santa Cruz公司。
三、实验方法
1.分组、构建PCOS大鼠模型及给药
55只大鼠适应性喂养1周后称重,采用随机区组法分组,即首先将大鼠根据体重分为3个区间,然后每个区间随机分为空白组(13只)、对照组(13只)及模型组(29只)。空白组不做处理,每天上午8∶00~10∶00对照组给予皮下注射0.2 mL大豆油溶剂,模型组同一时间予颈背部按60 mg/kg
的剂量皮下注射DHEA 0.2 mL,连续注射28 d,
构建PCOS大鼠模型[5]。造模期间每日取大鼠阴道分泌物进行阴道涂片,观察大鼠动情周期的变化。造模结束后,分别从空白组、对照组及模型组中随机抽取5只大鼠,测定体重,检测血清性激素水平,并于麻醉下取双侧卵巢组织观察卵巢形态的变化,评价造模效果。造模成功定义为体重增加,动情周期紊乱(大鼠动情周期4个阶段未按照顺序进行,或处于非动情期),血清睾酮水平升高,卵巢质量及体积增加,卵巢組织中几乎无正常卵泡,并且卵泡呈现多囊样改变。造模成功后将模型组剩余24只大鼠分为模型对照组、低剂量组、高剂量组各8只。低剂量组每日给予腹腔注射生理盐水和雷帕霉素1 mg/kg,高剂量组每日给予腹腔注射生理盐水和雷帕霉素10 mg/kg,模型对照组及对照组予腹腔注射等体积生理盐水。
2. 观察各组大鼠动情周期的变化
每日清晨取大鼠阴道分泌物涂抹于酒精擦拭的载玻片上,待自然风干后,进行快速革兰染色,在显微镜下观察阴道涂片的细胞类型:动情前期主要是白细胞为主,动情期主要是有核上皮细胞为主,动情后期主要是无核角化细胞为主,动情间期以上3种细胞均存在[6]。
3. 监测大鼠血糖及血清激素水平的变化
造模28 d后及给药结束后,禁食水12 h后于大鼠尾静脉取血后采用血糖仪检测血糖,麻醉后开腹暴露腹主动脉,抽取2~4 mL动脉血,离心分离血清后分装于EP管内-20℃冰箱保存备用。采用ELISA法按试剂盒说明书步骤测定血清孕激素、睾酮、雌二醇水平。
4. 监测大鼠体重及卵巢质量、体积及相对质量的变化
研究过程中每3 d清晨监测1次大鼠体重并记录,根据数值变化绘制体重变化图。研究结束时麻醉大鼠,腹主动脉取血后处死,摘取双侧卵巢,称重,放置于冰面上测量卵巢的长度、宽度及厚度,计算卵巢体积(长度×宽度×厚度)及卵巢相对质量[质量(mg)/体积(mm3)],置于4%甲醛中以备后续制作石蜡切片[7]。
5. HE染色法观察卵巢形态学变化
卵巢组织经常规固定、脱水、浸蜡、包埋,制作石蜡标本,然后以4 μm厚度切片,脱蜡后进行HE染色,操作按照试剂说明书进行。
6. Masson染色法检测卵巢组织纤维化情况
卵巢组织切片后脱蜡,根据试剂盒的操作流程依次进行染色,在光学显微镜下观察各组卵巢组织纤维化的情况,采用Image J软件对病理图片进行分析及定量,计算纤维化阳性范围(阳性面积/总面积×100%)。
7. 免疫组织化学染色法检测卵巢组织中mTOR、p-mTOR及p-P70S6表达情况
卵巢组织切片后脱蜡,然后根据试剂盒说明书进行免疫组织化学(免疫组化)染色,并于光学显微镜下观察各组染色的情况,采用Image J软件对病理图片进行分析并计算光密度(OD)值。
8. TUNEL法检测卵巢组织中细胞凋亡情况
卵巢组织切片后脱蜡,根据试剂盒说明书进行抗体修复、破膜、复染等,于荧光显微镜下观察各组大鼠卵巢组织中细胞凋亡情况,采用Image J软件对病理图片进行分析及定量。
四、统计学处理
采用GraphPad 8.0进行画图及统计学处理。其中符合正态分布的计量资料以 表示,多组间比较采用方差分析,两两比较采用LSD-t检验;不符合正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-Wallis H检验,两两比较时调整α水平,即α′ = 0.05 / 10 = 0.005;大鼠体重采用重复测量数据方差分析。α = 0.05。
结果
一、大鼠动情周期的变化
空白组及对照组大鼠基本都存在正常动情周期,模型组及低剂量组大鼠动情周期紊乱,且大部分大鼠处于无动情期或动情周期紊乱,但小部分高剂量组大鼠恢复为正常动情周期。见图1。
二、大鼠血糖和血清性激素水平的变化
造模28 d后,PCOS组、空白组和对照组大鼠的血糖、血清睾酮及雌二醇水平比较差异均有统计学意义(F值分别为12.200、8.404及24.650,P均< 0.05)。其中PCOS组大鼠的血糖、血清雌二醇及睾酮值均高于空白组及对照组(P均< 0.05);空白组与对照组的上述指标间比较差异均无统计学意义(P均> 0.05);3组血清孕激素水平比较差异无统计学意义(F = 3.690,P > 0.05)。见图2A~D。
给药28 d后,空白组、对照组、模型对照组、低剂量组及高剂量组大鼠的血糖、血清孕激素、睾酮及雌二醇水平比较差异均有统计学意义(F值分别为15.860、2.892、33.042及4940.000,P均<
0.001)。其中模型对照组大鼠的血糖、血清睾酮及雌二醇水平均高于其他各组(P均< 0.001);其他4组中除低剂量组大鼠的血糖低于对照组(P < 0.05)外,血糖、血清睾酮及雌二醇水平组间比较差异均无统计学意义(P均> 0.05);高剂量组血清孕激素水平低于空白组(P < 0.05),其他4组血清孕激素水平组间比较差异均无统计学意义(P均> 0.05)。见图2E~H。
三、大鼠体重、卵巢质量、体积及相对质量的变化
1. 大鼠体重的变化
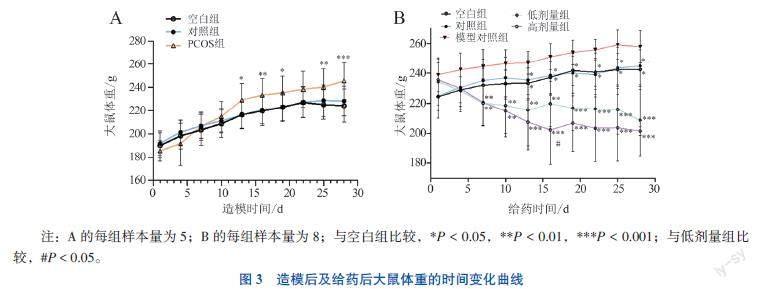
在重复测量方差分析中,大鼠体重与造模时间或给药时间存在交互效应(F值分别为23.620、11.490,P均< 0.001),故组间比较采用t检验。随着造模时间增加,空白组与对照组大鼠的体重相近(P > 0.05),从第13日起PCOS组大鼠的体重高于对照组(P均< 0.05)。造模成功后,给药后第13日起低剂量组和高剂量组大鼠体重均比模型组减少(P均< 0.05),其中高剂量组从给药第13日起体重减轻且在第16日体重低于低剂量组(P < 0.05)。见图3。
2. 大鼠卵巢质量、体积及相对质量的变化
造模28 d后,PCOS组、空白组和对照组大鼠的卵巢质量、体积及相对质量比较差异均有统计学意义(F值分别为21.216、25.803及20.080,P均< 0.05)。其中PCOS组卵巢质量、体积及相对质量均比空白组及对照组增加(P均< 0.05);空白组与对照组的上述指标组间比较差异均无统计学意义(P均> 0.05)。
給药28 d后,空白组、对照组、模型对照组、低剂量组及高剂量组大鼠的卵巢质量、体积及相对质量比较差异均有统计学意义(F值分别为141.700、9.802、64.901,P均< 0.05)。其中模型对照组的卵巢质量、体积及相对质量均大于其他各组(P均< 0.05);低剂量及高剂量组的卵巢质量及相对质量均低于空白组和对照组;空白组与对照组组间、低剂量组与高剂量组组间比较差异均无统计学意义(P均> 0.05)。造模后及给药后大鼠卵巢质量、体积及相对质量比较和卵巢组织外观见图4。
四、大鼠卵巢组织的HE染色情况
空白组及对照组大鼠的卵巢组织形态完整、结构紧密,卵巢中各级卵泡及黄体均存在;而PCOS组及模型对照组的卵巢组织结构相对松散,偶见正常卵泡存在,卵泡多数呈囊性扩张,2组相比示PCOS大鼠模型在腹腔注射雷帕霉素过程中卵巢组织仍是多囊样改变;低剂量组卵巢中卵泡仍呈囊性扩张,但部分扩张的卵泡体积稍缩小,卵巢皮质中可见少量原始卵泡;高剂量组卵巢可见呈囊性扩张的卵泡明显减少,且卵泡皮质中可见原始卵泡存在。见图5。
五、大鼠卵巢组织的Masson染色情况
各组大鼠卵巢Masson染色显示,组织纤维化主要存在于卵泡膜、萎缩的黄体与组织间质内。空白组、对照组、模型对照组、低剂量组及高剂量组大鼠卵巢组织的纤维化阳性范围组间比较差异有统计学意义(F = 9.338,P < 0.001),其中低剂量组与高剂量组的纤维化阳性范围较空白组及对照组增加,高剂量组较模型对照组增加(P均< 0.05)。见图6。
六、大鼠卵巢组织的免疫组化染色情况
免疫组化切片可见mTOR蛋白广泛表达于卵巢组织各细胞中。各组大鼠卵巢组织的mTOR蛋白OD值比较差异无统计学意义(F = 0.232,P = 0.918)。p-mTOR蛋白主要表达于卵泡、萎缩的黄体与组织间质内。空白组、对照组、模型对照组、低剂量组及高剂量组大鼠卵巢组织的p-mTOR蛋白OD值比较差异有统计学意义(F = 4.991,P =
0.003),其中模型对照组高于其他4组(P均< 0.05)。5组大鼠卵巢组织的p-P70S6蛋白OD值组间比较差异也有统计学意义(F = 4.708,P = 0.004),其中高剂量组低于空白组、对照组及低剂量组(P均< 0.05)。见图7。
七、大鼠卵巢组织的TUNEL检测结果
5组大鼠卵巢组织的TUNEL检测荧光强度组间比较差异有统计学意义(H = 57.351,P < 0.001),其中模型对照组高于空白组、对照组和高剂量组(P均< 0.005),空白组低于低剂量组(P <
0.005),高剂量组与空白组、对照组比较差异均无统计学意义(P均> 0.005)。见图8。
讨论
PCOS是育龄期女性的常见疾病,但其病因及发病机制仍不清楚[8]。有研究认为PCOS的发生可能与PCOS患者卵巢颗粒细胞不正常的细胞凋亡调控有关[9]。相关研究表明,mTOR信号通路的参与是PCOS的重要病理生理学基础[10]。mTOR信号通路蛋白的过度表达可损害卵丘细胞的相互作用,导致胰岛素抵抗,并直接影响卵泡的生长[11]。
本研究通过应用DHEA诱导大鼠体重、卵巢质量增加,卵巢体积增大,月经周期紊乱,血清睾酮水平升高,卵泡呈多囊样改变,从而成功建立PCOS大鼠模型[12]。造模后PCOS组大鼠血糖、睾酮及雌二醇水平升高,体重、卵巢质量、体积及相对质量增加,且HE染色示卵巢组织均存在多囊样改变,说明PCOS大鼠卵巢组织在短期内无法自行恢复排卵。本研究还显示,PCOS大鼠卵巢组织mTOR的磷酸化增多及卵巢细胞凋亡增加, PCOS的发生、发展可能与mTOR通路异常激活导致卵巢组织细胞凋亡有关。高剂量组mTOR的磷酸化减少,下游蛋白P70S6的磷酸化水平下调及卵巢细胞凋亡接近正常,其多囊样卵泡明显缩小,出现少数始基卵泡相结合,提示高剂量雷帕霉素通过抑制mTOR信号通路的异常激活,可能缓解PCOS大鼠卵巢组织中的多囊样改变。这一结论也与近年来相关研究一致[4, 13]。但有研究表明,雷帕霉素可能阻碍卵泡发育,进一步加剧DHEA诱导的PCOS小鼠生殖失衡[14]。而且动物的种属不同、雷帕霉素剂量不同以及给予雷帕霉素时期不同,雷帕霉素对卵巢的作用可能有所不同,对PCOS患者卵巢的作用可能也不同,故雷帕霉素对PCOS的影响仍然需要进一步研究。本研究Masson染色中,雷帕霉素可能加重PCOS大鼠卵巢组织的纤维化,其对后续卵泡的发育、排卵、受孕及后代发病情况仍需要进一步研究。
综上所述,雷帕霉素可以抑制mTOR信号通路的异常激活,缓解PCOS大鼠卵巢多囊样改变,但雷帕霉素加重卵巢组织纤维化,且大鼠体重、卵巢质量与体积低于正常水平,可能对PCOS大鼠后续卵泡发育及排卵产生不良影响,故应用雷帕霉素治疗PCOS,需综合考虑其利弊,且应结合目前临床常用药物对PCOS的疗效及不良反应综合判断。
参 考 文 献
[1] Wang Z, Zhai D, Zhang D, et al. Quercetin decreases insulin resistance in a polycystic ovary syndrome rat model by improving inflammatory microenvironment. Reprod Sci, 2017, 24(5): 682-690.
[2] Wang F, Xie N, Wu Y, et al. Association between circadian rhythm disruption and polycystic ovary syndrome. Fertil Steril, 2021, 115(3): 771-781.
[3] Torshizi F F, Chamani M, Khodaei H R, et al. Therapeutic effects of organic zinc on reproductive hormones, insulin resistance and mTOR expression, as a novel component, in a rat model of polycystic ovary syndrome. Iran J Basic Med Sci, 2020, 23(1): 36-45.
[4] 陳秀英, 管海云, 李斌, 等. 雷帕霉素对小鼠始基卵泡激活及生长发育的作用研究. 中华生殖与避孕杂志, 2020, 40(1): 24-29.
[5] Khan S H, Rizvi S A, Shahid R, et al. Dehydroepiandrosterone sulfate (DHEAS) levels in polycystic ovarian syndrome (PCOS). J Coll Physicians Surg Pak, 2021, 31(3): 253-257.
[6] 张婷, 王颖, 王莉. 大鼠阴道涂片两种染色方法比较. 中国比较医学杂志, 2018, 28(12): 98-101.
[7] 刘艳丽. 来曲唑法和脱氢表雄酮法诱导PCOS大鼠模型的比较研究. 郑州: 郑州大学, 2011.
[8] Escobar-Morreale H F. Polycystic ovary syndrome: definition, aetiology, diagnosis and treatment. Nat Rev Endocrinol, 2018, 14(5): 270-284.
[9] 吴坚, 郑赓唐, 张琳, 等. 多囊卵巢综合征卵巢颗粒细胞凋亡调控蛋白Bcl-2、Bax、p53的表达及其意义. 新医学, 2019, 50(7): 536-539.
[10] Liu J, Wu D C, Qu L H, et al. The role of mTOR in ovarian neoplasms, polycystic ovary syndrome, and ovarian aging. Clin Anat, 2018, 31(6): 891-898.
[11] Herta A C, Lolicato F, Smitz J E J. In vitro follicle culture in the context of IVF. Reproduction, 2018, 156(1): F59-F73.
[12] Li Y, Zheng Q, Sun D, et al. Dehydroepiandrosterone stimulates inflammation and impairs ovarian functions of polycystic ovary syndrome. J Cell Physiol, 2019, 234(5): 7435-7447.
[13] 周咏, 许丽, 肖月, 等. 雷帕霉素对肥胖小鼠卵巢功能的影响. 南京医科大学学报(自然科学版), 2020, 40(9): 1245-1251, 1262.
[14] Guo Z, Chen X, Feng P, et al. Short-term rapamycin administration elevated testosterone levels and exacerbated reproductive disorder in dehydroepiandrosterone-induced polycystic ovary syndrome mice. J Ovarian Res, 2021, 14(1): 64.
(收稿日期:2022-03-01)
(本文编辑:林燕薇)
