儿童重症肺炎支原体肺炎中TLR7、TLR9和IFN-Ⅰ的变化及意义
2023-05-30燕江雪丁霞焦琼杰黄莉曹囡囡董信芳倪倩
燕江雪?丁霞?焦琼杰?黄莉?曹囡囡?董信芳?倪倩

【摘要】目的 研究儿童重症肺炎支原体肺炎(SMPP)中Toll样受体7(TLR7)、TLR9和Ⅰ型IFN的变化及意义。方法 纳入80例肺炎支原体肺炎(MPP)患儿,分为非重症MPP组(MPP組)和重症MPP组(SMPP组);选择同期于门诊体检的26名健康儿童为健康对照组。收集各组儿童血清,并收集SMPP组影像学检查仅表现为单侧肺实变、肺不张、肺脓肿或肺组织坏死的26例患儿患侧和对侧肺泡灌洗液(BALF),采用ELISA检测血清及BALF中TLR7、TLR9、髓样分化因子88(MyD88)、IFN-α、IFN-β的含量。结果 与健康对照组相比,SMPP组和MPP组血清中TLR7、TLR9、MyD88、IFN-α、IFN-β水平均升高,且SMPP组血清中各因子的水平均高于MPP组(P均< 0.05)。患侧BALF中TLR7、TLR9、MyD88、IFN-α、IFN-β的水平均高于对侧(P均< 0.01)。TLR7和MyD88水平预测SMPP的受试者操作特征曲线的曲线下面积分别为0.709、0.723。结论 过度诱导和生成的TLR7、TLR9、IFN-α和IFN-β可能是儿童SMPP发生及局部肺组织严重损伤的致病因素。TLR7、MyD88可以作为SMPP的预测指标以指导临床治疗。
【关键词】儿童;重症肺炎支原体肺炎;Toll样受体7;Toll样受体9;干扰素-α;干扰素-β
Changes and significance of TLR7/9 and IFN-Ⅰ levels in children with severe mycoplasma pneumoniae pneumonia Yan Jiangxue△, Ding Xia, Jiao Qiongjie, Huang Li, Cao Nannan, Dong Xinfang, Ni Qian.△Pediatric Respiratory Department, Lanzhou University Second Hospital, Lanzhou 730030, China
Corresponding author, Ni Qian, E-mail: natelieniqian@yeah.net
【Abstract】Objective To investigate the changes and significance of Toll-like receptor 7 (TLR7), TLR9 and type I interferon (IFN-Ⅰ) in children with severe mycoplasma pneumoniae pneumonia (SMPP). Methods 80 children with mycoplasma pneumoniae pneumonia (MPP) were divided into the non-severe MPP (MPP group) and SMPP groups (SMPP group). 26 healthy children who underwent outpatient physical examination were chosen as the control group. Serum samples in each group were collected. In the SMPP group, bronchoalveolar lavage fluid (BALF) on the affected and contralateral sides of 26 children with unilateral lung consolidation, atelectasis, lung abscess or lung tissue necrosis on imaging examination were collected. The levels of TLR7, TLR9, myeloid differentiation factor 88 (MyD88), interferon-α (IFN-α) and IFN-β in the serum and BALF samples were determined by enzyme-linked immunosorbent assay (ELISA). Results The serum levels of TLR7, TLR9, MyD88, IFN-α and IFN-β in the SMPP and MPP groups were significantly higher than those in the control group, and the levels of all cytokines in the SMPP group were significantly higher compared with those in the MPP group (all P < 0.05). The levels of TLR7, TLR9, MyD88, IFN-α and IFN-β in the BALF on the affected side were significantly higher than those on the contralateral side (all P < 0.01). The area under the receiver operating characteristic curve (AUC) of serum TLR7 and MyD88 levels for predicting SMPP was 0.709 and 0.723. Conclusions Over-induced and generated TLR7, TLR9, IFN-α and IFN-β may be pathogenic factors for the incidence of SMPP and severe local lung tissue injury in children with SMPP. TLR7 and MyD88 can be used as predictors of SMPP to guide clinical treatment.
【Key words】Children; Severe mycoplasma pneumoniae pneumonia; Toll-like receptor 7; Toll-like receptor 9;
Interferon-α; Interferon-β
肺炎支原體肺炎(MPP)是儿科呼吸系统的常见疾病,所有年龄段的儿童均易感,而部分重症MPP(SMPP)患儿会发生呼吸衰竭或肺外组织损伤,甚至留下后遗症[1-2]。因此,寻找SMPP的早期预测指标和新的治疗靶点成为提高临床治愈率、改善预后的关键。现有研究认为,免疫调节紊乱在SMPP发病机制中发挥着重要作用[1, 3]。Toll样受体7(TLR7)和TLR9是先天性免疫系统中的细胞跨膜受体,两者被激活后可活化髓样分化因子88(MyD88)途径,产生大量细胞因子,如IFN、TNF-α、IL-6、IL-12等,进一步诱导适应性免疫的发生[4-6]。IFN-α和IFN-β是Ⅰ型IFN(IFN-Ⅰ)家族的主要成员,具有抗病毒及免疫调节功能,而TLR7、TLR9/MyD88/IFN-Ⅰ信号通路是生成IFN-Ⅰ的主要通路[4, 7]。有报道当负反馈调节失衡时,TLR过度激活,生成大量炎症因子,进一步导致机体产生慢性感染、自身免疫紊乱等疾病[1]。目前国内外罕见TLR7、TLR9和IFN-Ⅰ对儿童SMPP影响的相关研究。本研究通过检测MPP患儿、SMPP患儿和健康儿童的血清,以及影像学检查表现为单侧肺组织病变的SMPP组患儿患侧及对侧肺泡灌洗液(BALF)中TLR7、TLR9、MyD88、IFN-α、IFN-β的含量,探讨儿童SMPP中TLR7、TLR9、 IFN-Ⅰ的变化和意义,为寻找SMPP的治疗靶点及预测指标提供临床依据。
对象与方法
一、研究对象
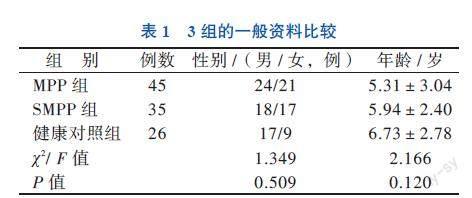
收集2020年10月至2021年10月本院收治的符合MPP或SMPP诊断标准80例患儿;其中MPP患儿45例,均收集血清;SMPP患儿35例,均收集血清,且选取26例影像学检查仅表现为单侧肺组织病变的患儿,收集患侧和对侧的BALF。根据MPP患儿入院后的病情进展,将80例患儿分为非重症MPP组(MPP组)和SMPP组。另选择同期于本院门诊体检的26名健康儿童为健康对照组。3组患儿的性别、年龄比较差异均无统计学意义(P均> 0.05),见表1。本研究获得医院伦理委员会批准(批件号:2020A-207),征得入组儿童监护人知情并签署知情同意书。
二、诊断标准
参考《儿童肺炎支原体肺炎诊治专家共识(2015年版)》及《诸福棠实用儿科学》(2002年)中的MPP诊断标准:①具有肺炎的临床表现或影像学表现;②确定肺炎支原体(MP)感染的病原学证据;③青霉素、头孢类抗菌药物治疗无效。
SMPP诊断标准:除符合MPP的诊断标准外需满足以下任一标准:①一般状况差,有拒食或脱水征;②意识障碍;③肺部浸润呈现多肺叶的受累或≥2/3的一侧肺;④呼吸频率显著增快、发绀、呼吸困难甚至呼吸衰竭;⑤胸腔积液、肺不张、肺脓肿、坏死性肺炎、肺栓塞等肺内并发症;⑥脉搏血氧饱和度≤92%;⑦心率明显增快,甚至心力衰竭;⑧脓毒血症,甚至感染性休克。
三、纳入及排除标准
MPP组及SMPP组患儿的纳入标准:①0~14岁,符合MPP及SMPP诊断标准;②病程在14 d以内;③血培养和(或)痰培养阴性、无明确病毒感染证据者;④入组前未使用过糖皮质激素和IFN治疗。健康对照组的纳入标准:0~14岁、入组前1个月内无感染史的健康儿童。
排除标准:①既往有支气管哮喘和慢性肺病等病史的患儿;②既往有血液系统疾病、严重先天性心脏病、严重肝肾功能不全、先天性支气管肺发育不良、遗传代谢性疾病、免疫缺陷疾病等具有严重基础疾病的患儿。
收集BALF的SMPP患儿纳入标准:符合上述SMPP纳入及排除标准,但是肺部CT仅存在单侧肺部影像学改变,如单侧肺不张、肺实变、肺脓肿、肺组织坏死等。
四、研究方法
1.标本采集
患儿入院后次日清晨采集空腹静脉血2 mL,对照组健康儿童清晨采集空腹静脉血2 mL,在4℃以3000转/分离心10 min后,分离血清于-80℃冰箱保存备检。
2. BALF采集
按照文献[8]技术要求,根据先对侧后患侧的原则行支气管肺泡灌洗,并收集BALF各5 mL;对侧选择右肺中叶或左上叶舌段,患侧选择病变段,总回收率≥30%,红细胞< 20%,且无大气道分泌物混入为合格标本;将新鲜BALF移取至15 mL
锥形离心管中,在相同条件下离心后,分离上清液置于-80℃冰箱保存备检。
3.标本检测
采用ELISA检测血清及BALF中TLR7、TLR9、MyD88、IFN-α、IFN-β的含量,试剂盒购自上海酶联生物科技有限公司,具体操作步骤严格按试剂盒说明书进行,检测仪器为赛默飞世尔Mulltiskan FC型酶标仪。
五、统计学处理
使用SPSS 25.0进行数据分析。计数资料用频数或百分比(%)表示,组间比较采用χ2检验。符合正态分布的计量资料以 表示。血清样本数据若方差齐,通过单因素方差分析进行多组间比较,组间两两比较采用Tukey-Kramer检验;若方差不齐,通过Brown-Forsythe检验进行多组间比较,组间两两比较采用Tamhanes T2检验。同一SMPP患儿患侧及对侧BALF的样本数据比较采用配对t检验。采用Pearson相关分析检验血清中各因子之间的相关性。绘制受试者操作特征(ROC)曲线得到曲线下面积(AUC),分析血清中各因子水平在SMPP预测中的价值。P < 0.05为差异有统计学意义。
结果
一、3组血清TLR7、TLR9、MyD88、IFN-α、IFN-β水平的比较
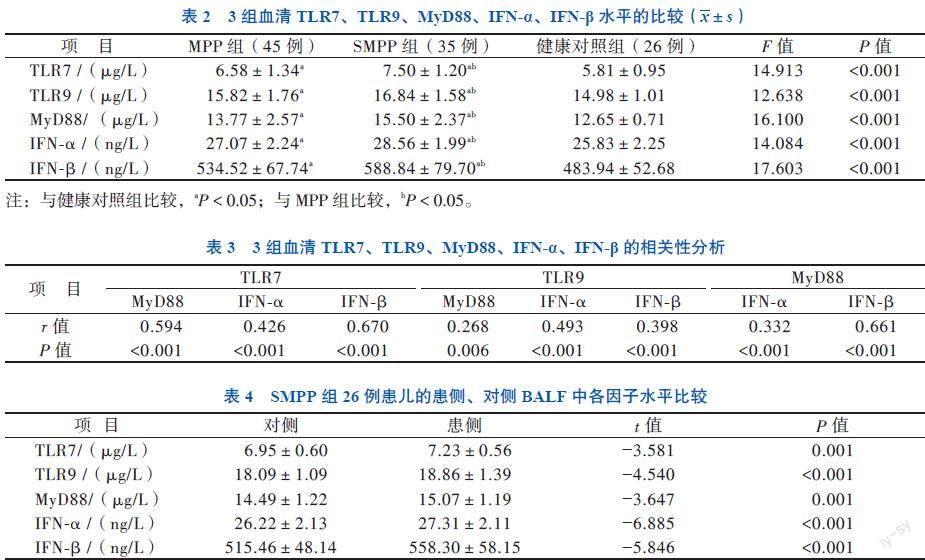
与健康对照组相比,SMPP组和MPP组血清TLR7、TLR9、MyD88、IFN-α、IFN-β的水平均有所升高(P均< 0.05),且SMPP组的上述指标水平均高于MPP组(P均< 0.05)。见表2。
二、3组血清TLR7、TLR9、MyD88、IFN-α和IFN-β的相关性分析
血清TLR7或TLR9与MyD88、IFN-α、IFN-β均呈正相关,MyD88与IFN-α、IFN-β也呈正相关(P均< 0.05)。见表3。
三、SMPP组患儿患侧、对侧BALF中的各因子水平比较
患侧BALF中的TLR7、TLR9、MyD88、IFN-α、IFN-β水平均高于对侧(P均< 0.01)。见表4。
四、血清TLR7、TLR9、MyD88、IFN-α、IFN-β
对SMPP的预测价值
TLR7和MyD88的AUC分别为0.709、0.723,其AUC均> 0.700,对SMPP的辅助诊断具有一定价值;TLR7的约登指数最大值为0.397,此时的截断值为7.08 μg/L,灵敏度为68.57%,特异度为71.11%;MyD88的约登指数最大值为0.390,此时的截断值为13.61 μg/L,灵敏度为85.71%,特异度为53.33%。见图1、表5。
讨论
MP在感染机体后,可通过特殊的细胞器黏附于宿主呼吸道上皮细胞表面生长繁殖,产生过氧化物、毒素等毒性代谢产物,造成宿主细胞损伤,并进一步激活先天性免疫系统,释放细胞因子,触发趋化及细胞毒作用;也可通过其顶端结构侵入组织细胞后合成DNA而生长繁殖,导致慢性感染[9-10]。
TLR7和TLR9主要表达于浆细胞样树突状细胞(pDC)的内体表面,分别识别病毒RNA或细菌DNA;当病原体入侵机体时,炎症部位产生的趋化因子可趋化pDC至炎症部位,此时病原体可通过受体介导的内吞作用进入pDC的内体溶酶体系统,同时TLR7和TLR9从内质网沿分泌途径也进入内体溶酶体系统,进一步启动MyD88依赖信号通路,引导IFN调节因子7向细胞核易位,进而促进细胞合成IFN-Ⅰ,生成的IFN-Ⅰ可与Ⅰ型IFN受体结合,启动多个信号转导通路,调控多种免疫细胞的功能,如1型辅助性T淋巴细胞(Th1)、细胞毒性T淋巴细胞(CTL)、自然杀伤细胞(NK)等,并释放TNF-α、IL-1、IL-2、IL-3、IFN-γ 等细胞因子[8,11-14]。
TLR信号转导及后续的功能必须受到严格的负调控,以控制过度的炎症反应,减轻宿主的组织损伤;大多数负调控因子的表达可由TLR的激活引起,并以负反馈的方式终止TLR的功能[15]。但是,当负反馈调节失衡时,TLR通路的过度激活导致机体产生慢性感染、自身免疫紊乱等相关疾病[1, 15]。例如在SLE中,TLR7促进患者的pDC分泌大量IFN-α,这是SLE组织损伤的重要机制[14]。流行性感冒病毒感染后可激活TLR7,通过MyD88依赖途径,诱导大量IFN-α生成,发挥抗病毒及免疫调节作用,但当负反馈调节失衡时,IFN-α可通过诱导TNF-α、C-X-C基序趋化因子10 (CXCL10)等促炎及趋化因子的不当表达,过度活化并募集中性粒细胞,导致免疫调节紊乱,造成急性肺损伤[16]。
本研究显示,MPP组和SMPP组血清TLR7、TLR9、MyD88、IFN-α、IFN-β的水平均比对照组升高,且SMPP组患儿上述各因子的水平均高于MPP组。此外,本研究检测了影像学检查仅表现为单侧肺组织病变的SMPP患儿患侧和对侧BALF
中TLR7、TLR9、MyD88、IFN-α和IFN-β水平,结
果显示患侧各因子水平均高于对侧。上述结果表明MP感染机体后会促进TLR7、TLR9的诱导和IFN-α、IFN-β的生成,且SMPP患儿外周血中和损伤肺组织局部TLR7、TLR9、IFN-α、IFN-β水平更高,说明过度活化的TLR7、TLR9和过度生成的IFN-α、IFN-β很有可能是SMPP的致病因素。寻找可以应用于临床的TLR7、TLR9抑制剂,有可能成为治疗SMPP的新方法。Yang等[17]发现,与健康对照组相比,IFN-α2水平在轻症MPP患儿BALF中并无升高,但在SMPP患儿BALF中升高,与本研究一致。另有学者报道,新型冠状病毒感染引起的重症肺炎血管并发症,依赖于血管紧张素转换酶2(ACE2)的表达,而IFN-α或IFN-β可促进ACE2的表达,并且IFN-α对内皮细胞血管形成、稳态和屏障功能可产生不利影响[18]。过度表达的IFN-α、IFN-β和ACE2是否参与了SMPP的肺血管损伤机制,有待进一步研究。
本研究中血清各因子的相关性分析显示,血清TLR7或TLR9与MyD88、IFN-α、IFN-β水平之间均呈正相关。综合以上结果,推测TLR7、TLR9/MyD88/IFN-Ⅰ信號通路可能是SMPP致病信号通路,该信号通路的过度活化很有可能是SMPP患儿局部肺组织急性损伤的致病机制。由于本研究为临床试验,相较于动物实验而言,具有一定局限性,如不能严格控制发病时间来观察上述因子的动态变化等,所以仍需进一步的研究来证实该信号通路在SMPP发病中的意义。
ROC曲线分析显示,TLR7、MyD88的AUC >
0.700,对SMPP具有一定的预测价值,其中以MyD88为诊断指标时的AUC最大、灵敏度较高。IFN-α和IFN-β的AUC分别为0.666、0.694,十分接近0.700,笔者推测在后续加大研究的样本量后,IFN-α和IFN-β也可能是预测SMPP的辅助指标。
综上所述,过度诱导和生成的TLR7、TLR9、IFN-α和IFN-β可能是儿童SMPP发生及SMPP肺组织严重损伤的致病因素之一。TLR7、MyD88可以作为SMPP的预测指标辅助指导临床治疗。未来通过研究和使用TLR7、TLR9的拮抗剂来抑制其诱导活化,有可能减轻SMPP患儿的病情,阻止急性肺损伤。由于本研究纳入的病例数较少,加之临床研究有其局限性,后续研究将继续加大样本量,并进一步完善TLR7、TLR9/MyD88/IFN-Ⅰ信号通路与SMPP致病机制相关研究,为SMPP的诊治提供更为充分的依据。
参 考 文 献
[1] Sun L L, Ye C, Zhou Y L, et al. Meta-analysis of the clinical efficacy and safety of high- and low-dose methylprednisolone in the treatment of children with severe mycoplasma pneumoniae pneumonia. Pediatr Infect Dis J, 2020, 39(3): 177-183.
[2] Zheng B, Zhao J, Cao L. The clinical characteristics and risk factors for necrotizing pneumonia caused by Mycoplasma pneumoniae in children. BMC Infect Dis, 2020, 20(1): 391.
[3] 张贺, 刘晓萌, 宋义琴, 等. 甲泼尼龙辅助治疗儿童肺炎支原体感染性大叶性肺炎疗效与安全性分析. 新医学, 2020, 51(8): 624-627.
[4] Arora S, Ahmad S, Irshad R, et al. TLRs in pulmonary diseases. Life Sci, 2019, 233: 116671.
[5] Anthoney N, Foldi I, Hidalgo A. Toll and Toll-like receptor signalling in development. Development, 2018, 145(9): dev156018.
[6] Marongiu L, Gornati L, Artuso I, et al. Below the surface: the inner lives of TLR4 and TLR9. J Leukoc Biol, 2019, 106(1): 147-160.
[7] Mesev E V, LeDesma R A, Ploss A. Decoding type I and III interferon signalling during viral infection. Nat Microbiol, 2019, 4(6): 914-924.
[8] 国家卫生健康委员会人才交流服务中心儿科呼吸内镜诊疗技术专家组,中国医师协会儿科医师分会内镜专业委员会,中国医师协会内镜医师分会儿科呼吸内镜专业委员会,等. 中国儿科可弯曲支气管镜术指南(2018年版). 中华实用儿科临床杂志, 2018, 33(13):983-989.
[9] Lanao A E, Chakraborty R K, Pearson-Shaver A L. Mycoplasma infections. Treasure Island (FL): StatPearls Publishing, 2021.
[10] 陈春艳, 刘紫玲, 余斓, 等. 肺炎支原体荚膜多糖抑制树突状细胞吞噬和膜分子表达. 中国免疫学杂志, 2018, 34(1): 15-18, 24.
[11] Ivin M, Dumigan A, de Vasconcelos F N, et al. Natural killer cell-intrinsic type I IFN signaling controls Klebsiella pneumoniae growth during lung infection. PLoS Pathog, 2017, 13(11): e1006696.
[12] 彭卓颖, 薛婧, 魏强. HIV-1病毒与浆细胞样树突状细胞的相互作用. 中国比较医学杂志, 2017, 27(6): 77-81.
[13] Balan S, Saxena M, Bhardwaj N. Dendritic cell subsets and locations. Int Rev Cell Mol Biol, 2019, 348: 1-68.
[14] Takagi H, Arimura K, Uto T, et al. Plasmacytoid dendritic cells orchestrate TLR7-mediated innate and adaptive immunity for the initiation of autoimmune inflammation. Sci Rep, 2016, 6: 24477.
[15] Kumar V. Toll-like receptors in sepsis-associated cytokine storm and their endogenous negative regulators as future immunomodulatory targets. Int Immunopharmacol, 2020, 89(Pt B): 107087.
[16] 杨磊. IRF7-IFN-α信号通路在流感病毒诱导急性肺损伤中的作用及可能机制. 长春: 吉林大学, 2019.
[17] Yang M, Meng F, Gao M, et al. Cytokine signatures associate with disease severity in children with Mycoplasma pneumoniae pneumonia. Sci Rep, 2019, 9(1): 17853.
[18] Klouda T, Hao Y, Kim H, et al. Interferon-alpha or -beta facilitates SARS-CoV-2 pulmonary vascular infection by inducing ACE2. Angiogenesis, 2022, 25(2): 225-240.
(收稿日期:2022-06-10)
(本文編辑:林燕薇)
