粪菌移植抗小鼠肠道菌群紊乱所致内毒素血症损伤研究
2023-05-30张伟陈雪龙陈水云齐艳萍
张伟 陈雪龙 陈水云 齐艳萍

摘 要:背景:肠道菌群在动物的新陈代谢、生长发育和维持健康过程中发挥了重要作用,调节机体免疫功能,使之处于平衡状态,从而避免或减少免疫相关疾病的发生。一旦肠道菌群紊乱将会导致机体出现内毒素血症,此时可以通过粪菌移植来调节小鼠的肠道菌群紊乱并且抑制由于肠道菌群紊产生的内毒素血症等相关炎症。方法:将30只健康小鼠随机分为3组,每组10只。在相同情况下置于普通动物饲养室饲养一周后,空白组10只小鼠饲喂普通日粮,对照组10只小鼠添加抗生素,实验组10只小鼠在饲喂抗生素后进行粪菌移植;上述小鼠血清采用ELISA法检测TNF-α、IL-1β、IL-6、IL-10以及LPS;对其中部分小鼠肠道进行基于16S rDNA基因的微生物多样性检测。结果:对照组小鼠体内的炎性因子LPS、TNF-α、IL-6较空白组组显著升高(P<0.05),而IL-10、IL-1β的数值显著低于空白组(p<0.05);进行粪菌移植后,实验组小鼠体内的促炎因子浓度明显下降,实验组小鼠血清中LPS、TNF-α、IL-6的水平显著低于治疗前(p<0.05);IL-10、IL-1β的水平高于治疗前(p<0.05);16S rRNA检测结果显示,在对小鼠进行粪菌移植后,通过Alpha多样性和Beta多样性分析,粪菌移植后的小鼠肠道内物种多样性增加。意义:抗生素能够导致正常小鼠的肠道菌群紊乱,通过粪菌移植可以调节肠道菌群结构,从而改善内毒素血症。
关键词:粪菌移植;内毒素血症;肠道菌群紊乱;炎性因子
中图分类号:S854.5+3 文献标识码:A 文章编号:1673-260X(2023)03-0049-05
肠道菌群在动物的新陈代谢、生长发育和维持健康过程中发挥了重要作用,能调节机体免疫功能,使之处于平衡状态,从而避免或减少免疫相关疾病的发生,一旦肠道菌群紊乱将会导致机体出现内毒素血症。研究发现抗生素混合物干预肠道菌群的小鼠,由于肠道菌群缺失会导致淋巴组织发育受损、免疫细胞内环境平衡失调,并改变胃肠道对感染性或炎性疾病的易感性[1-3]。内毒素是一种巨分子化合物类脂多糖体,存在于革兰氏阴性菌的胞壁外膜之最外层[4]。内毒素血症可以在多系统的多种疾病中出现,通常会造成致死性感染性休克、多器官功能衰竭、弥漫性血管内凝血等,病死率极高[5,6]。
而粪菌移植是一种将外源健康微生物群落移植到受体肠道中,从而改变患病受体的肠道微生态紊乱,使之恢复健康稳态的一种技术手段。近年来,以FMT为代表的菌群移植技术在人类的临床医学上得到了广泛应用,它可以有效治疗艰难梭菌等引起的肠炎等疾病[7]。一些在猪上开展的研究表明,使用FMT方法引入外源“健康”或者“功能”菌群能够快速、有效地改善受体动物的肠道健康,优化肠道菌群,增强免疫机能,强化代谢功能[8]。然而,由于粪便菌群与肠道中的菌群在数量和组成上还有很大不同[9],因此有必要深入分析和确认是否肠道菌移植和粪菌移植会对动物的生理稳态和代谢进程产生差异影响。这将为进一步优化菌群移植方法的可行性,开发更为合适的调控技术提供理论基础和技术支持,同时也为菌群移植在畜牧业生产中能够标准量化提供一定的思路。目前,粪菌移植技术已经在人类医疗中得以应用,即将健康人粪便中的功能性菌群移植至患者胃肠道中,从而通过重建新的肠道菌群来治疗肠内、外疾病。在畜牧业中,也可通过该技术进行肠道菌群结构的调节,从而改善内毒素血症。本文旨在通过粪菌移植来调节小鼠的肠道菌群紊乱,抑制由于肠道菌群紊导致的内毒素血症等相关炎症,为该技术在畜牧业中的应用提供基础依据和技术参考。
1 材料与方法
1.1 小鼠分组
健康雄性小鼠,20-25g,于普通动物饲养室饲养,自由饮用自来水,室内温度22-26℃,相对湿度60-80%,定时通风换气。
将30只小鼠随机分为3组,每组10只小鼠。在相同情况下置于普通动物饲养室饲养一周后,空白组10只小鼠饲喂普通日粮,对照组10只小鼠添加抗生素,实验组10只小鼠在饲喂抗生素后进行粪菌移植。抗生素處理组采用联合抗生素氨苄青霉素8g/L、硫酸新霉素(8g/L和万古霉素4g/L),建立内毒素血症模型。
1.2 体征评分
在饲喂抗生素后,观察一周,对小鼠的临床症状,如小鼠出现呆滞,竖毛,呼吸困难,腹泻等行为进行评分;腹泻评分参考文献,以大便性状为计分标准。根据小鼠每日血便情况和大便性状进行评分,大便性状正常计0分,软但成形计1分,未成形便计2分,稀便计3分。血便情况潜血阴性计0分,隐血阳性计1分,便中带血计2分,血便计3分。两项评分相加得分,以上行为各记一分,大于一分则认为存在炎症。通过观察发现饲喂抗生素的小鼠出现呆滞,腹泻行为。
小鼠粪便软且成型计1分,便中带血计2分,大于标准一分,所以则认为小鼠体内存在炎症。
1.3 内毒素血症检测
采集小鼠血清,用ELISA试剂盒检测TNF-α、IL-1β、IL-6、IL10等抗炎细胞因子和LPS浓度,通过对比饲喂抗生素前后试剂盒检测的血清浓度评价是否患内毒素血症,再通过灌胃后观察血清浓度是否发生变化来观察是否对肠道菌群紊乱的小鼠有治疗效果。
1.4 粪菌移植
将正常小鼠的粪便稀释离心后制备健康菌群混悬液。肠道菌群紊乱的小鼠灌胃给予混悬液500μL,每日2次,连续灌胃五日。利用16S和ELISA检测肠道菌群、TNF-α、IL-1β、IL-6等血清指标。
2 结果与分析
2.1 抗生素对小鼠血清炎性细胞因子的影响
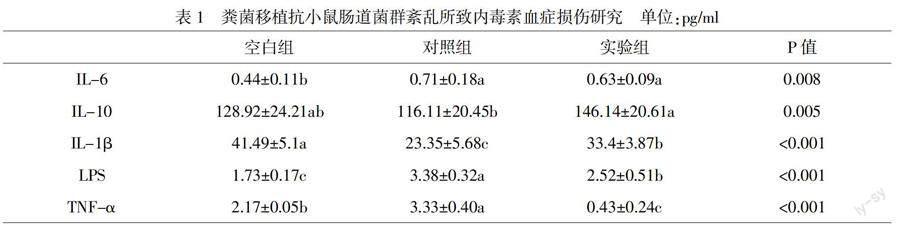
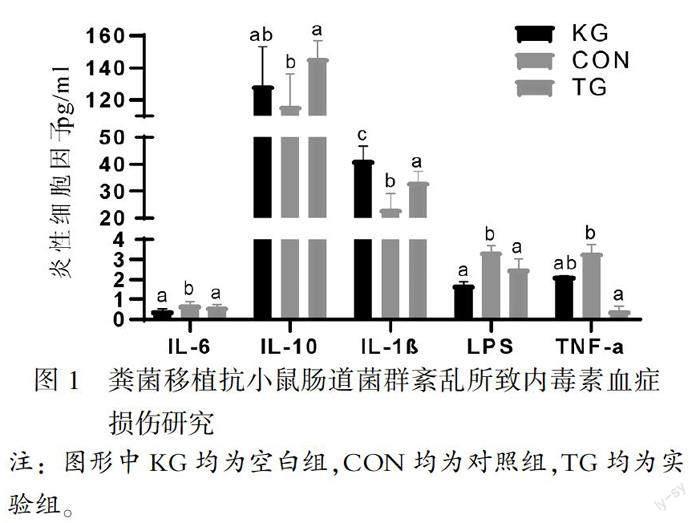
由表1可知,给予抗生素后,对照组小鼠体内炎性指标TNF-α、IL-6的数值显著高于空白组小鼠(p<0.05),IL-10、IL-1β的数值低于空白组(p<0.05),LPS的数值显著高于空白组(p<0.05)。
2.2 粪菌移植对血清炎性细胞因子的影响
对患内毒素血症小鼠进行粪菌移植后,用ELISA试剂盒进行检测。由表1可知,在进行粪菌移植后,实验组小鼠血清中TNF-α、IL-6的水平显著低于治疗前(p<0.05);IL-10、IL-1β的水平高于治疗前(p<0.05),LPS的水平明显低于治疗前(p<0.05)。
2.3 测序结果分析
在对10只加入抗生素的小鼠7只正常饲喂的小鼠以及4只灌胃后的小鼠采取其粪便标本进行测序后,我们对3组的小鼠粪便样本进行16S rDNA高通量测序分析。根据测序及注释结果,所有粪便样本中共检测出15054个OTU。维恩图(图2)展示出三组小鼠粪便中OTU组成情况。其中三组共有的OTU为核心OTU共22个。对照组,空白组,实验组所特有的OTU数分别为7162、1085、5347个。
我们使用Past数据分析软件绘制香农曲线(shannon rarefaction curve)来评估测序数量是否足够,shannon稀释曲线还能间接代表着标本中微生物菌群的丰富程度。香农指数作为一个评价样品内物种多样性程度的指标,其数值越大表示样品中的多样性程度越高。从图3中可看出,随着数量的增多,每个粪便标本中的香农指数期望值曲线都达到平台区,代表本次测序的结果可以覆盖住粪便样本中大部分细菌的物种丰度,说明此次测序的结果是合理的,测序结果能代表粪便样本中微生物群的多样化特点。为了探讨粪菌移植后肠道菌群多样性和丰度变化,比较菌群多样性指数图3列出了Alpha多样性分析参数,包括Chao1指数、Shannon指数和Simpson指数。根据Alpha多样性分析显示,在加入抗生素以后小鼠体内的菌群多样性显著低于空白组(P<0.05)。在对肠道菌群紊乱的小鼠进行粪菌移植后,粪菌移植组肠道菌群多样性明显高于对照组(P<0.05)。由图可见,表明幼年小鼠经抗生素混合物干预肠道菌群后,对饲喂抗生素的小鼠进行粪菌移植后可以看出相对于空白组小鼠Alpha多样性增加,肠道内物种多样性增加,小鼠体内的肠道菌群更加丰富。
为了探讨FMT后肠道菌群群落之间的相似度,采用基于binary-euclidean算法的PCoA(Principal co-ordinates analysis)分析方法进行β多样性分析。两点之间的距离越近,表明两个样本之间的微生物群落结构相似度越高,差异越小。Beta多样性如PCA图(图4)中所示,横坐标PC1贡献度为40.6%,纵坐标PC2贡献度为14.1%,三组小鼠肠道菌群可明显区分,同一组内小鼠样本聚集在一起,说明同组内小鼠肠道菌群相似度高;组间小鼠样本在空间距离较远,表明组间样本相似度低。结果显示,对照组与空白组和粪菌移植组样本相似度低,粪菌移植组与空白组之间肠道菌群相似度高。
3 讨论与分析
相关报道发现,结肠炎患者常伴有肠道菌群失衡。有益菌群数量减少,有害菌群增多,导致肠道屏障功能受损,促进疾病进展[10]。同时,肠道存在促炎与抗炎因子的动态平衡,结肠炎发生与促炎、抗炎因子动态平衡失衡存在密切联系,其中TNF-α、IL-6等具有重要促进作用[11]。局部炎症反应会促进IL-6等分泌与合成,而IL-6等又会诱导大量TNF-α产生,进而加重结肠炎患者病情[12]。因此调解肠道菌群、减轻患者炎症反应是结肠炎治疗的关键环节。在生命刚开始就存在于肠道里的菌群,对于构建肠道菌群及对肠道能否保持健康起着重要作用,生命早期使用抗生素能够破坏这些菌群的优势作用并延迟肠道菌群的正常构建[13]。抗生素对肠道菌群的影响是持久的,根据抗菌药物的作用范围、剂量、给药途径和治疗时间,抗菌药物可以极大地改变肠道和口腔内微生物群落的组成[14]。在摄入抗生素后的几天内,微生物的多样性通常会减少,而且很少能完全恢复最初的细菌群落组成。有研究报道一岁以内婴儿使用抗生素后肠道内双歧杆菌和拟杆菌相对丰度减少和细菌群落的多样性减少,这会使新生儿存在使用抗生素后潜在的抗生素耐药或肠道菌群紊乱相关疾病的危险中[15]。肠道菌群在动物的新陈代谢、生长发育和维持健康过程中发挥了重要作用,肠道菌群紊乱会促使条件致病菌(有害菌)过度生长和繁殖,引起胃肠道内毒素(LPS)含量增加,进而导致肠粘膜屏障受到破坏、通透性增加造成肠源性LPS入血[16],LPS随血液流经全身各器官组织,使机体发生系统性慢性炎症,从而引起亚临床内毒素血症。这与本实验中对正常小鼠饲喂抗生素后,体内炎性因子发生的变化一致,在给予抗生素后,小鼠血清浓度含有的炎性因子TNF-α、IL-1β、IL-6、IL-10与空白组相比均有明显变化,其中TNF-α、IL-6的水平比空白组水平显著增高,LPS的数值显著高于空白组,而IL-10和IL-1β的水平则比空白组显著降低。这与吴思谋的长期抗生素暴露对高脂饮食负荷小鼠糖代谢和肠道菌群的影响研究中的观点一致。长期饲喂抗生素可以干预高脂饮食负荷小鼠的肠道菌群,并且调节代谢紊乱的研究结果一致[17]。
粪菌移植又称为粪便细菌治疗或肠道菌群移植,是指将健康供体的粪便微生物通过上消化道或下消化道途径转移至患病个体的胃肠道,通过重建肠道菌群、调节菌群与宿主间的相互作用,达到治疗疾病的目的。粪菌移植是通过口服或灌腸的方法,将健康机体粪便送入肠道,有助于肠道菌群的恢复和减少细菌耐药。研究表明,粪菌移植对于调节结肠炎患者肠道菌群平衡、重建肠道微生态系统及恢复肠黏膜屏障有明显疗效,在治疗艰难梭菌相关腹泻、炎症性肠病和免疫治疗相关结肠炎的成功经验也说明其在改变肠道菌群的组成以促进个体健康中的作用[18]。在2003年一项研究报告指出,6例反复发作的重症UC患者在接受FMT治疗后,临床症状得到缓解,并且电子结肠镜检查和组织血检查后发现,患者的肠道炎性症状缓解及组织黏膜得到修复[19]。由此可见,肠道菌群平衡对维持小鼠肠黏膜免疫屏障功能方面同样具有重要作用,若肠道菌群失调便可激活肠道内多种免疫细胞,释放大量炎症介质因子,因此,粪菌移植能够调节肠道菌群结构。本实验通过对健康小鼠饲喂抗生素导致肠道菌群紊乱,从而导致小鼠体内出现内毒素血症,小鼠出现眼珠发红,粪便多成稀状,精神状态萎靡等临床症状,而通过粪菌移植治疗肠道菌群紊乱后,小鼠临床症状有所减轻,精神状态活跃,粪便逐渐正常。在对患内毒素血症小鼠进行粪菌移植后,通过小鼠体内的炎性因子的检测发现,在进行粪菌移植后,实验组小鼠血清中TNF-α、IL-6的水平显著低于治疗前(p<0.05);IL-10、IL-1β的水平高于治疗前(p<0.05),LPS的水平明显低于治疗前(p<0.05)。小鼠的内毒素血症状况得到改善,临床症状和血清指标充分说明粪菌移植在对于肠道菌群紊乱的治疗中起到明显的效果,也充分证实了粪菌移植是有效的治疗方法。
综上所述,粪菌移植能够改善抗生素导致的小鼠肠道菌群紊乱,调节肠道菌群结构,从而改善内毒素血症。
——————————
参考文献:
〔1〕Abt MC, Artis D. The intestinal microbiota in health and disease: the influence of microbial products on immune cell homeostasis [J].Current Opinion in Gastroenterology, 2009, 25(06): 496-502.
〔2〕Littman DR, Pamer EG. Role of the commensal microbiota in normal and pathogenic host immune responses [J]. Cell Host & Microbe, 2011, 10(04): 311-323.
〔3〕Smith K, Mccoy KD, Macpherson AJ, et al. Use of axenic animals in studying the adaptation of mammals to their commensal intestinal microbiota [J]. Seminars in Immunology, 2007, 19(02): 59-69.
〔4〕Scher JU, Abramson SB. The microbiome and rheumatoid arthritis [J]. Nature Reviews Rheumatology, 2011, 7(10): 569-578.
〔5〕Wu HJ, Ivanov II, Darce J, et al. Gut-residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cells [J]. Immunity, 2010, 32(06): 815-827.
〔6〕Brown JM,Hazen SA. The gut microbial endocrine organ: bacterially derived signals driving cardiometabolic diseases[J]. Annual Review of Medicine, 2015, 66(01): 343-359.
〔7〕黄河,张阳,刘柱成,等.美沙拉嗪口服联合灌肠治疗高龄活动期溃疡性左半结肠炎的疗效[J].实用医学杂志,2020,36(03):365-368.
〔8〕KATO S, KANI K, ISHIBASHI A, et al. RETRACTED:P444 Shared decision making for switching from oral me-salazine tablets to granules in low adherent inflammatorybowel disease patients[J].J Crohns Colitis,2018,12(suppl_1): S329.
〔9〕賈子君,杨振寰,甄建华,等。美沙拉嗪联合康复新液灌肠治疗溃疡性结肠炎及对炎症因子与凝血功能影响的Meta分析[J].中医药导报,2019, 25(18):119-126.
〔10〕SPROCKETT, DANIEL, FUKAMI, TADASHI, RELMAN, DAVID A.. Role of priority effects in the early-life assembly of the gut microbiota[J]. Nature reviews. Gastroenterology& hepatology,2018,15(04):197-205.
〔11〕Nogacka AM, Salazar N,Arboleya S, etal.Early microbiota, antibiotics and health[J].Cellular and Molecular Life Sciences, 2018,75(01):83-92.
〔12〕Tiancheng Wang, Mengyao Guo, Xiaojing Song, Zecai Zhang, Haichao Jiang, Wei Wang, Yunhe Fu, Yongguo Cao, Lianqin Zhu*, Naisheng Zhang* Stevioside Plays an Anti-inflammatory Role by Regulating the NF-κB and MAPK Pathways in S. aureus-infected Mouse Mammary Glands. Inflammation. 2014 Oct;37(05):1837-46.
〔13〕吴思谋,苗钟化,周青青,等.长期抗生素暴露对高脂饮食负荷小鼠糖代谢和肠道菌群的影响[J].现代预防医学,2021,48(21):3878-3883.
〔14〕赵微,张峰睿,缪应雷.炎症性肠病与肠道微生态[J].胃肠病学,2019,24(06):381-384.
〔15〕Tazoe H, Otomo Y, Kaji I, et al. Roles of short-chain fatty acids receptors, GPR41 and GPR43 on colonic functions.[J]. Journal of Physiology and Pharmacology, 2008, 59(2): 251-262.
〔16〕Morrison DJ, Preston T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism [J]. Gut Microbes, 2016, 7(03): 189-200.
〔17〕BRUNSE A, MARTIN L, RASMUSSEN T S, et al. Effect of fecal microbiota transplantation route of administration on gut colonization and host response in preterm pigs[J]. The ISME journal,2019,13(03):720-733.
〔18〕NIEDERWERDERMC, CONSTANCELA, ROWLAND R R R, et al. Fecal Microbiota Transplantation Is Associated With Reduced Morbidity and Mortality in Porcine Circovirus Associated Disease[J].Frontiers in Microbiology,2018,18(01):37.
〔19〕CARSTENSA, ROOSA, ANDREASSONA, et al. Differential clustering of faecal and mucosa-associated microbiota in healthy individuals[J]. Journal of Digestive Diseases, 2018,19:745-752.
收稿日期:2022-11-19
基金项目:安徽省教育厅重点项目(KJ2021A0872)
通讯作者:齐艳萍(1979-),女,黑龙江绥化人,教授,博士,主要从事动物流行病学及疫病防控方面的研究,E-mail:qiyanping2018@vip.163.com
