黑色素瘤缺乏因子2在缺氧复氧损伤介导的肝细胞焦亡中的作用▲
2020-11-30李春桃唐苏婷喻淋淋徐云柯
李春桃 唐苏婷 喻淋淋 徐云柯 郭 勇 李 波
(1 西南医科大学附属中医医院肝胆外科,四川省泸州市 646000,电子邮箱:373632809@qq.com;2 西南医科大学附属医院肝胆外科,四川省泸州市 646000)
肝脏缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)是各种临床病理过程和肝脏手术的主要并发症,例如失血性休克、创伤、肝移植和肝切除术[1-3]。由于激活了氧化应激、免疫应答和细胞凋亡等过程,HIRI具有高发病率和高死亡率的特征[4-6]。目前,临床上采用缺血预处理和药物制剂来预防和减轻HIRI[7],但是缺血预处理并不适用于所有HIRI患者,且目前可用的药物制剂对HIRI的疗效也有限[8]。目前尚无有效、规范的方法用于预防和减轻HIRI[9]。因此,明确HIRI发展的作用机制显得尤为迫切。
细胞焦亡由Zychlinsky等[10]发现并命名,是一种有别于细胞凋亡的细胞程序性死亡,其典型特征是细胞膜快速破裂以及促炎因子的释放[11]。目前,已经在脑、心脏、肾脏、肝脏等多种脏器缺血再灌注损伤中发现了细胞焦亡的现象[12-18]。由此推测细胞焦亡参与HIRI的发生发展并可能发挥重要作用。黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)属于具有200个氨基酸重复序列的造血干扰素诱导性核抗原家族,蛋白质编码区全长1 032 bp,共编码344个氨基酸,能响应外源性病原微生物以及内源性免疫应激,形成炎性体复合物,诱导细胞焦亡[19]。已有研究表明,HIRI小鼠肝组织中的AIM2蛋白表达水平上调[20]。然而,AIM2在HIRI介导的细胞焦亡中是否发挥作用尚不清楚。本研究利用缺氧复氧干预L02细胞系以构建HIRI体外模型,探究AIM2在缺氧复氧损伤介导的肝细胞焦亡中的作用。
1 材料与方法
1.1 细胞和试剂 人正常肝细胞系L02购自武汉普诺赛生命科技有限公司。RPMI-1640培养基(批号:42401042)、胎牛血清(批号:10099133C)、青链霉素双抗(批号:15070063)、磷酸缓冲盐溶液(phosphate buffered saline,PBS;批号:10010023)购自美国Gibco公司;细胞计数检测(cell counting kit-8,CCK-8)试剂盒购自日本DOJINDO公司(批号:CK04);FAM-FLICA半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,Caspase)-1试剂盒购自美国ImmunoChemistry Technologies公司(批号:1904D);组织裂解液(批号:R0010)以及高效化学发光试剂盒(批号:SW2020)购自北京索莱宝科技有限公司。二喹啉甲酸试剂盒(批号:23227)、Lipofectamine 3000转染试剂(批号:L3000015)、针对AIM2的小干扰RNA(si-AIM2,批号:4392420)以及相应的阴性对照(si-NC,批号:4457287)购自美国Thermo Fishier Scientific公司;抗Caspase-1兔多克隆抗体(批号:ab1872)、抗AIM2兔多克隆抗体(批号:ab93015)、抗白细胞介素(interleukin,IL)-1β兔单克隆抗体(批号:ab9722)、抗IL-18兔多克隆抗体(批号:ab191152)、抗β-肌动蛋白兔多克隆抗体(批号:ab5694)以及辣根过氧化物标记的山羊抗兔IgG二抗(批号:ab205718)均购自英国Abcam公司。
1.2 实验方法
1.2.1 细胞培养:L02细胞培养于含10%胎牛血清、1%青链霉素双抗的培养瓶中,放置于5%二氧化碳、37℃恒温细胞培养箱内。每2 d换液1次,当细胞长至90%融合状态时进行传代。
1.2.2 缺氧复氧细胞模型的建立:将部分L02细胞接种在6孔板中(1×106个/孔),常规培养24 h,400倍AE31型倒置显微镜(厦门麦克奥迪实业有限公司)下观察细胞并收集细胞备用,设为空白对照。其余L02细胞转入缺氧环境培养箱中,条件设置为37℃、1% O2、5%二氧化碳、94% N2,培养6 h后,将细胞转至37℃、5%二氧化碳、95%空气的恒温培养箱中复氧培养,分别在复氧1 h、3 h、6 h、12 h、24 h后在400倍显微镜下观察并收集细胞备用。
1.2.3 si-AIM2、si-NC转染L02细胞:按照说明书的操作步骤,用Lipofectamine 3000转染试剂分别将si-AIM2、si-NC转染L02细胞,分别作为缺氧复氧+si-AIM2组、缺氧复氧+si-NC组。转染6 h后,更换为含10%胎牛血清但不含双抗的培养基继续培养6 h,之后进行缺氧培养6 h,复氧培养12 h并收集细胞备用,缺氧、复氧的方法同1.2.2。另取L02细胞分别作为缺氧复氧模型组、空白对照组,均不进行转染,前者采用1.2.2的方法进行缺氧培养6 h、复氧培养12 h,而后者则在常氧条件下培养等量时长,最后收集细胞备用。
1.2.4 细胞活性测定:采用CCK-8法检测细胞活性。将L02接种到96孔板中(7×103个/孔),预培养24 h,然后分别按照1.2.2及1.2.3对细胞进行分组及处理后,每孔加入10 μL CCK-8试剂,避光孵育3 h。将MK3全自动酶标仪(美国Thermo Fisher公司)设置在450 nm波长并记录OD值。实验重复4次。
1.2.5 细胞焦亡率测定:采用流式细胞术检测细胞焦亡率。参照文献[21],根据L02细胞中活化的Caspase-1和碘化丙啶的双阳性染色情况来评估细胞焦亡情况。收集经1.2.2及1.2.3步骤干预后的L02细胞,用1 mL胰酶在37℃条件下消化1 min。消化后吸出胰酶,加入PBS,在室温条件下1 000 r/min离心5 min,吸出PBS,重复3次。PBS重悬细胞,用FAM-FLICA Caspase-1和碘化丙啶对细胞进行双染色,按照试剂盒说明书进行操作。然后通过FACSCalibur流式细胞仪(美国BD公司)进行检测。实验重复3次。
1.2.6 蛋白免疫印迹实验:收集经1.2.2及1.2.3步骤干预后的L02细胞,用裂解液裂解并提取蛋白质,使用二喹啉甲酸试剂盒进行蛋白定量,通过聚丙烯酰胺凝胶电泳对定量的蛋白进行分离。将分离的蛋白转到聚偏氟乙烯膜上,再将聚偏氟乙烯膜用5%脱脂乳封闭1 h,在4℃条件下将封闭后的聚偏氟乙烯膜分别与抗AIM2(1 ∶1 000)、Caspase-1(1 ∶1 000)、IL-1β(1 ∶1 000)、IL-18(1 ∶500)、β-肌动蛋白(1 ∶200)的一抗共同孵育过夜,之后与二抗(1 ∶5 000)在室温下孵育1 h,用高效化学显影试剂盒使条带可见,利用Image-Pro Plus 6.0软件统计蛋白条带灰度,根据β-肌动蛋白灰度值对定量结果进行归一化处理。实验重复3次。
1.3 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用单因素方差分析,其中两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同复氧时间下L02细胞的形态 随缺氧后复氧时间的延长,L02细胞的形态损伤逐渐加剧,漂浮细胞团块逐渐增多。见图1。
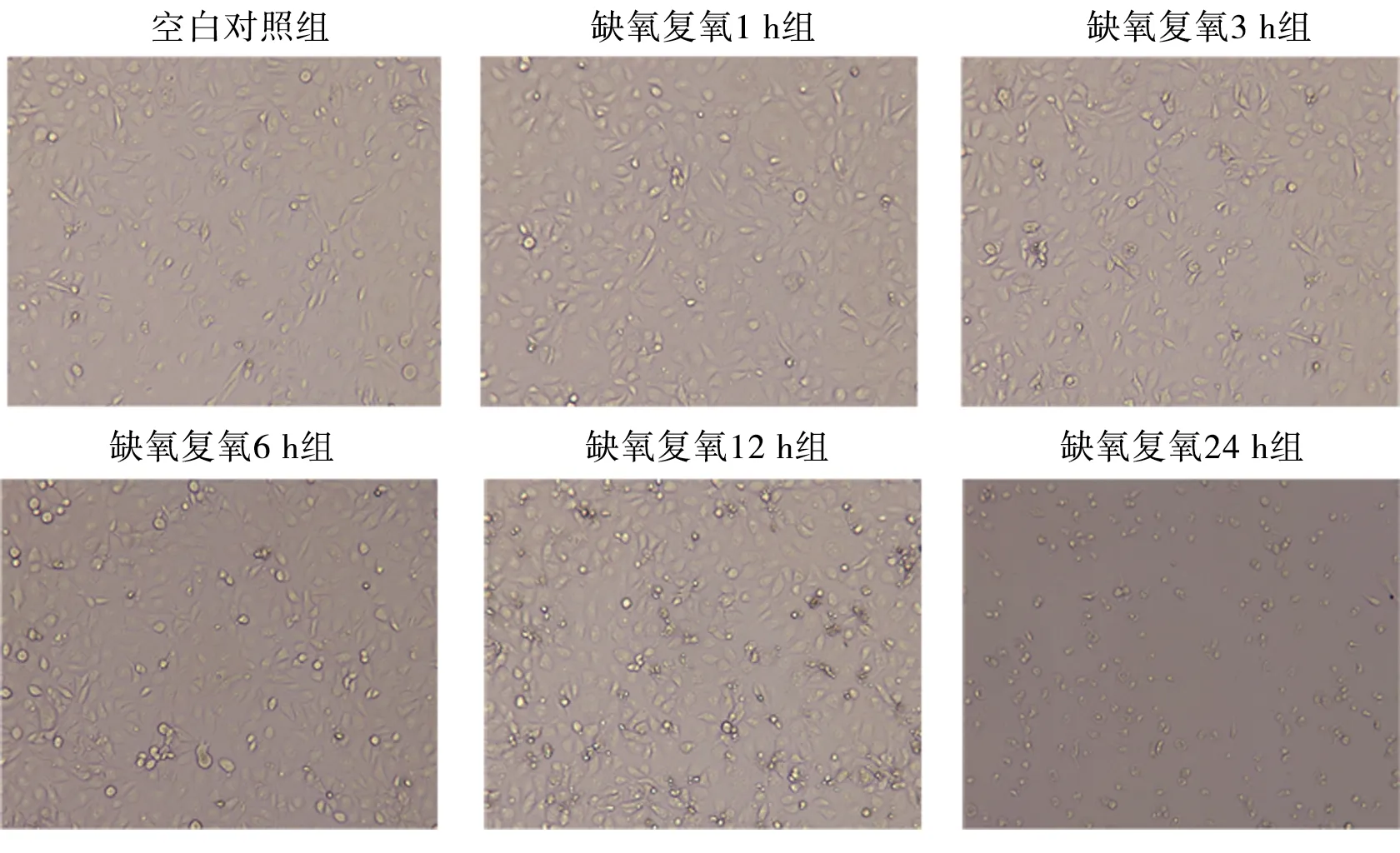
图1 缺氧后复氧对L02细胞状态的影响
2.2 不同复氧时间下L02细胞的活性 与空白对照组、缺氧复氧1 h组、缺氧复氧3 h组相比,缺氧复氧6 h、12 h、24 h组细胞活力下降(P<0.05)。缺氧复氧6 h、12 h、24 h组细胞活力依次下降(均P<0.05)。见表1。
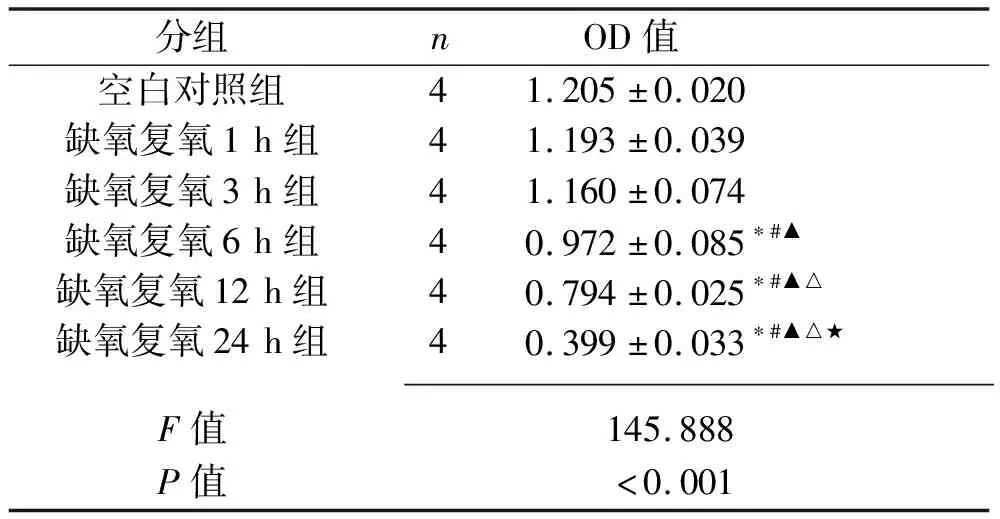
表1 不同复氧时间对L02细胞活力的影响(x±s)
2.3 不同复氧时间下L02细胞的焦亡情况 与空白对照组比较,缺氧复氧 3 h、6 h、12 h、24 h组的Caspase-1/碘化丙啶阳性率上升(P<0.05);与缺氧复氧1 h、3 h组比较,缺氧复氧6 h、12 h、24 h组的Caspase-1/碘化丙啶阳性率上升;缺氧复氧6 h、12 h、24 h组的Caspase-1/碘化丙啶阳性率依次上升(均P<0.05)。见图2和表2。
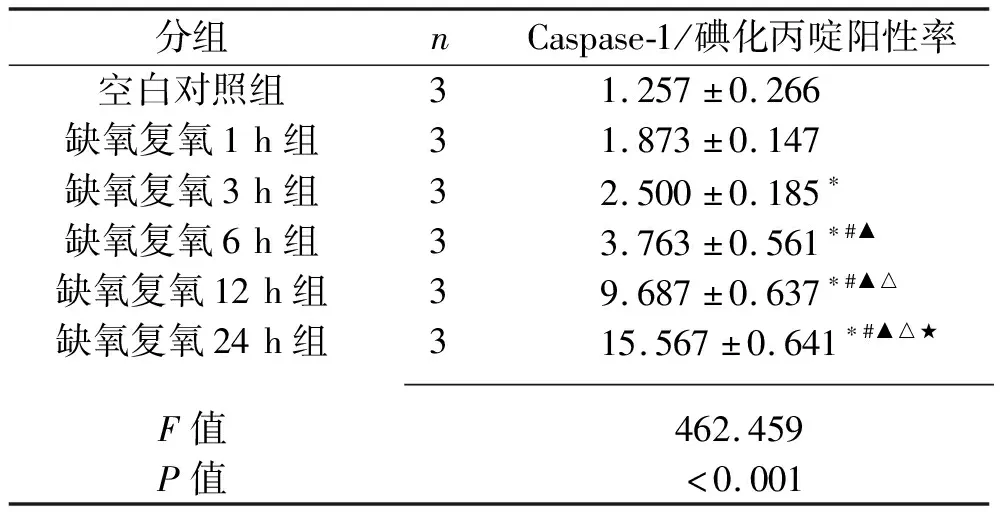
表2 不同复氧时间L02细胞Caspase-1/碘化丙啶阳性率比较(x±s,%)
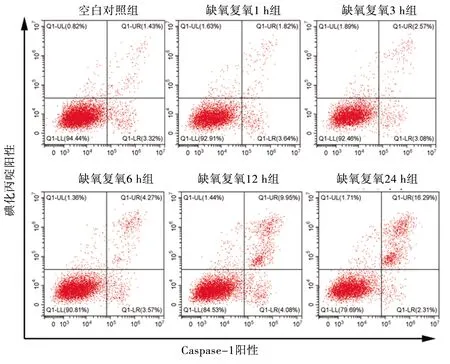
图2 缺氧复氧对L02细胞Caspase-1/碘化丙啶阳性率的影响
2.4 不同复氧时间下L02细胞AIM2蛋白及焦亡相关蛋白表达情况 与空白对照组相比,缺氧复氧3 h、6 h、12 h、24 h组的AIM2蛋白表达水平上升(均P<0.05);与缺氧复氧1 h组相比,缺氧复氧12 h、24 h组AIM2蛋白表达水平上升(均P<0.05)。与缺氧复氧3 h组相比,缺氧复氧24 h组AIM2蛋白表达水平上升(均P<0.05);与空白对照组相比,缺氧复氧 6 h、12 h、24 h组的焦亡标志物Caspase-1、IL-1β、IL-18蛋白表达水平上升(均P<0.05);与缺氧复氧1 h组相比,缺氧复氧12 h、24 h组的Caspase-1、IL-1β、IL-18蛋白表达水平上升(均P<0.05);与缺氧复氧3 h组相比,缺氧复氧12 h组的IL-1β以及缺氧复氧24 h组的Caspase-1、IL-1β、IL-18蛋白表达水平上升(均P<0.05);与缺氧复氧6 h组相比,缺氧复氧24 h组Caspase-1、IL-1β、IL-18蛋白表达水平上升(均P<0.05);与缺氧复氧12 h组相比,缺氧复氧24 h组Caspase-1、IL-1β表达水平上升(均P<0.05)。见表3和图3。
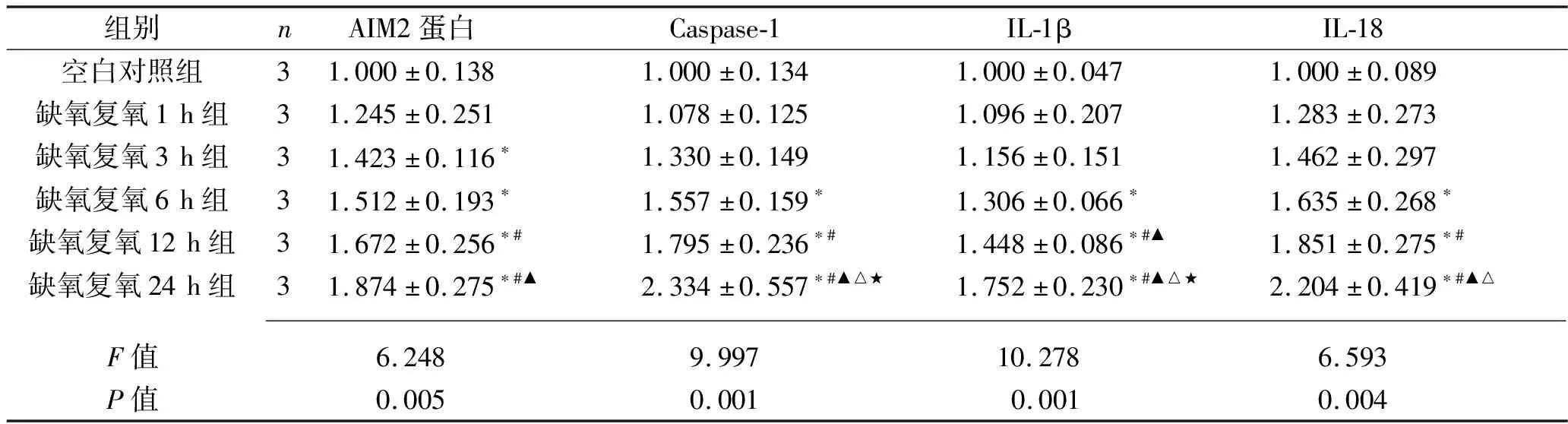
表3 不同复氧时间L02细胞AIM2、Caspase-1、IL-1β、IL-18蛋白相对表达水平比较(x±s)
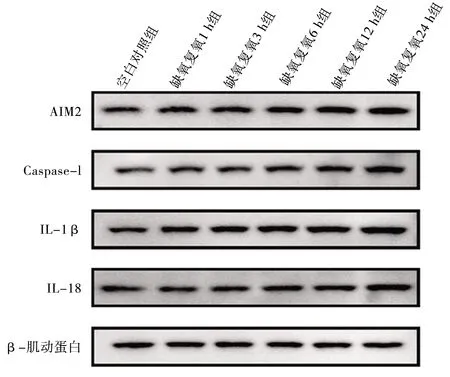
图3 缺氧复氧对L02细胞AIM2、Caspase-1、IL-1β、IL-18蛋白表达的影响
2.5 干扰AIM2基因对缺氧复氧后L02细胞活性的影响 与空白对照组相比,缺氧复氧模型组、缺氧复氧+si-NC组、缺氧复氧+si-AIM2组细胞活性下降(P<0.05);缺氧复氧模型组和缺氧复氧+si-NC组细胞活性比较,差异无统计学意义(P>0.05);而与缺氧复氧模型组、缺氧复氧+si-NC组相比,缺氧复氧+si-AIM2组细胞活性上升(P<0.05)。见表4。
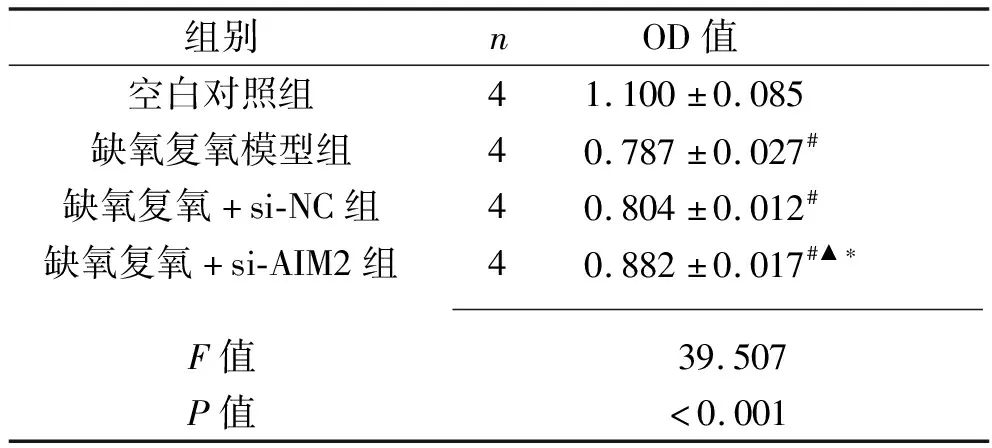
表4 4组L02细胞活性比较(x±s)
2.6 干扰AIM2基因对缺氧复氧后L02细胞焦亡 与空白对照组相比,缺氧复氧模型组、缺氧复氧+si-NC组、缺氧复氧+si-AIM2组Caspase-1/碘化丙啶阳性率升高(P<0.05);缺氧复氧模型组和缺氧复氧+si-NC组Caspase-1/碘化丙啶阳性率比较,差异无统计学意义(P>0.05);与缺氧复氧模型组、缺氧复氧+si-NC组相比,缺氧复氧+si-AIM2组的Caspase-1/碘化丙啶阳性率降低(P<0.05)。见表5和图4。
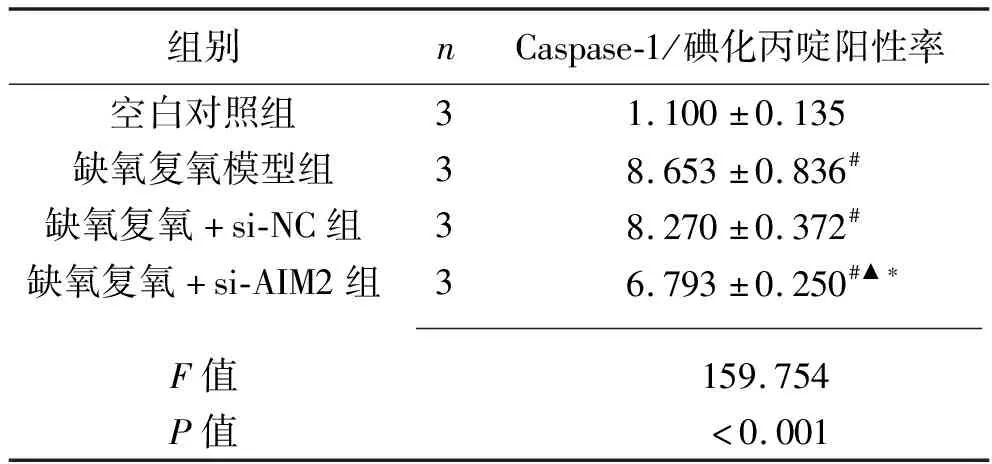
表5 4组L02细胞Caspase-1/碘化丙啶阳性率比较(x±s,%)
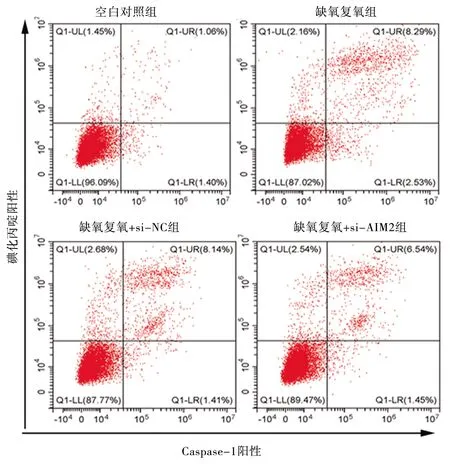
图4 干扰AIM基因2对缺氧复氧下L02细胞Caspase-1/碘化丙啶阳性率的影响
2.7 干扰AIM2基因对缺氧复氧后L02细胞Caspase-1、IL-1β、IL-18蛋白表达水平 与空白对照组相比,缺氧复氧模型组、缺氧复氧+si-NC组的Caspase-1、IL-1β、IL-18蛋白表达水平,以及缺氧复氧+si-AIM2组的Caspase-1、IL-18蛋白表达水平升高(均P<0.05);缺氧复氧模型组和缺氧复氧+si-NC组的Caspase-1、IL-1β、IL-18蛋白表达水平比较,差异无统计学意义(P>0.05);与缺氧复氧模型组相比,缺氧复氧+si-AIM2组Caspase-1、IL-1β蛋白水平降低(均P<0.05);与缺氧复氧+si-NC组相比,缺氧复氧+si-AIM2组Caspase-1、IL-1β、IL-18蛋白表达水平均下降(均P<0.05)。见图5和表6。
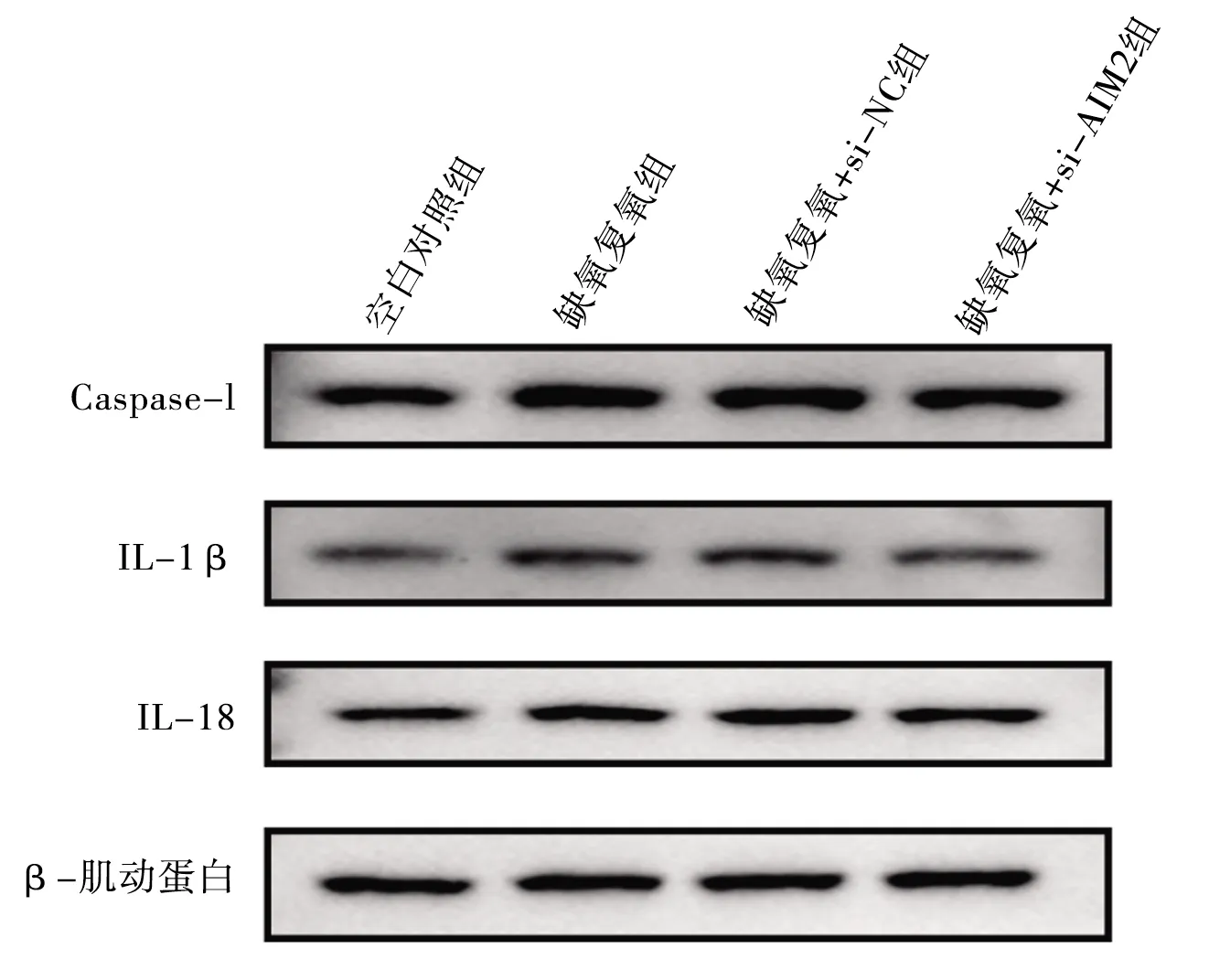
图5 干扰AIM2对缺氧复氧下L02细胞Caspase-1、IL-1β、IL-18蛋白表达的影响
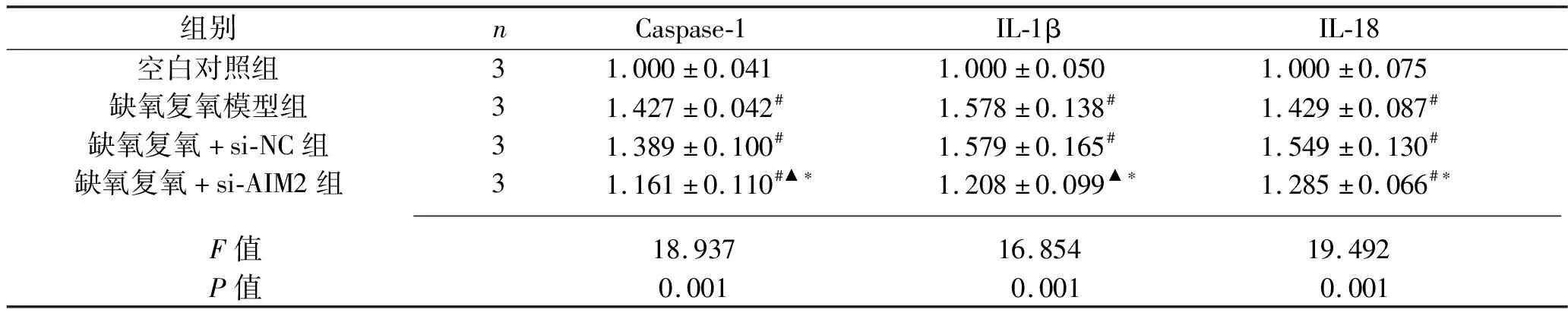
表6 4组L02细胞Caspase-1、IL-1β、IL-18蛋白相对表达水平的比较(x±s)
3 讨 论
HIRI常见于肝脏切除或肝移植手术中,目前仍缺乏有效的干预手段[22]。细胞焦亡途径可能是HIRI发生的关键机制,但在细胞层面上HIRI与细胞焦亡的关系,尚未见有研究报道。本研究通过对正常肝细胞系L02进行缺氧复氧处理以建立HIRI体外模型,发现随缺氧后复氧时间的延长,L02细胞的形态损伤逐渐加剧,漂浮细胞团块逐渐增多,CCK-8检测发现,与空白对照组、缺氧复氧1 h组、缺氧复氧3 h组相比,缺氧复氧 6 h、12 h、24 h组细胞活力下降(P<0.05),提示HIRI体外模型构建成功,可用于后续研究。
细胞焦亡是新发现的一种伴随炎症的细胞程序性裂解死亡[23]。已有研究证实,细胞焦亡依赖于胱天蛋白酶家族的激活,其中经典通路是Caspase-1激活并切割促炎性细胞因子前体以产生大量活性形式的IL-1β和IL-18[24]。此外,Caspase-1还可以切割热解成孔蛋白-消皮素D,产生消皮素D的N端和C端,其中N端可以转移至细胞膜,与细胞膜上的磷脂蛋白结合,触发细胞膜穿孔,促进炎性因子的释放从而引发细胞焦亡[25-26]。本研究参照相关文献[21],以Caspase-1和碘化丙啶双阳性率来评估细胞焦亡率,结果显示,与空白对照组比较,缺氧复氧 3 h、6 h、12 h、24 h组的Caspase-1/碘化丙啶阳性率上升;缺氧复氧6 h、12 h、24 h组的Caspase-1/碘化丙啶阳性率高于缺氧复氧1 h、3 h组,且依次升高(P<0.05)。这提示随缺氧后复氧时间的增加,Caspase-1/碘化丙啶阳性率总体呈上升趋势,表明L02细胞的细胞焦亡与缺氧后复氧有关。
AIM2是胞质双链DNA的传感器,被病原微生物双链DNA或自身免疫激活后,与细胞凋亡相关斑点样蛋白和Caspase-1前体组成炎性小体复合物,剪切炎性细胞因子IL-1β前体和IL-18前体,并引发细胞焦亡[27-28]。Gao等[19]发现,由AIM2介导的细胞焦亡在放射性肺损伤中发挥重要作用,抑制AIM2的活化可以减轻放射性肺损伤。Liang等[29]则提出,抑制AIM2活性可以改善脑缺血再灌注损伤。本研究结果显示,复氧6~24 h后,L02细胞AIM2蛋白和焦亡相关蛋白Caspase-1、IL-1β和IL-18表达水平升高,尤其是复氧24 h后,L02细胞以上蛋白的表达水平高于2个或2个以上不同复氧时间组,表明随着缺氧复氧时间的增加,细胞焦亡不断加剧,同时AIM2可能参与了细胞焦亡。
然而,缺氧复氧造成的细胞焦亡是否由AIM2介导还需要进一步验证。本研究进一步应用小干扰RNA内源性干扰AIM2基因的表达,结果显示,与缺氧复氧模型组和缺氧复氧+si-NC组比较,缺氧复氧+si-AIM2组细胞活性升高,而Caspase-1/碘化丙啶阳性率、焦亡相关蛋白Caspase-1和IL-1β的表达水平均降低(P<0.05),但缺氧复氧模型组和缺氧复氧+si-NC组之间差异并无统计学意义(P>0.05);且缺氧复氧+si-AIM2组焦亡相关蛋白IL-18的表达水平亦低于缺氧复氧+si-NC组(P<0.05)。提示缺氧复氧引起的细胞焦亡与AIM2的活化有关,AIM2可能通过Caspase-1及炎性细胞因子诱发细胞焦亡。
综上所述,AIM2参与缺氧后复氧诱导的L02细胞焦亡;干扰AIM2基因的表达可能通过抑制Caspase-1、IL-1β、IL-18的表达水平来改善缺氧后复氧引起的L02细胞焦亡。
