自体造血干细胞移植治疗多发性骨髓瘤的疗效评价及影响因素:单中心真实世界研究
2023-05-29平措卓嘎王剑利赵万红张鹏宇何爱丽
平措卓嘎,王剑利,徐 燕,赵万红,张鹏宇,刘 捷,雷 博,何爱丽
(1.西安交通大学第二附属医院血液科,陕西西安 710004;2.西藏自治区人民医院风湿血液科,西藏拉萨 850000)
多发性骨髓瘤(multiple myeloma,MM)是一种以骨髓中单克隆浆细胞异常增生为特征的血液恶性疾病,临床常表现为高钙血症、肾功能损害、贫血及多发骨骼破坏等,好发于老年人,男性较女性多见。在当今的新药治疗时代,蛋白酶体抑制剂、新型免疫调节剂、单克隆抗体等在临床上的广泛应用,以及细胞免疫治疗如CAR-T[1]的开展,很大程度上已提高了MM 的缓解率;延长了患者的总生存(OS)和无进展生存(PFS),但是该病依然不可治愈。对于年龄低于65岁且能耐受强化疗的MM 患者,多项指南[2]认为,大剂量化疗序贯自体造血干细胞移植(autologous hematopoietic stem cell transplantation,auto-HSCT)仍然是首选的一线治疗方案。本文收集既往在我院接受auto-HSCT 的MM 患者的临床资料,并以适合但未接受自体移植的同时期MM 患者为对照,分析他们的临床疗效、生存状况,以及影响疾病预后的因素,以进一步验证我中心auto-HSCT 在MM 疾病治疗中的效果,并对肿瘤的个体化治疗提供有价值的参考。
1 资料与方法
1.1 研究对象
选取西安交通大学第二附属医院2014年1月至2021年12月收治的155例初诊MM 患者作为研究对象,年龄均≤65岁;根据治疗方式不同分为auto-HSCT 组51例(32.9%)与 非auto-HSCT 组104例(67.1%)。收集临床资料进行回顾性分析。所有患者均符合“中国多发性骨髓瘤诊治指南”的诊断标准[3],并按照传统的Durie-Salmon(D-S)和国际分期系统ISS进行临床分期,根据mSMART3.0标准进行危险度分层。本研究符合医院伦理委员会的伦理学标准,所有研究对象(或其监护人)均签署书面知情同意书。
1.2 诱导化疗方案
155例患者均接受≥4周期的诱导治疗。128例(82.6%)采用含新药硼替佐米和/或来那度胺为主的方案,包括BD(硼替佐米+地塞米松)、BCD(硼替佐米+环磷酰胺+地塞米松)、PAD(硼替佐米+吡柔比星/脂质体多柔比星+地塞米松)、BTD(硼替佐米+沙利度胺+地塞米松)、VRD(硼替佐米+来那度胺+地塞米松)、RCD(来那度胺+环磷酰胺+地塞米松)等;27例(17.4%)采用传统化疗联合或不联合沙利度胺治疗,化疗方案主要包括VAD(长春瑞滨+吡柔比星+地塞米松)、CVD(环磷酰胺+长春瑞滨+地塞米松)、CVAD(环磷酰胺+长春瑞滨+吡柔比星+地塞米松)、MP(马法兰+地塞米松)等。
1.3 动员方案及造血干细胞的采集
auto-HSCT 患者采用化疗+重组人粒细胞刺激因子(G-CSF)或CXCR4拮抗剂(普乐沙福)+G-CSF动员干细胞方案。14例患者给予普乐沙福+G-CSF动员方案,具体为G-CSF 10μg/kg d1—d4+普乐沙福20 mg或0.24 mg/kg(肌酐清除率≤50 m L/min时0.16 mg/kg)皮下注射,d4;第5天开始采集干细胞。化疗动员方案多采用CE(环磷酰胺3 g/m2,依托泊苷400 mg/m2)、CED(CE+地塞米松10 mg d1-d3)或环磷酰胺3 g/m2;在中性粒细胞计数<0.5×109/L时皮下注射G-CSF 5~10μg/(kg·d),当白细胞>4×109/L时用血细胞分离仪器采集外周血造血干细胞。采集后将造血干细胞悬液与细胞冻存液(10%DMSO)按1∶1比例混合后,冷冻保存于-80℃超低温冰箱。
1.4 移植前预处理方案
所有auto-HSCT患者均接受以口服或静脉注射马法兰为基础的大剂量化疗(HDT)预处理方案。38例患者采用马法兰140~200 mg/m2;9 例采用马法兰140~200 mg/m2+硼替佐米1.3 mg/m2ih d-6、d-3、d+1、d+3;4例采用马法兰140~200 mg/m2+环磷酰胺1.2 g/m2ivd d-5、d-4方案。
1.5 干细胞回输及支持治疗
在预处理后1 d或2 d内将自体外周血造血干细胞解冻复温后回输,输注前均予以地塞米松、异丙嗪预防过敏。所有患者自体移植期间入住无菌层流病房。化疗过程中充分水化、碱化尿液,预处理方案中含有大剂量CTX 时予以美司钠预防出血性膀胱炎,常规给予保肝、营养心肌、预防感染、抑酸、止吐、维持水电解质与酸碱平衡等对症支持治疗;中性粒细胞数<0.5×109/L 时 使 用G-CSF 刺 激 造 血,PLT 数<20×109/L时输注血小板悬液,HB<70 g/L 时输注悬浮红细胞。
移植后造血重建标准:在不输注血制品情况下,连续3 d中性粒细胞绝对值≥0.5×109/L时的第1日,连续7 d PLT≥20×109/L 的第1日为造血重建时间。开始时间为干细胞输注后的第1日。
1.6 巩固及维持治疗
Auto-HSCT 组患者接受中位数5次(4~14)的诱导治疗,移植后50例(98%)患者根据临床疗效接受2~3次巩固治疗后维持或直接进入维持治疗。其中37例采用了以硼替佐米为基础的方案,主要有BCD、VRD、BD、BTD 等;3例采用了伊沙佐米为基础的IRD 方案;3例采用单独来那度胺或来那度胺+地塞米松为基础的方案;3例采用了单独沙利度胺维持治疗;3例患者采用传统的VAD、CVAD、MP等化疗方案交替维持;1例采用了DECP 方案(顺铂+依托泊苷+环磷酰胺+地塞米松)巩固治疗。其间患者如疾病复发或进展,重新开始新一轮的诱导缓解治疗。
非auto-HSCT 组104 例患者同样根据疾病状态、治疗耐受情况及经济状况等选择了类似的巩固及维持治疗方案。
1.7 疗效评价及随访
按照2016 年国际骨髓瘤工作组疗效评价标准[4],分为严格意义的完全缓解(sCR)、完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。
随访采用病历查询或电话随访,失访病例8 例(5.2%),随访终止为患者死亡或末次随访,末次随访时间为2022年2月。研究终点为患者疾病进展、患者死亡或研究结束,失访患者研究终点取末次随访时间。OS定义为自疾病诊断至任何原因死亡或随访结束,PFS定义为自疾病诊断至疾病进展或死亡或随访结束。
1.8 统计学处理
采用SPSS 22.0进行数据分析。满足正态分布的计量资料组间比较采用t检验(以中位数表示),非正态分布的计量资料组间比较采用Mann-WhitneyU检验。计数资料以率表示,组间比较采用χ2检验或Fisher确切概率法,生存分析采用Kaplan-Meier生存分析法,单因素分析采用Log-rank检验,多因素分析采用COX回归。P<0.05为差异有统计学意义。
2 结 果
2.1 患者的基本临床特征
155例MM 患 者 中 男91 例(58.7%),女64 例(41.3%),中位年龄56(29~65)岁;其中auto-HSCT组患者51 例,中位年龄53(36~64)岁,非auto-HSCT 组患者104例,中位年龄58(29~65)岁,两组患者年龄有统计学差异(P<0.01);两组患者M 蛋白、DS分期、肾功能、mSMART3.0危险度分层等临床特征情况见表1。部分患者首次就诊时未查乳酸脱氢酶(LDH)、β2微球蛋白及遗传学检测,无法进行ISS分期及mSMART 危险分层。除年龄以外,两组患者在性别、M 蛋白类型、DS分期、ISS分期、危险度分层、初诊时肾功有无异常、血细胞计数、LDH、血清β2微球蛋白、白蛋白、校正血清钙、血脂水平等方面均无统计学差异。

表1 两组MM 患者基线特征的比较Tab.1 Comparison of baseline characteristics between the two MM groups[n(%)]
2.2 移植后造血重建和并发症
51例患者共行55次自体移植(4例患者行双次自体移植),回输单个核细胞(MNC)的中位数为5.91(2.29~12.47)×108/kg,回输CD34+细胞中位数为6.12(0.75~24.73)×106/kg。移植后均获得造血重建。中性粒细胞植入中位时间为10(8~13)d,血小板植入中位时间为10(7~16)d。Auto-HSCT 组所有患者移植后均出现了Ⅳ度骨髓抑制;50例(98%)患者出现了不同程度的消化道不良反应,其中1级28例、2级19例、3级2例、4级1例,主要表现为恶心呕吐、腹泻腹胀等;29 例(56.9%)患者出现了粒缺期感染发热,主要以肺部感染及肠道感染为主,未见导管相关感染出现;10 例(19.6%)患者出现肝功能损害,其中1级9例,2级1例;9例(17.4%)患者出现口腔溃疡;2例(3.9%)患者出现抑郁状态;1例出现不全肠梗阻。在积极抗感染、保护胃黏膜、加强止吐及保肝、刺激骨髓造血、成分输血等支持治疗后均好转,未出现移植相关死亡,所有患者均未发生膀胱出血、心脏毒性、肝静脉闭塞等并发症。
2.3 疗效评价
2.3.1 Auto-HSCT 前、后临床疗效的评价 移植后3个月评估auto-HSCT 组疗效,部分患者根据实际复诊情况及随访截止时间提前或延迟评估。51例移植患者auto-HSCT前、后临床疗效见表2,移植后sCR/CR率明显提高(P=0.041),移植后有效缓解率(≥VGPR)亦有提高,但差异无统计学意义(P=0.05)。
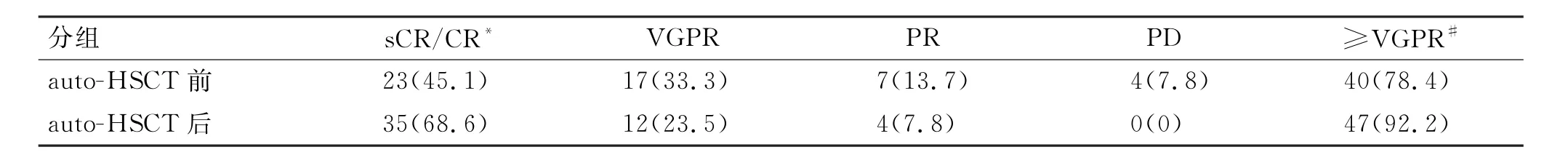
表2 auto-HSCT前、后疗效的比较Tab.2 Comparison of efficacy before and after auto-HSCT [n(%)]
2.3.2 auto-HSCT 组与非auto-HSCT 组患者最佳疗效的比较 取MM 患者随访结束时最佳疗效,比较auto-HSCT组与非auto-HSCT 组的疗效差别。auto-HSCT组51例患者与非auto-HSCT 组104例患者治疗后疗效情况见表3。两组比较,auto-HSCT 组sCR/CR率较非auto-HSCT组明显提高(P=0.001);两组患者有效缓解率(≥VGPR)比较,差异有统计学意义(P=0.001)。

表3 auto-HSCT组与非auto-HSCT组患者最佳疗效比较Tab.3 Comparison of optimal efficacy between auto-HSCT group and non-auto-HSCT group [n(%)]
2.4 生存分析
155例患者的中位随访时间35.5 个月。auto-HSCT 组51例患者中位随访时间32.5(7~84.5)个月,中位OS未达到,中位PFS 30.5个月,3年OS、PFS分别为87%和40.3%;到随访结束疾病进展24例(47.1%),死亡5 例(9.8%),分别于移植后7个月、12个月、12.5个月、24.5个月、65个月因本病相关死亡,失访1例(2%)。
非auto-HSCT 组104 例患者中位随访时间40.5(3.5~94.5)个月,中位OS 61个月,中位PFS 21个月,3年OS、PFS 分别为65.3%和33.1%;到随访结束疾病进展71 例(68.3%),死亡37 例(35.6%),1例于确诊后32个月因脑出血死亡,其余患者均因本病相关死亡。失访7例(6.7%)。
两 组OS 比 较,auto-HSCT 组OS 较 非auto-HSCT 组明显延长(P=0.004);两组PFS 比较,auto-HSCT 组PFS较非auto-HSCT 组延长,但差异无统计学意义(P=0.065,图1)。
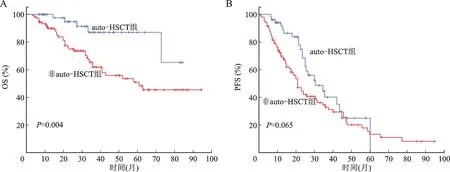
图1 auto-HSCT组与非auto-HSCT组的OS(A)、PFS(B)比较Fig.1 Comparison of OS(A)and PFS(B)between auto-HSCT group and non-auto-HSCT group
2.5 auto-HSCT组的预后因素分析
2.5.1单因素分析结果 对auto-HSCT 组患者进行预后影响因素分析,分析性别(男/女)、年龄(<55岁/≥55岁)、疾病分型(IgG/Ig A/轻链型/other)、DS分期(Ⅰ~Ⅱ期/Ⅲ期)、ISS分期(Ⅰ~Ⅱ期/Ⅲ期)、mSMART3.0危险分层(标危/高危)、初诊时血清肌酐水平(<177μmol/L/≥177μmol/L)、β2-微球蛋白(<3.5 mg/L/≥3.5 mg/L)、球蛋白(<40 g/L/≥40 g/L)、白蛋白(<35 g/L/≥35 g/L)、乳酸脱氢酶(<250 U/L/≥250 U/L)、血 清 校 正 钙(<2.75 mmol/L/≥2.75 mmol/L)、血红蛋白(<100 g/L/≥100 g/L)、血小板(<100×109/L/≥100×109/L)、白细胞(<4×109/L/≥4×109/L)、胆固醇(<5.2 mmol/L/≥5.2 mmol/L)、三酰甘油(<1.7 mmol/L/≥1.7 mmol/L)、移植前疾病状态(≥VGPR/PR 及以下)、移植后疾病状态(≥VGPR/PR 及以下)对OS、PFS的影响。结果显示,血清校正钙升高(P=0.001)、血小板减少(P=0.008)是影响OS的不良预后因素;女性(P=0.015)、血小板减少(P<0.001)、移植前疾病状态在PR 及以下(P=0.003)是影响PFS的不良预后因素。将P<0.1的变量因素进一步进行COX 多因素分析。
2.5.2COX 多因素分析结果 根据单因素结果,将性别、血清校正钙、血小板值、移植前疗效纳入COX多因素分析,结果显示,PLT 减少(HR=0.062,P=0.038)、血清校正钙升高(HR=21.35,P=0.017)是影响OS的独立预后因素,PLT 减少(HR=0.185,P=0.004)、女性(HR=3.226,P=0.008)、移植前疾病状态在PR 及以下(HR=3.474,P=0.012)是影响PFS的独立预后因素(表4)。
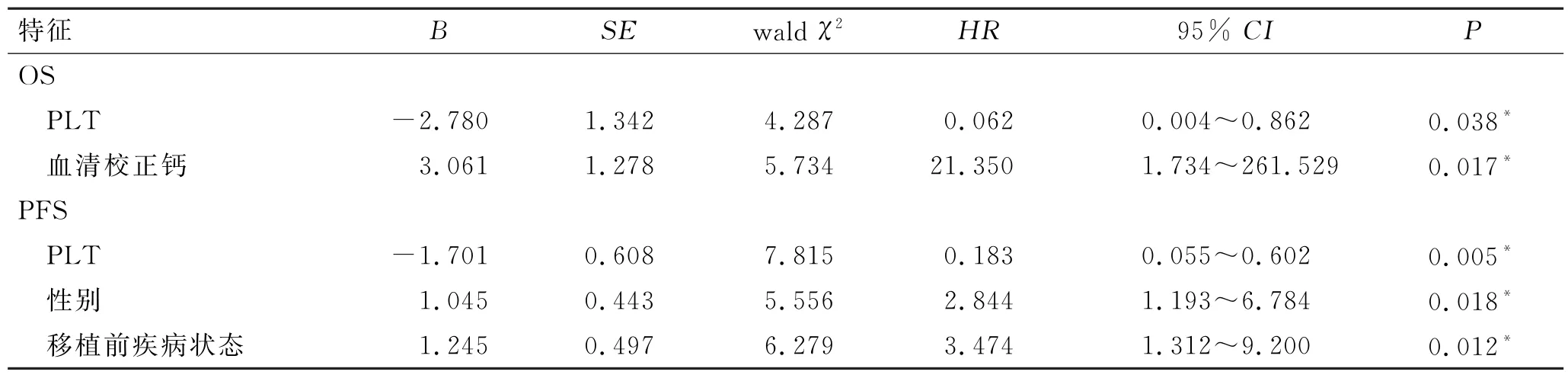
表4 auto-HSCT组影响疗效的多因素分析Tab.4 Multivariate analysis of prognosis in auto-HSCT group
3 讨 论
多发性骨髓瘤是血液系统第二常见的恶性肿瘤,传统化学药物治疗下疾病完全缓解率低、易复发、总生存时间短,严重影响患者的生活质量。因此,各种新型的免疫调节剂、蛋白酶体抑制剂、单克隆抗体等药物不断涌现,并对MM 的疗效有了一定的提高,但auto-HSCT 对MM 的治疗作用仍不容忽视。目前大量研究及相关指南均认为大剂量化疗后auto-HSCT是治疗MM 的一线标准方案[2,5]。
本研究回顾性分析了既往在我中心行auto-HSCT 的51 例MM 患 者,发 现auto-HSCT 后 疾 病sCR/CR 率较移植前明显提高;比较auto-HSCT 与非auto-HSCT 两组患者的疾病缓解率,结果显示auto-HSCT 组sCR/CR 率及有效缓解率(≥VGPR)均较非auto-HSCT 组明显提高,表明大剂量马法兰化疗序贯auto-HSCT 可显著提高适合移植MM 患者的缓解率。IFM-2009的一项随机Ⅲ期临床试验分析使用RVD 方案及RVD 联合auto-HSCT 治疗初诊MM 患者的临床疗效,结果显示联合auto-HSCT组与单纯RVD 治疗组的CR 率分别为59%vs.48%(P=0.03),auto-HSCT 能提高MM 患者的缓解率[6]。王超雨等[7]对56 例MM 患者auto-HSCT后的疗效分析结果显示移植后CR率达78.6%,有效缓解率达94.7%。本研究与以上报道结果相似,说明auto-HSCT能够更好地提高MM 患者的疾病缓解率。
许多研究提示,移植前、后疾病缓解程度对MM患者的生存有影响,达到深层次缓解可延长患者的生存时间。AGGARWAL 等[8]分析了141 例接受auto-HSCT 的MM 患者的疾病缓解状况及OS、PFS,发现移植前达VGPR 及以上与未达VGPR 患者的中位PFS分别为69.8个月与58.3个月,差异有统计学意义(P=0.021);移植后达VGPR 及以上与未达VGPR 患者的中位OS分别是138个月与72.9个月,中位PFS分别为83个月与19.2个月,两组差异均有统计学意义(P<0.001)。说明移植前、后有效缓解率的提高均能延长患者的OS、PFS。一项荟萃分析评估了auto-HSCT 后反应深度对MM 患者长期预后的影响,发现在HDT+ASCT 后获得CR,进展/死亡风险降低38%,死亡风险降低41%,同样auto-HSCT前、后疾病达CR与<CR或达CR+VGPR与<VGPR相比,更深的缓解能延长患者的PFS、OS[9]。本研究分析了移植前、后≥VGPR 与<VGPR 患者的OS、PFS差别,发现移植前≥VGPR 与<VGPR 患者的中位PFS分别为34.5个月与18个月,两组比较差异有统计学意义(P=0.003);进一步多因素分析发现,移植前疾病状态为PR 及以下是影响MM 患者PFS的独立危险因素。与上述研究结果相似,说明移植前疾病更深的缓解可延长患者的PFS。随着随访时间的延长,可以继续观察移植后疗效对患者OS、PFS的影响。
虽然目前许多新型药物的出现,使MM 患者的生存时间有了一定的延长,但许多研究仍表明auto-HSCT 能进一步改善MM 患者的疗效。因此,本研究分析了我中心同一时期MM 患者接受auto-HSCT与适合但未进行auto-HSCT 对生存的影响,发现auto-HSCT 组与非auto-HSCT 组的中位OS为未达到vs.61个月(P=0.004),差异有统计学意义;中位PFS为30.5个月vs.21个月,auto-HSCT 组的中位PFS较非auto-HSCT 组延长9.5个月,但差异无统计学意义(P=0.065)。表明auto-HSCT可改善MM 患者的OS,同时PFS也有延长。PFS差异无统计学意义,考虑可能与auto-HSCT组中有6例(11.8%)患者移植前疾病进展后再行挽救移植、样本量少、随访时间短等因素有关。国内汪娟等[10]回顾性分析了接受auto-HSCT 的27例患者与未移植的28例患者的疾病缓解率及OS、PFS的差别,发现auto-HSCT组与未移植组的中位OS分别为未达vs.60个月(P>0.05),中位PFS分别为未达vs.29个月(P<0.05),表明auto-HSCT 不仅能延长MM 患者的PFS,亦可能对延长OS有益。这些研究都说明即使进入新药时代,比起单纯药物治疗auto-HSCT 仍能明显延长适合移植患者的生存期。
对于一种肿瘤性疾病来说,它的预后不仅仅受治疗方案一种因素的影响,也会受到患者性别、年龄、肿瘤分期、疾病缓解状态等多种因素的影响,因此本研究对接受auto-HSCT 的患者进行了预后影响因素分析,并根据单因素分析结果进一步行多因素分析,明确不同疾病因素对预后的影响。结果发现,初诊时PLT 减少、血清校正钙升高是影响OS 的独立预后因素,PLT 减少、女性、移植前疾病状态在PR 及以下是影响PFS的独立预后因素。既往很多研究结果提示MM 患者不同性别的OS、PFS无差异,但也有研究指出性别影响患者的生存率。如BOYD 等[12]的一项纳入1 969例患者的Ⅲ期临床试验中分析了MM 患者的性别差异,女性中t(4;14)、t(14;16)和1q扩增等高危遗传学突变发生率高,这可能影响患者的临床疗效,并发现男、女患者的中位OS为49.9个月vs.44.8个月(P=0.02),中位PFS为19.9个月vs.16 个月(P=0.105),可看出男性的OS 与PFS时间较女性更长。本研究结果显示,auto-HSCT组男性的OS及PFS均优于女性,且PFS差异有统计学意义,进一步分析发现数据中男性高危14 例(42%),女性高危9例(50%),女性患者中含有高危遗传学突变的比例较高,不排除这对患者的生存时间有影响。另外本研究样本量少,可能导致统计偏倚等,往后随着样本量扩大,可进一步了解不同性别间遗传学、年龄、合并症的差别,从而进一步分析患者的生存差异。
MM 患者多发的骨质破坏导致血钙增高,而增多的血钙沉积在肾脏,会引起肾脏的不可逆性损害,因此,多项研究证明,血清钙升高是影响MM 患者预后的独立危险因素[13]。谢艳梅等[14]分析了血清校正钙与LDH 对MM 患者预后的影响,发现高校正血清钙组的累积OS 率低于非高钙血症组,3 年累积OS率分别为(53.0±10.5)%vs.(74.6±6.6)%(P=0.016)。本研究结果也提示,auto-HSCT 组血清校正钙升高MM 患者的OS及PFS较未升高患者低,且OS差异有统计学意义(P=0.001)。血小板[11]是止血及血栓形成的重要因素,目前有许多研究发现PLT 与肿瘤密切相关。在MM 中,PLT 反应浆细胞浸润骨髓的严重程度,PLT 减少提示MM 更具侵袭性[15]。KYLE等[16]在一项综述中多因素分析结果发现,PLT 减少是影响MM 患者生存的预后不良因素。本研究同样发现PLT 减少是影响MM 患者OS、PFS的独立预后因素,这与以上研究结果相同,但本研究中两组的样本量差异大,今后扩大样本量可继续观察PLT 计数对MM 患者生存的影响。
综上,本研究发现MM 患者接受auto-HSCT后,疾病的缓解率较移植前明显提高;auto-HSCT 组患者的临床缓解率较未移植组明显升高,并且患者的OS、PFS也得到相应延长。但本研究为单中心研究,病例数较少,且两组患者存在年龄差异可能对结果产生影响,今后随着样本量的扩大,将进一步分析验证MM 患者接受auto-HSCT 的临床疗效及影响预后因素。
