B淋巴细胞缺乏影响小鼠心脏结构及心肌免疫细胞组成
2023-05-29刘成峰王军奎王西强李飞鹏
齐 婷,刘成峰,石 爽,王军奎,王西强,李飞鹏
(1.陕西省人民医院心血管内一科,陕西西安 710068;2.华阴市人民医院,陕西渭南 714200)
B淋巴细胞是原始小鼠心脏中最常见的免疫细胞之一[1]。既往研究表明,在急慢性心肌损伤中,调节心肌B 淋巴细胞可以发挥心脏保护的作用[2-4]。研究显示,在正常生理状态下,B 淋巴细胞在初级和次级淋巴器官之间循环,直到结合其同源抗原[5-6]。并且有研究显示,小鼠心脏内存在大量B淋巴细胞。然而,心脏内B 淋巴细胞的基本生物学特点及其发育和转运过程尚不清楚。由于B淋巴细胞在心肌损伤中发挥着重要作用[4],因此,阐明心脏内B淋巴细胞在初始状态下的生物学特性有助于探讨B 淋巴细胞在心脏疾病发生发展中的作用,并评估靶向B 淋巴细胞干预在心脏疾病治疗中的潜力。本研究拟使用B 淋巴细胞缺失小鼠,探讨B 淋巴细胞缺失对心脏发育过程中心脏结构、功能及心肌免疫细胞组成的影响。
1 材料与方法
1.1 实验动物
选用10~14 周龄雌性C57BL/B6J 野生型(WT)小鼠及B6.129S2-Ighmtm1Cgn/J(μMT)小鼠进行实验,μMT 小鼠为纯和的B 淋巴细胞缺陷小鼠。小鼠均饲养于无病原体环境中,按照指南自由给予食物及水。所有实验均根据西安交通大学医学院动物委员会批准的动物协议进行。
1.2 心脏超声检查
超声检查使用Vevo 770 超声系统(VisualSonics Inc,Toronto,Ontario,Canada)。腹腔注射0.005 mL/g的20 g/L tribromoethanol麻醉小鼠,根据超声检查时间,可每隔30 min以初始剂量的1/5作为维持剂量。使用化学脱毛剂从前胸脱掉毛发,将小鼠以左侧卧位放置在保暖垫上,以维持体温(37℃),用直肠温度计监测体温。胸口部位涂抹适量超声凝胶,注意保持适当接触的同时,避免过度按压胸部。通过手持操作超声换能器获得二维多普勒图像。超声检测左心室质量(LVM)、左心室射血分数(LVEF)。
1.3 形态学和组织学观察
提前准备好小鼠CO2处死箱,控制CO2流量约2 L/min。将小鼠放入CO2处死箱处死小鼠。处死小鼠后,取心脏称重,确定心脏质量与胫骨长度的比值(HW/TB)。心脏经过处理,使用麦胚凝集素(WGA)染色心肌细胞细胞膜,用Zeiss共聚焦显微镜观察荧光,用Zeiss Axiovision软件分析和测量数字图像,以确定心肌细胞横截面积。
1.4 流式细胞术分析
处死小鼠后,取心脏使用10 m L HBSS溶液从右心室底部冲洗心脏。将心脏放入盛有Hank's平衡盐溶液(HBSS)的培养皿(直径100 mm)中,挤出心脏中的残留血液。去除心脏表面液体,称量左心室,使用刀片切碎左心室,均为2 min。之后,将左心室块置于含有3 m L HBSS的15 m L离心管中,并换洗1次。向盛有标本的各离心管中分别加入胶原酶(450 U/mL)、透明质酸酶(60 U/m L)、DNAseⅠ(60 U/m L)。将所有标本置于37℃震荡器中恒温、匀速消化45 min后,加入6 m L HBB 终止消化。采用40μm 滤膜过滤,将滤液转入新的15 mL离心管,4℃、400 r/min离心7 min。弃上清,每个样品加入1 m L ACK lysis buffer,混匀后于冰上静置12 min,加入5 m L FACS buffer,4℃、400 r/min再次离心7 min。弃上清,加入45μL FACS buffer,吸取1/3离心液转入1.5 mL离心管中,加入目标抗体混合物,使用美国BD LSRⅡ流式细胞仪进行实验检测。流式细胞术设门策略见图1。
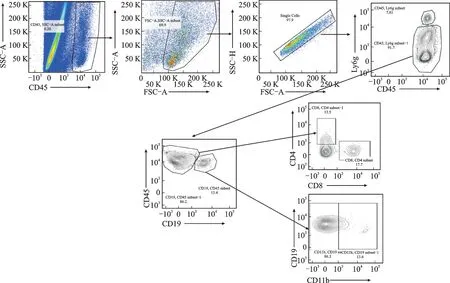
图1 流式细胞术设门策略Fig.1 Gating strategy for the flow cytometric analysis
1.5 RNA提取及RNA测序分析
RNA 提取使用Trizol Plus RNA Purification Kit(catalog number:12183-555)及Pure Link DNase(Cat.No.12185-010))。简要步骤如下:将心肌细胞在捣碎机捣碎,放于EP 管里。每孔加入500μL Trizol,使用移液管混匀后,转移到1.5 m L EP管中。加入100μL 氯仿,用手用力摇动15 s。室温孵育2~3 min。4℃下12 000×g 离心15 min。制备Pure Link DNase混合液。将200μL 无色上层液体转移到新鲜的无Rnase管中。每个样品加入200μL 700 m L/L乙醇并充分混匀。将400μL 样品转移到带有收集管的离心管中。12 000×g在室温下离心15 min,丢弃过滤液,将离心管重新放于收集管中。加350μL洗涤缓冲液Ⅰ,12 000×g在室温下离心15 s丢弃过滤液,将离心管重新放于收集管中。将80μL Pure-Link DNase混合物直接添加到Spin Cartridge膜表面。室温下孵育15 min。添加350μL 洗涤缓冲 液Ⅰ,12 000×g在室温下离心15 s丢弃过滤液,将离心管重新放置到收集管中。加入500μL洗涤缓冲液Ⅱ,12 000×g在室温下离心15 s。12 000×g室温下离心1 min。加入30μL 无Rnase水,室温孵育1 min。13 000×g室温下离心2 min,随后收集RNA。将RNA 进行测序分析[7]。
1.6 统计学分析
使用Graph Pad prism 8.0(Graphpad software,Inc.,Cary,NC)进行统计分析和绘图。变量采用均数±标准误表示,两组间比较采用Student’st检验,两组以上比较采用One-way Anova检验。P<0.05认为差异具有统计学意义。
2 结 果
2.1 B淋巴细胞缺失改善心脏结构及功能
与WT 小鼠相比,μMT 小鼠HW/BW 及左心室质量明显减低(P<0.05,图2A、图2B);WGA 染色结果同样显示,与WT 小鼠相比,μMT 小鼠心脏的心肌细胞横截面积明显减小(P<0.001,图2C、图2D)。心脏超声结果提示,与WT 小鼠相比,μMT 小鼠的左心室射血分数明显上升(P<0.05,图2E)。为了进一步验证上述结果,我们使用m RNA 测序的方法从基因水平验证上述发现,结果显示,WT 小鼠及μMT 小鼠在m RNA 水平上明显不同(图3A、图3B)。GO 富集分析显示,WT 小鼠及μMT 小鼠的差异基因主要富集在心脏发育上(图4)。KEGG 富集分析显示,WT 小鼠及μMT 小鼠的差异基因富集在肥厚性心肌病信号通路上(图5)。

图2 WT小鼠与μMT小鼠心脏的结构及功能改变Fig.2 Structural and functional changes of the heart in WT andμMT mice

图3 WT与μMT小鼠心肌细胞基因表达变化Fig.3 Gene expression changes in cardiomyocytes of WT andμMT mice
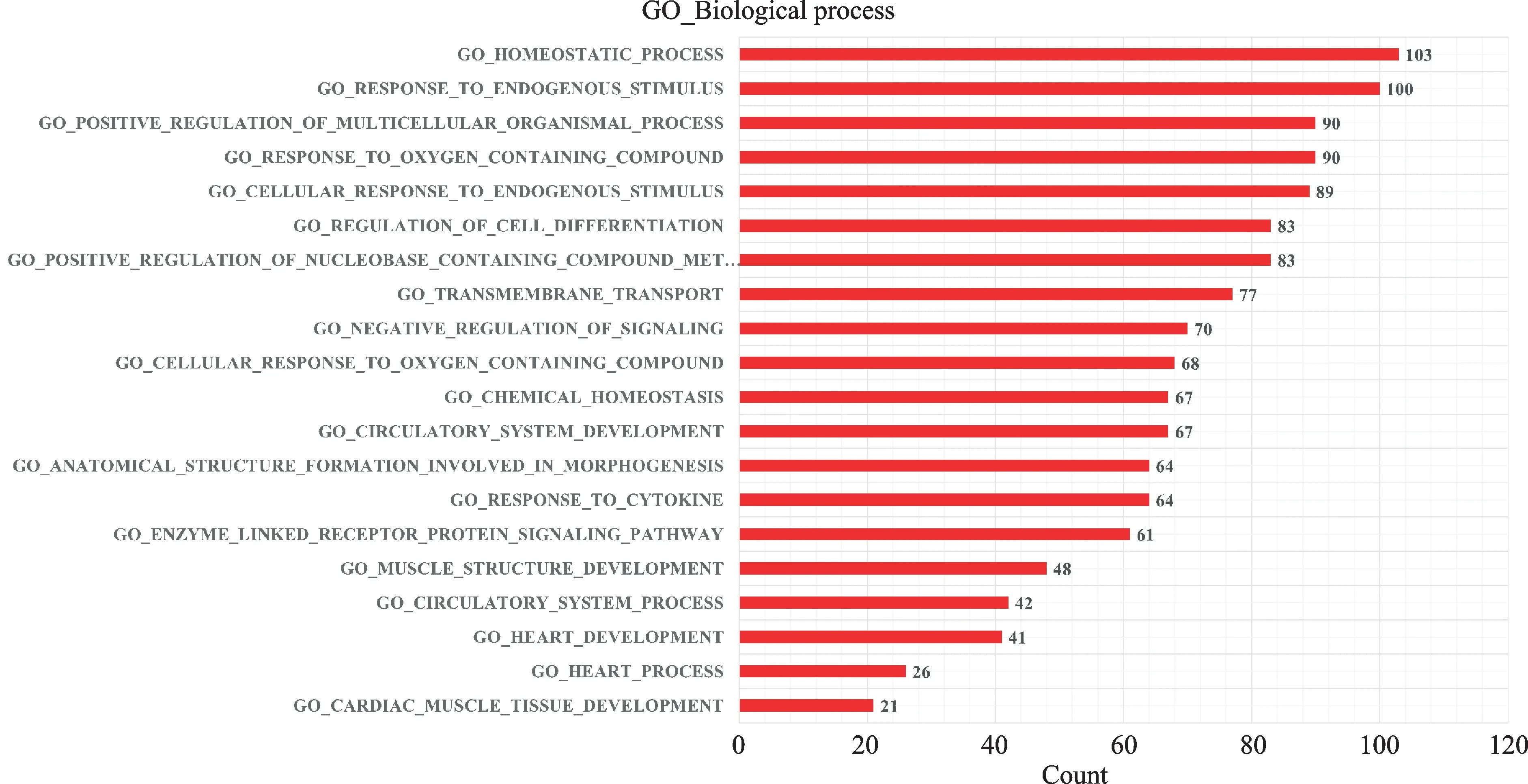
图4 心肌细胞差异基因GO 分析Fig.4 Gene Ontology(GO)analysis
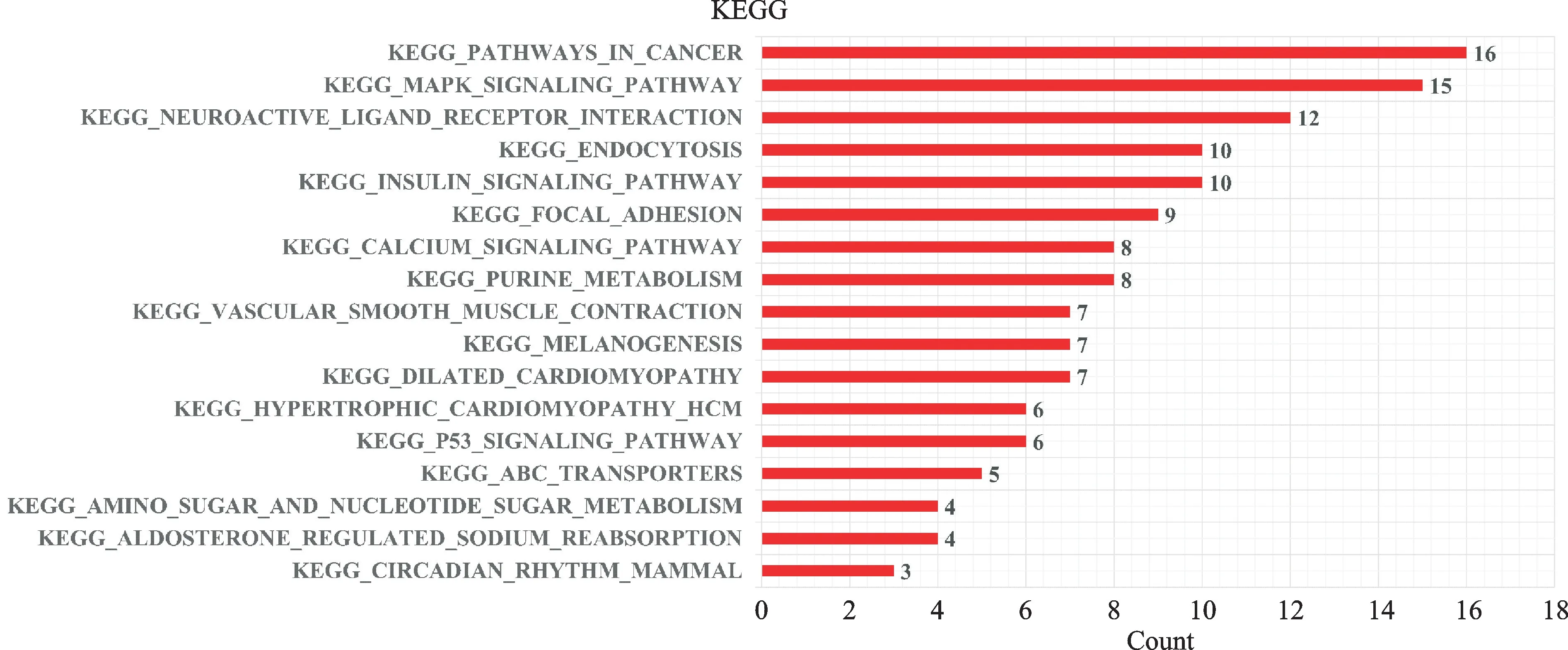
图5 心肌细胞差异基因KEGG 富集分析Fig.5 KEGG pathway enrichment analysis
2.2 B淋巴细胞缺失改变心脏免疫细胞组成
流式细胞术结果显示,与WT 小鼠相比,μMT 小鼠心肌具有更少的Ly6g+的中性粒细胞(P<0.001,图6A、图6B)、CD4+阳 性T 淋 巴 细 胞(P<0.01,图6C、图6D)及CD8+T 淋巴细胞(P<0.05,图6C、图6E)。
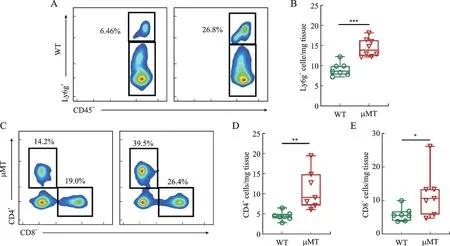
图6 WT小鼠与μMT小鼠心肌免疫细胞的改变Fig.6 Changes ofcardiac immune cells in WT andμMT mice
3 讨 论
20世 纪60 年 代,GOWANS 和KNIGHT 进 行了B淋巴细胞再循环的经典研究[5]。此后,免疫学家认为,B淋巴细胞在初级淋巴器官和次级淋巴器官之间不断循环,而不会在周围组织中堆积[6]。然而,近期研究发现,原始心脏中存在一个相对较大的B淋巴细胞池[8],而且B 淋巴细胞亚群与心肌细胞微血管内皮密切接触,并在通过心脏时在心肌细胞停留[9]。但是,关于心脏内B 淋巴细胞的基本生物学特点及其发育和转运过程尚不清楚。本研究结果显示,B淋巴细胞调节心肌细胞免疫细胞的组成,降低左心室质量,并增加心肌收缩力,揭示了循环B淋巴细胞与心肌细胞的生物学关系,对免疫细胞只有在外渗和进入实质后才能在组织稳态中发挥作用的观点提出了挑战。
本研究结果显示,与WT 小鼠相比,μMT 小鼠心肌细胞内的CD4+细胞及CD8+T 细胞明显减少。这一结果既往文献也有报道,认为B 细胞在组织损伤的情况下调节T 淋巴细胞的运输[8]。此外,本研究发现,与WT 小鼠相比,μMT 小鼠具有更小的心室质量、更小的心肌细胞横截面积和更高的左心室射血分数。而WT 小鼠与μMT 小鼠差异基因主要富集在心脏发育及肥厚型心肌病的富集通路上,揭示了B淋巴细胞在心脏生长发育中的重要作用。研究显示,心脏B淋巴细胞趋化因子信号通路上调并表达多种细胞因子,如TGF-β1。有研究认为,B淋巴细胞敲除后对心肌质量的影响可能是由于淋巴细胞和心肌细胞之间间接的旁分泌所致[9]。
现有证据表明,心肌损伤可触发B 淋巴细胞的聚集。YAN 等[1]首先报道了小鼠缺血损伤后心肌免疫细胞的动态变化,结果显示B 淋巴细胞在心肌梗死后第1天显著增加,在损伤后第7天达到高峰,即使在心肌梗死后14 d,B 淋巴细胞水平仍然很高。HORCHMAN 等[4]发现心肌梗死后心外膜脂肪组织中B淋巴细胞增加。HEINRICHS等[10]研究了B淋巴细胞向受损心肌募集的机制,发现CXCL13-CXCR5轴可能是心肌梗死后B淋巴细胞在心脏聚集的关键驱动因素。虽然B淋巴细胞和心脏损伤的大部分数据是通过缺血性损伤模型获得的,但在白喉毒素(Rosa26-DTMlc2v-Cre)诱导的心脏损伤、基因缺陷心肌损伤模型[7]和压力诱导的心肌损伤模型[11]中均观察到了心肌B 淋巴细胞数量的增加,这表明心脏细胞损伤都可能触发B淋巴细胞在心脏中的聚集。
本研究证实并扩展了既往报道的心肌B 淋巴细胞研究结果,揭示了B 淋巴细胞缺失改变心肌免疫细胞的组成、降低左心室质量并增加心肌收缩力的作用,揭示了循环B 淋巴细胞与心肌细胞生物学之间的关系。但是,本研究仅为现象观察研究,未对B 淋巴细胞敲除后对心脏结构、功能及心肌免疫细胞组成影响的潜在机制进行探讨,其发生机制需要进一步研究。
