筛选鉴定CD44v9特异性结合肽并用于胃癌检测的研究
2023-05-29刘亚萍和水祥
张 丹,冯 云,刘亚萍,赵 倩,黄 晋,和水祥
(1.西安交通大学第一附属医院消化内科,陕西西安 710061;2.陕西科技大学电子信息与人工智能学院光电系,陕西西安 710021)
肿瘤的早期诊断是目前肿瘤研究的重要方向。分子影像通过对活体的生物学过程在细胞和分子水平进行的描述和测量实现疾病的早期筛查[1]。随着各种影像学技术的发展,目前分子影像学诊断的关键是选择合适的靶分子及获得针对靶分子的特异性亲和探针。CD44是目前已明确的胃癌标志物,尤其是可变型外显子编码区CD44v,相对CD44固有型外显子编码区CD44s,具备更高的肿瘤特异性。CD44v中,CD44v6靶向药物开发较多,部分已进入临床试验。而CD44v9作为CD44家族中高特异性结构域,尚缺乏相应的探针开发。本团队致力于胃癌多肽探针的开发,曾经使用噬菌体多肽展示技术对CD44s、CD44v6进行筛选并获取多肽探针,发现单一探针在信号强度、灵敏性、特异性方面尚存在较大的提升空间。因而,针对高特异性肿瘤标志物的探针,对加强肿瘤灶信号、提升早癌检出率有重要意义。本研究使用CD44v9 为靶点,开发并验证其特异性配体多肽序列。
1 材料与方法
1.1 细胞系及主要试剂
人胃癌SGC-7901细胞购自中国科学院上海细胞库,人胚肾HEK-293 细胞购自美国菌种保藏中心。CD44v9外显子编码区由上海强耀生物科技有限公司合成,噬菌体展示12肽库购自美国New England Biolabs公司。
1.2 噬菌体展示肽库筛选
1.2.1筛选 分别将10 g/L BSA 或100μg/m L CD44v9溶于8.4 g/L Na HCO3(p H 8.4),加入至酶标板,4℃过夜。加入30 g/L BSA 封阻满孔,孵育2 h。使用TBS(10 mmol/L Tris,p H 7.4)将10μL噬菌体展示肽库(New England Biolabs,US)稀释至100μL,加入10 g/L BSA孔内,37℃摇动孵育2 h。将10 g/L BSA孔内未结合的噬菌体上清加入100μg/mL CD44v9孔内,37℃摇动孵育2 h。后去除未结合噬菌体上清,0.1%TBST(Tween-20 1 g/L)洗板10次。后将100μL洗脱缓冲(0.2 mol/L Glycine-HCl p H 2.2,1 mg/m L BSA)加入CD44v9孔内作用15 min,取出洗脱液,使用15μL 中和缓冲液(1 mol/L Tris-HCl p H 9.1)中和。
1.2.2扩增滴定 复苏E.coliER2738,培养至对数期,取1μL后将上一步所获取噬菌体洗脱液进行滴定。将洗脱液使用LB 液体培养基分别稀释至10-6、10-7、10-8、10-9、10-10稀释度,分别依次与菌液、3 m L 顶层琼脂糖迅速混匀,后加至LB/IPTG/Xgal固体培养基平板。37℃培养,次日选择含有102数量级蓝色噬菌斑的平板进行计数。计算回收率:回收率=回收噬菌体/投入噬菌体。
将1.2.1步骤中所获得全部噬菌体洗脱液加入20 m LE.coliER2738对数期菌液中,225 r/min振荡培养,37℃、4.5 h,培养物使用4℃10 000 r/min离心10 min,使用PEG/NaCl 4℃过夜沉淀噬菌体,4℃10 000 r/min 离心15 min,弃上清,沉淀使用TBS重悬,重复上述沉淀过程,最终沉淀使用200μL TBS 0.2 g/L NaN3噬菌体保存液溶解,为次级库,对次级库按上述方法再进行滴定。
1.2.3后续筛选 重复步骤1.2.1,进行后续3轮淘选,其中所加噬菌体文库为上一轮所获得次级库,洗涤液中Tween浓度增加至5 g/L。每轮淘选结束按照1.2.2方法进行滴定及扩增至次级库。对第4轮洗脱物不扩增,仅进行滴定。
1.3 测序
1.3.1噬菌体单克隆化 从第4轮筛选滴定的平板中选择102水平平板,随机挑取30个蓝斑,即噬菌体单克隆。将E.coliER2738菌液在37℃、225 r/min条件下振荡培养4.5 h至对数期。将每个噬菌体单克隆加入1 m L 上述菌液中,继续按上述条件培养6 h,将培养物离心,收集上清为噬菌体单克隆贮液。
1.3.2噬菌体DNA 提取及测序 将500μL噬菌体单克隆贮液加入200μL PEG/NaCl,4℃沉淀噬菌体10 min,高速离心后去除上清。将沉淀使用100μL碘化物缓冲液(10 mmol/L Tris,1 mmol/L EDTA,4 mmol/L NaI)重悬,再加入250μL 无水乙醇常 温沉淀DNA。混合物高速离心10 min,去除上清,用700 m L/L的乙醇漂洗沉淀,短时真空干燥。最终将沉淀使用TE 缓冲液(10 mmol/L Tris,1 mmol/L EDTA)30μL重悬。
取上述噬菌体单克隆DNA 贮液,送上海生工生物工程公司,使用-96gⅢ测序引物(5'-HOCCCTCATAGTTAGCGTAACG-3')行全自动测序。根据噬菌体多肽展示文库附带使用手册对噬菌体测序结果进行读取及翻译。
1.4 ELISA鉴定候选噬菌体
将噬菌体单克隆进行常规扩增滴定。分别将10 g/L BSA 或100μg/m L CD44v9 溶 于8.4 g/L Na HCO3(p H 8.4),加入至酶标板,4℃过夜。加入30 g/L BSA 封阻满孔,孵育2 h。每组设置3个复孔。每组分别加入1011待测克隆或对照克隆,37℃孵育1 h,0.5%TBST 洗板6次。加入封阻液稀释的山羊抗M13噬菌体衣壳蛋白多克隆抗体(1∶1 000,Santa Cruz,US),37℃孵育1 h,常规洗涤后再加入封阻液稀释的HRP 标记兔抗山羊抗体(1∶5 000,Bioss,CN),37℃孵育1 h,常规洗涤。TMB 显色试剂盒显色,使用酶标仪在波长450 nm 处读取吸光度。计算选择力,即CD44v9孔A值/BSA 孔A值。
1.5 多肽合成
将选择的多肽序列,连同乱序对照序列,由多肽合成仪合成(上海强耀生物技术公司),氮端标记罗丹明或生物素。纯度95%以上,合成产物由高分液相色谱鉴定。
1.6 细胞免疫荧光
在前期工作中,已验证人胚肾HEK-293细胞仅表达野生型CD44s,不表达CD44v[2],并构建CD44v3-v10重组质粒并验证在HEK-293细胞中过表达[3]。重组CD44v 质粒及空载质粒使用脂质体(Invitrogen,US)转染至HEK-293细胞。制备细胞爬片,去除培养基,PBS洗涤3次,加入40 g/L 多聚甲醛固定液,于4℃固定15 min,常规洗涤。30 g/L BSA 37℃封闭30 min,洗涤后加入封闭液稀释的FITC标记待测多肽及对照多肽(10μmol/L),37℃孵育10 min,PBS洗涤,加入DAPI染核5 min,洗涤后甘油封片,荧光显微镜拍照。
1.7 免疫组化检测探针与人胃癌组织结合
人胃癌组织芯片购自上海芯超生物科技有限公司,芯片包含23例首诊胃癌组织及相应的癌旁非癌组织。术前未进行过放化疗、生物治疗等肿瘤相关治疗。置组织芯片于烘箱60℃烘烤20 min,后浸泡于二甲苯中20 min,梯度乙醇水化。置于TE 缓冲液(p H 9.0)于微波炉内加热行抗原修复。3%H2O2去除内源性过氧化物酶活性。5%FBS 37℃封闭1 h。实验组滴加生物素标记多肽探针(10μmol/L),对照组滴加封闭液稀释的小鼠抗人CD44单克隆抗体(1∶100,Santa Cruz,US),后续以生物素标记山羊抗小鼠抗体(1∶500,Bioss,CN)。所有芯片滴加封闭液稀释的HRP标记链霉亲和素(1∶200),37℃孵育1 h。DAB试剂盒显色,苏木素复染细胞核,梯度乙醇脱水,二甲苯透明,中性树胶封片。显微镜下观察切片,统计染色得分,具体方法如下:着色细胞占总细胞比例0、0~10%、10%~50%、50%~80%、80%以上分别记0、1、2、3 分;着色强度记为1 分(浅着色)、2分(中等着色)及3分(强着色);将着色细胞数量比例得分与着色强度得分相乘所得即为染色得分。一个标本中任选5个高倍视野进行统计,最终该标本染色得分为5个分数均值。
1.8统计学处理
实验结果采用SPSS 19.0(SPSS,US)进行统计分析。计量数据表示为均数±标准差,计量数据组间差异比较采用t检验,变量间关联采用Perason相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 噬菌体展示肽库筛选
为了筛选与CD44v9结构域编码区结合的特异性多肽配体。CD44v9 外显子编码区纯化蛋白被包被至固相表面(酶标板)作为筛选靶点。1011数量级的噬菌体文库,包含109级别复杂度,首先与包被BSA 的阴性筛选孔结合,未结合噬菌体被投入CD44v9包被孔内进行筛选。每轮筛选后,对获得的噬菌体进行扩增,可以使优势噬菌体进行指数级别的富集。每轮筛选的回收率,即回收噬菌体/投入噬菌体,是筛选是否成功的参数。表1 示4 轮筛选的投入、回收、回收率数值。可见,随着筛选进行,在投入噬菌体数量级稳定的情况下,回收噬菌体及回收率的数量级呈现升高,经统计学检验发现,相邻轮次回收率两两比较,差异存均在统计学意义(P<0.05)。图1反应了4轮筛选回收率呈现的趋势,说明在筛选过程中,优势克隆富集情况明显,筛选有效。

图1 4轮噬菌体筛选回收率Fig.1 Recovery rates of four rounds of screening

表1 4轮筛选的投入、回收噬菌体及回收率Tab.1 Input phages,output phages and recovery rate of four rounds of pannings
2.2 噬菌体序列分析
在筛选结束后,对收取噬菌体进行滴定,随机选取30个噬菌体克隆进行测序。通过限制性内切酶位点进行插入DNA 定位,后通过M13 噬菌体密码子表进行翻译,可获得噬菌体所携带的多肽序列。在30个噬菌体单克隆中,如表2所示,出现序列重复富集现象,其中重复次数最高的序列为C9-3,共10次,其余序列 有C9-1(1 次)、C9-2(6 次)、C9-4(2 次)、C9-5(4次)、C9-6(3 次)、C9-7(1 次)、C9-8(2 次)、C9-9(1次)。重复次数多的序列相较重复序列少的序列亲和力及特异性更优的概率更大,是序列选择的重要参考标准。
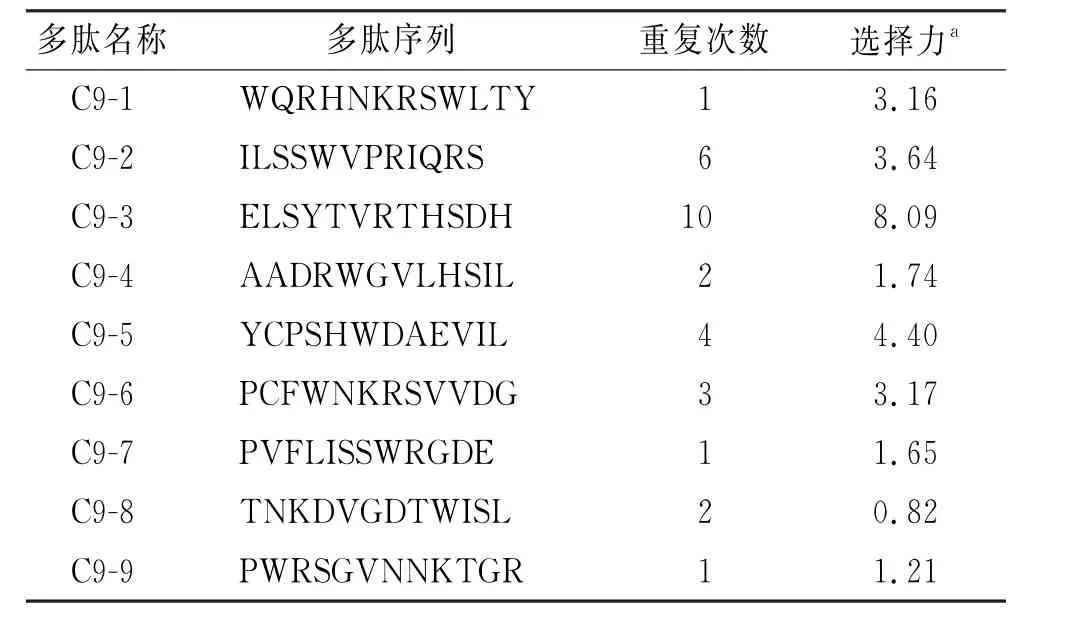
表2 噬菌体序列、重复情况及选择力Tab.2 Amino acid sequences,frequency and selectivity of screened peptides
2.3 噬菌体序列ELISA鉴定
噬菌体ELISA 用于鉴定待测序列,寻找高亲和力及选择性的噬菌体克隆。所有待测序列,包括随机对照序列克隆(unrelated random phage,Urps)均与CD44v9包被孔(靶蛋白)及BSA 包被孔(对照蛋白)进行结合检验。图2展示了噬菌体ELISA 的检验结果。噬菌体与CD44v9结合的吸光度绝对值代表结合的亲和力。可见吸光度绝对值最高的5个序列按顺序分别为C9-3、C9-2、C9-5、C9-1、C9-6,其中C9-3、C9-2两个克隆绝对值超过1.5。表2展示了所有待测序列的选择力,即噬菌体与靶蛋白、对照蛋白吸光度比值,这代表了噬菌体与靶蛋白结合的特异性。可见选择力最高的5个序列按顺序分别为C9-3、C9-5、C9-2、C9-6、C9-1,其中C9-3、C9-5两个克隆选择力大于4。综上,C9-3序列具备最佳的亲和力及特异性,同时也是重复率最高的序列,因此被选择为探针序列进行合成检测。

图2 噬菌体克隆ELISA鉴定结果Fig.2 ELISA of each individual phage clone
2.4 多肽探针检测细胞表面CD44v9
罗丹明标记的C9-3 多肽分别用于检测CD44v过表达细胞及空质粒转染对照细胞。如图3 展示,C9-3多肽结合于CD44v过表达的HEK-293 细胞,荧光信号明显高于空质粒转染的HEK-293 细胞。罗丹明标记的乱序对照肽用于结合CD44v过表达的HEK-293细胞时,也未发现明显的荧光信号。
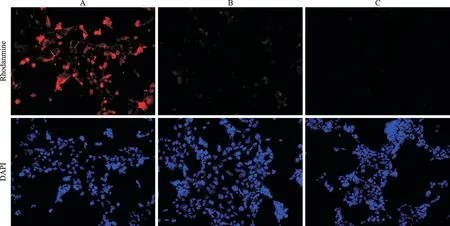
图3 C9-3多肽与CD44v9表达情况不同的HEK-293细胞结合情况Fig.3 Binding of C9-3 peptide to HEK-293 cells with different CD44v9 expression
2.5 多肽探针检测胃癌组织表面CD44v9
图4A 展示了胃癌组织中C9-3探针与CD44v9抗体染色情况,可见棕色着色位于细胞膜及细胞质中,分布位置基本一致。图4B 为组化评分统计图。多肽探针结合胃癌组织组化评分为5.09±3.84,癌旁组织为2.01±0.85,二者间存在统计学差异(t=3.953,P<0.01)。23例胃癌组织中,有11例(47.83%)经多肽探针结合呈强染色,10 例(43.48%)经CD44v9免疫组化检测结果为高表达,其中9例二者均为强染色。癌旁组织中,未发现探针强染色及CD44v9高表达。如图4C 所示,经线性回归分析显示,C9-3探针染色及CD444v9免疫组化评分间存在线性正相关关系(r=0.823,P<0.01)。

图4 C9-3多肽探针与胃癌及相应癌旁组织结合情况Fig.4 Binding of C9-3 peptide to gastric cancer and corresponding paracancerous tissues
3 讨 论
CD44是重要的肿瘤标志物,其通过不同的剪切表达,分子结构主要分为标准型CD44(CD44s)及可变型CD44(CD44v)。CD44分子为跨膜糖蛋白,包含有胞外段、跨膜段、胞内段3个部分,其中胞内段与跨膜段位于碳端,高度保守,编码区位于CD44基因的18、19、20号外显子。胞外段由1至17号外显子编码,包括有CD44分子生理功能区域——透明质酸结合域,以及v1-v10可变型外显子编码区域,由于可变性外显子存在多种剪切形式,因此CD44v分子种类繁多,胞外段长度可在200~700氨基酸不等[4]。
CD44分子是具备重要生理功能的细胞黏附分子及淋巴调节因子,但生理功能多与CD44s中所包含功能区相关。CD44v更多被研究的是其与肿瘤的关系。Rho A 与CD44v3形成复合物后,会激活Rho激酶,并磷酸化包括CD44v3、CD44v8-v10在内的几种蛋白,促使这些CD44分子与锚蛋白结合,从而调控肿瘤发展[5]。CD44v9 可以通过稳定雄激素受体诱发抗凋亡效应[6]。CD44v6可以与HGF形成复合物并将其呈递至受体,引发受体激酶样效应并激活Ras等下游通路,HGF 可以引发多种肿瘤的转移效应;HGF 经IFG-1、TGF-β、PEG-2 及 肿 瘤 坏 死 因 子激活可以刺激CD44v9 的产生[7]。CD44v7-v10 因MAPK 通路重要因子MEK、p38被抑制后同样出现转录水平的抑制[8]。可以发现,CD44v促进肿瘤机制的研究中,CD44v9是报道比较多的CD44v分子。
CD44是重要的胃癌标志物,在胃癌中的表达较正常胃黏膜组织明显上升。CD44 在正常胃黏膜中表达较少,而在癌前状态包括慢性萎缩性胃炎及肠化黏膜中表达局限于基底腺上皮细胞,癌组织中表达明显升高[9]。胃癌中关于CD44v的表达情况报道较多的是CD44v6,目前也有关于CD44v6的配体药物开发报道[10]。CD44v9被证实在胃癌组织中表达高于非癌组织[11-12];且有报道发现,CD44v6 在正常胃黏膜中有表达,但CD44v9不表达于HP阴性正常胃黏膜,提示CD44v9 具备更高的肿瘤特异性[13]。目前现有研究中,尚缺乏CD44v9的探针开发。
分子影像中成像技术已有高水平发展,可以满足闪烁扫描、光学、磁共振、超声等多平台分子水平成像,但目前制约分子影像学临床应用的原因是缺乏高灵敏、高特异、能产生明确病灶信号,并且稳定、经济的配体探针。本课题组曾通过噬菌体多肽展示技术,筛选并鉴定多条针对于CD44s、CD44v 的多肽探针[2-3,14]。发现单一探针在信号强度、灵敏性、特异性方面可能不足以满足临床要求。因而,使用不同灵敏度、特异性的探针进行复合,可以克服单一探针存在问题,在实际工作中达到提高检出率及检出特异性的目的。
因为本次筛选目标是高特异性肿瘤标志物CD44v9,因此保证探针的高特异性是本次筛查的重点。对于靶点,我们选择v9外显子合成区进行合成,最大程度避免其他结构的混入。筛选方面使用了阴性消减,减少非特异性噬菌体的结合。筛选过程中及筛选后的测序体现出了噬菌体的富集作用。后通过ELISA 验证,获得了最佳序列。经验证该序列的合成肽,可以特异性结合于CD44v过表达HEK-293细胞。一方面证实C9-3噬菌体被筛选是因为其表达肽的结合而非噬菌体非特异性结合;另一方面也证实了C9-3多肽不仅结合于固相包被的CD44v9,也可以结合于细胞表面表达的CD44v9。
通过对胃癌组织的结合,C9-3 多肽的诊断价值被进一步验证。相对我们在以往工作中所筛选的CD44s、CD44v6 探针,C9-3 在胃癌组织中的阳性率相对较低,但在癌旁非癌组织中,无一例阳性,明显低于我们既往获得探针,证明C9-3探针与其靶点一致,是胃癌的高特异性探针。因此,在后续工作中,几条探针将被用于复合检验肿瘤,以求达到临床中需求的检测强度及检测特异性。
