pH响应型DOX@R9-PEC-NP药物载体的合成及释药性能研究
2023-05-29徐晨帅冯晶晶郭仕伟白玉洁郭建峰
徐晨帅, 王 芳,2, 李 颖, 冯晶晶, 郭仕伟, 白玉洁, 郭建峰,3
(1.中北大学 化学与化工学院, 山西 太原 030051; 2.山西省沙棘药茶联合创新研发基地, 山西 太原 030051; 3.中国露酒植物提取与健康因子山西省重点实验室, 山西 太原 030051)
0 引 言
传统的化学治疗是目前治疗各类癌症的常见手段之一, 临床应用时会对正常组织和器官造成毒副作用, 因而限制了其临床应用[1]。药物智能给药系统(SDDS)因有缓释控释、靶向输送药物等优点, 可增强小分子化疗药物对病灶部位的靶向效果。因此, 设计具有靶向性的药物载体可以提高药物对肿瘤细胞的疗效, 减轻对身体的毒副作用[2-3]。
载药体系在系统给药到达病灶部位的过程中存在许多生物屏障[4-5], 在设计SDDS时应克服这些生物屏障。九聚精氨酸(Poly-arginine-9, R9)是一类在生理条件的酸碱度下具有较高正电荷的细胞穿膜肽[6-8], 可以与生物大分子结合后穿过细胞膜进入细胞内部, 具有较强的跨膜运输能力[9-10], 将其与药物载体连接, 设计出具有穿膜能力的载药纳米球, 可以提高肿瘤细胞对药物的摄取浓度[11]。
天然高分子材料果胶(Pectin, PEC)结构中富含-COOH、-OH等基团[12], 易进行化学修饰, 可以合成具有生物活性的衍生物[13], 应用于药物载体材料时, 有可缓释控释等优点[14]。CaCO3具有pH敏感性, 以及良好的生物相容性和可降解性[15], 使用CaCO3调控多糖聚合物结晶制备微粒的过程不涉及有机溶剂和表面活性剂的使用[16-17], 以肿瘤组织独特的微酸环境为特异识别靶点的载药系统更具智能化, 可减少小分子药物在正常细胞中的释放[18]。但是, 这种靶向载体的缺点是无法穿过细胞膜, 制约了靶向载体的应用。
本研究以PEC和R9为基质材料, 经酯化反应, 合成了具有穿膜效果的九聚精氨酸修饰的果胶衍生物(R9-PEC); 在R9-PEC溶液中, CaCO3自组装形成一种具有pH响应型的药物载体(R9-PEC-NP), 负载药物DOX(DOX@R9-PEC-NP)后, 实现了药物载体的靶向递送, 相较于受体靶向的载药系统, 本文设计的载药体系不依赖于肿瘤细胞上的受体表达, 能够更广泛地应用在肿瘤细胞中; 在载体表面修饰的具有穿膜效应的R9, 可改善靶向载体无法穿过细胞膜的缺点, 构建出同时具有靶向功能和穿膜潜力的载药系统, 以期提高抗癌药效。DOX@R9-PEC-NP的合成路线如图1 所示。
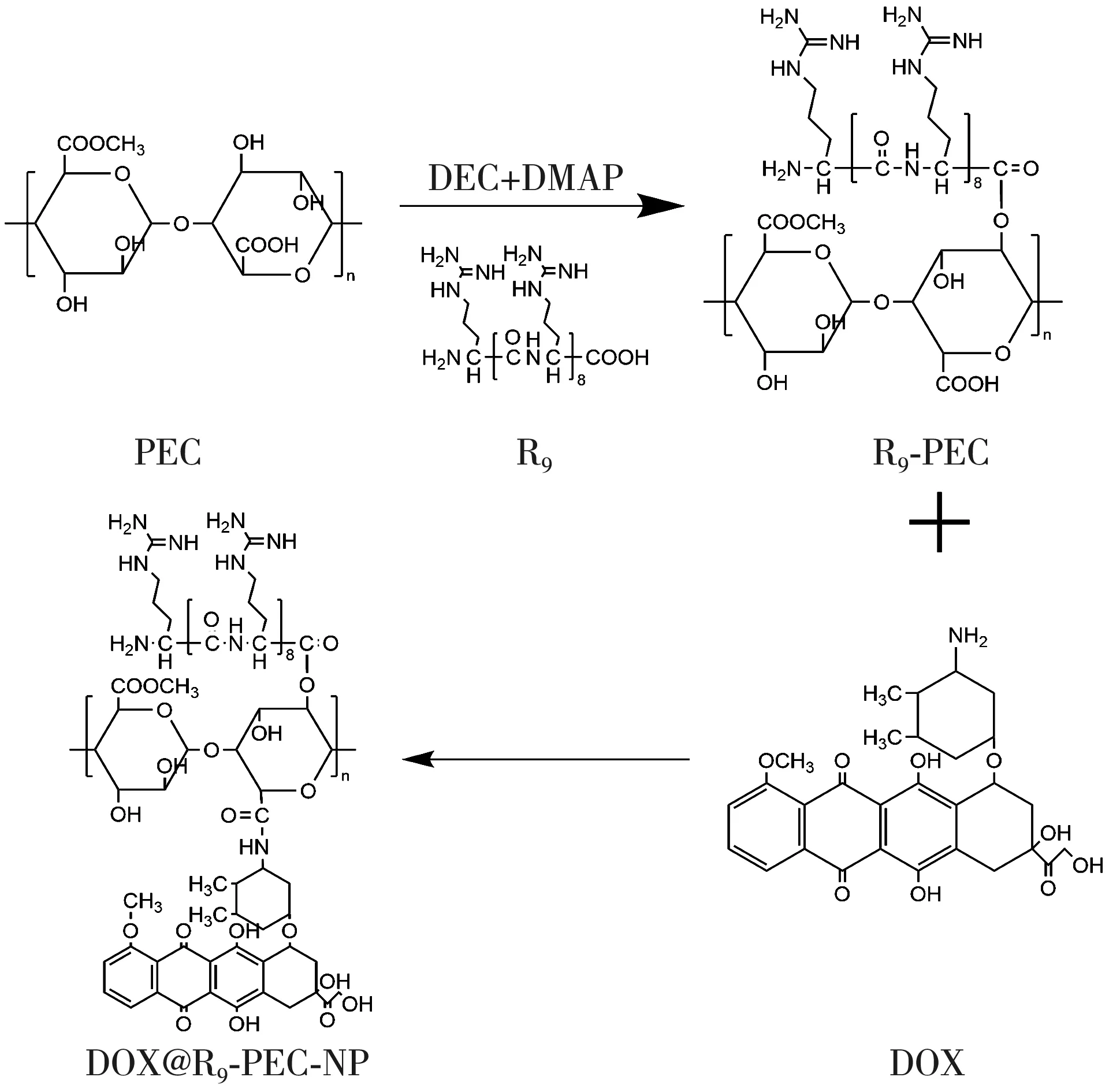
图1 DOX@R9-PEC-NP的合成路线图
1 实 验
1.1 试剂与仪器
试剂: 果胶(PEC, 相对分子质量Mr=1.5×105, 半乳糖醛酸含量≥74%), 上海易恩化学技术有限公司生产; 九聚精氨酸(R9, 98%), 湖北强耀生物科技有限公司生产; 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl), 分析纯, 上海毕得医药科技有限公司生产; 4-二甲氨基吡啶(DMAP), 分析纯, 上海易恩化学技术有限公司生产; 二甲基亚砜(DMSO)、阿霉素(DOX), 上海阿拉丁生化科技股份有限公司生产。
仪器: 台式高速离心机, TG-18W, 上海知信实验仪器技术有限公司; Zeta电位及激光粒度分析仪, Zeta Plus, 布鲁克海文仪器公司; 紫外可见分光光度计, ReadMax 1900, 上海闪谱生物科技有限公司; 傅里叶红外光谱仪(FTIR), Nicolet Nexus 470, 美国尼高力仪器公司; 冷冻干燥机, LGJ-10, 北京四环科学仪器厂; 元素分析仪, Elemantar: Vario EL cube, 德国Elementar公司; 扫描电子显微镜, Nova Nano 450, FEI公司; 荧光显微镜, Axio Vert A 1, 卡尔蔡司公司。
1.2 R9修饰PEC(R9-PEC)的制备
将50 mg R9和230 mg EDC·HCl溶于15 mL无水DMSO中, 室温(25±2)℃下反应6 h, 然后加入50 mg PEC和12 mg DMAP, 继续在室温(25±2)℃下反应24 h后, 于透析袋(截留分子质量为1.4×104g/cm3)中透析3 d, 将所得溶液冻干24 h, 得产物R9-PEC。
1.3 R9-PEC纳米球(R9-PEC-NP)的制备
取10 mL去离子水, 加入10 mg R9-PEC, 磁力搅拌至充分溶解。取2 mL的CaCl2溶液(0.02 mol/L)加入R9-PEC溶液中, 继续在室温(25±2)℃下高速搅拌2 h后, 取2 mL Na2CO3溶液(0.02 mol/L)加至以上溶液, 继续在室温(25±2)℃下高速搅拌24 h后, 将混合溶液离心10 min, 取沉淀冻干, 得到产物R9-PEC-NP。
1.4 阿霉素(DOX)载药量、包封率的测定
取10 mL 100 mg/L阿霉素水溶液, 加入10 mg R9-PEC-NP, 于摇床中震荡12 h, 在4 000 r/min条件下离心10 min, 并用去离子水多次洗涤沉淀, 收集沉淀(DOX@R9-PEC-NP)及所有洗涤水, 从而可以得出药物损失量。药物的浓度由UV-Vis在波长480 nm处测得。测定包封率ω(EE)和载药量ω(DL)。ω(EE)和ω(DL)的计算公式分别为
ω(EE)=[(M1-M2)/M1]×100%,
(1)
ω(DL)=[(M1-M2)/M3]×100%,
(2)
式中:M1为DOX的初始加入量, mg;M2为DOX的未装载量, mg;M3为装载DOX和纳米球的总质量, mg。
1.5 DOX的体外释放率检测
称取2份10 mg DOX@R9-PEC-NP, 分别溶于装有2 mL pH为5.0和7.4的磷酸盐(PBS)缓冲液的透析袋中。将透析袋置于20 mL相应pH的PBS缓冲液中, 在37 ℃水浴摇床中进行药物在体外模拟环境中的释放。利用UV-Vis在波长480 nm处测定吸光度, 根据DOX的标准曲线得出DOX的浓度, 计算得出DOX的累积释放量。
1.6 表征方法
利用元素分析仪(EA, Elemantar: Vario EL cube)测定R9的取代度, 用傅里叶红外光谱仪(FT-IR, Nicolet Nexus 470)对R9-PEC的化学结构进行表征, 用Zeta电位与粒度分析仪(Zeta Plus)和扫描电子显微镜(SEM, Nova Nano 450)观察R9-PEC-NP的形貌、尺寸和电位, 用紫外-可见分光光度计(UV-Vis, ReadMax 1900)研究R9-PEC-NP对DOX的装载及释放量。
2 结果与分析
2.1 R9-PEC的表征
2.1.1 EA的表征
聚合物PEC的羟基与R9的羧基可通过酯化反应连接, 实现PEC与R9偶联(R9-PEC), PEC和R9-PEC可通过N元素含量的差异, 确定两者的成功偶联, 可利用元素分析仪测定两者中N元素的质量分数, 实验结果如表1 所示。由此间接地测定R9-PEC中R9的取代度(DS), 计算式公式为

表1 PEC和R9-PEC中C、H、N元素的质量分数
DS=(n1-n2)×100%,
(3)
式中:n1为N元素的物质的量, mol;n2为无水葡萄糖残基的物质的量, mol。
经计算, R9-PEC中R9的取代度为7.01%。
2.1.2 FT-IR的表征

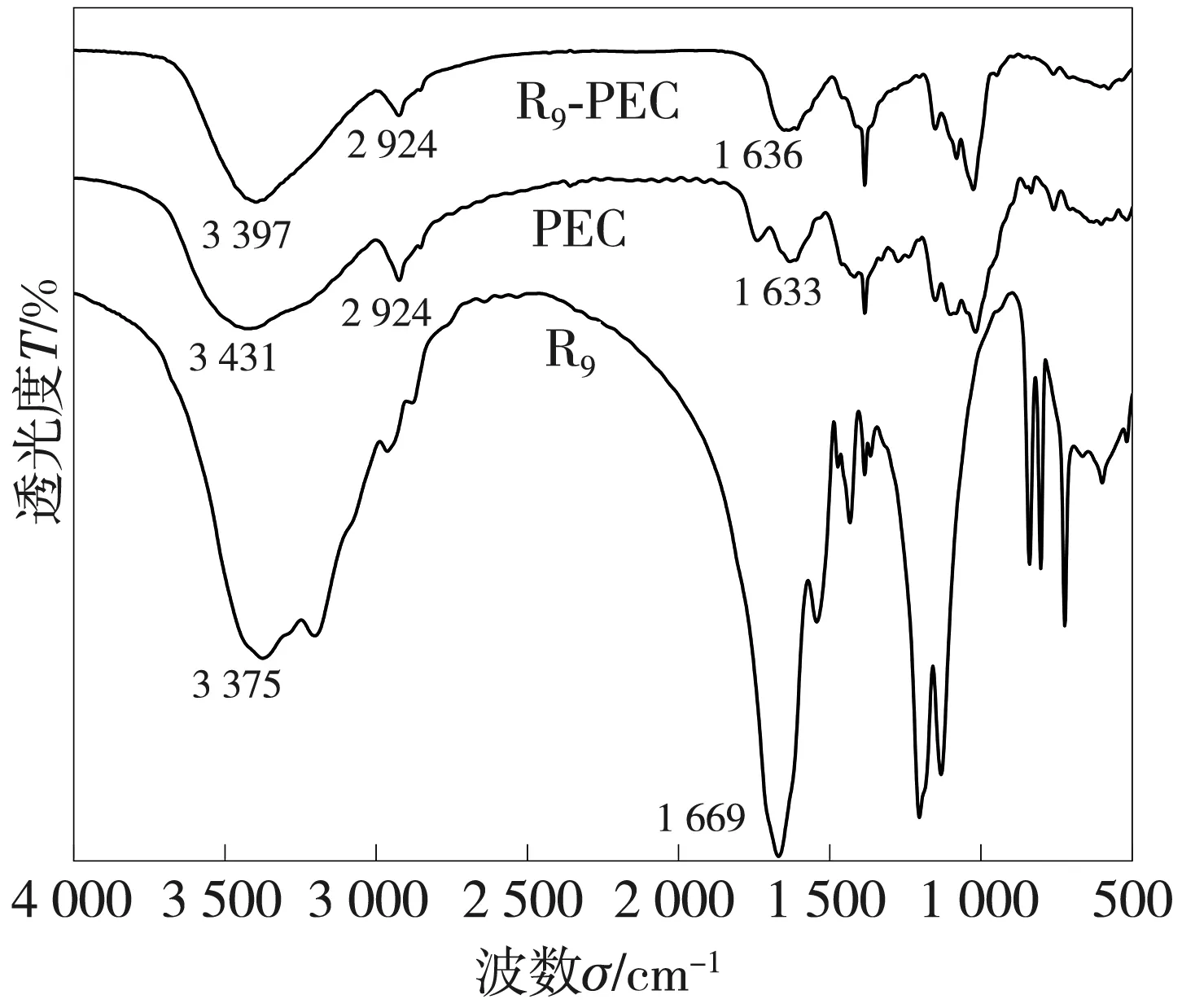
图2 PEC、R9及R9-PEC的FT-IR图谱
2.2 R9-PEC-NP的表征
2.2.1 SEM表征结果
R9-PEC-NP的SEM和粒径分布如图3 所示。由图3 可以看出, 制备的微粒的粒径分布在50 nm~350 nm之间, 平均粒径为215 nm, 形态近似球形, 大小较均一。

(a)扫描电镜图
2.2.2 Zeta电位表征结果
R9-PEC-NP在不同pH条件下的Zeta电位如图4 所示。由图4 可以看出, R9-PEC-NP在pH>5的条件下带负电, 有利于与带正电的DOX通过静电相互作用结合, 实现DOX的负载; 在pH<5的条件下带正电, 有利于R9-PEC-NP在酸性条件下释放DOX。
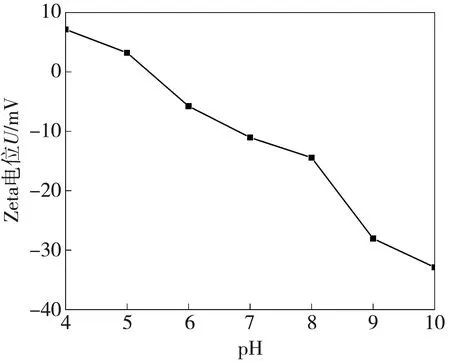
图4 R9-PEC-NP在不同pH下的Zeta电位
2.3 DOX@R9-PEC-NP的表征
2.3.1 倒置荧光显微镜表征结果
用倒置荧光显微镜观察DOX@R9-PEC-NP的载药情况(见图5)。因DOX的红色荧光, 可在倒置荧光显微镜下观察DOX@R9-PEC-NP中DOX的分布状态。通过观察可以看出, 部分DOX@R9-PEC-NP粒子呈现出了红色的荧光, 证明了DOX被装载于R9-PEC-NP中。

图5 DOX@R9-PEC-NP在倒置荧光显微镜下的载药情况
2.3.2 UV-Vis表征结果
药物DOX、药物载体R9-PEC-NP、载药微粒DOX@R9-PEC-NP通过UV-Vis进行全波长扫描的实验结果如图6 所示。DOX在480 nm左右有吸收峰, 未装载药物的R9-PEC-NP在480 nm左右无吸收峰, 而负载DOX的载药微粒DOX@R9-PEC-NP在480 nm左右有吸收峰, 说明DOX有效地载入到了R9-PEC-NP中。
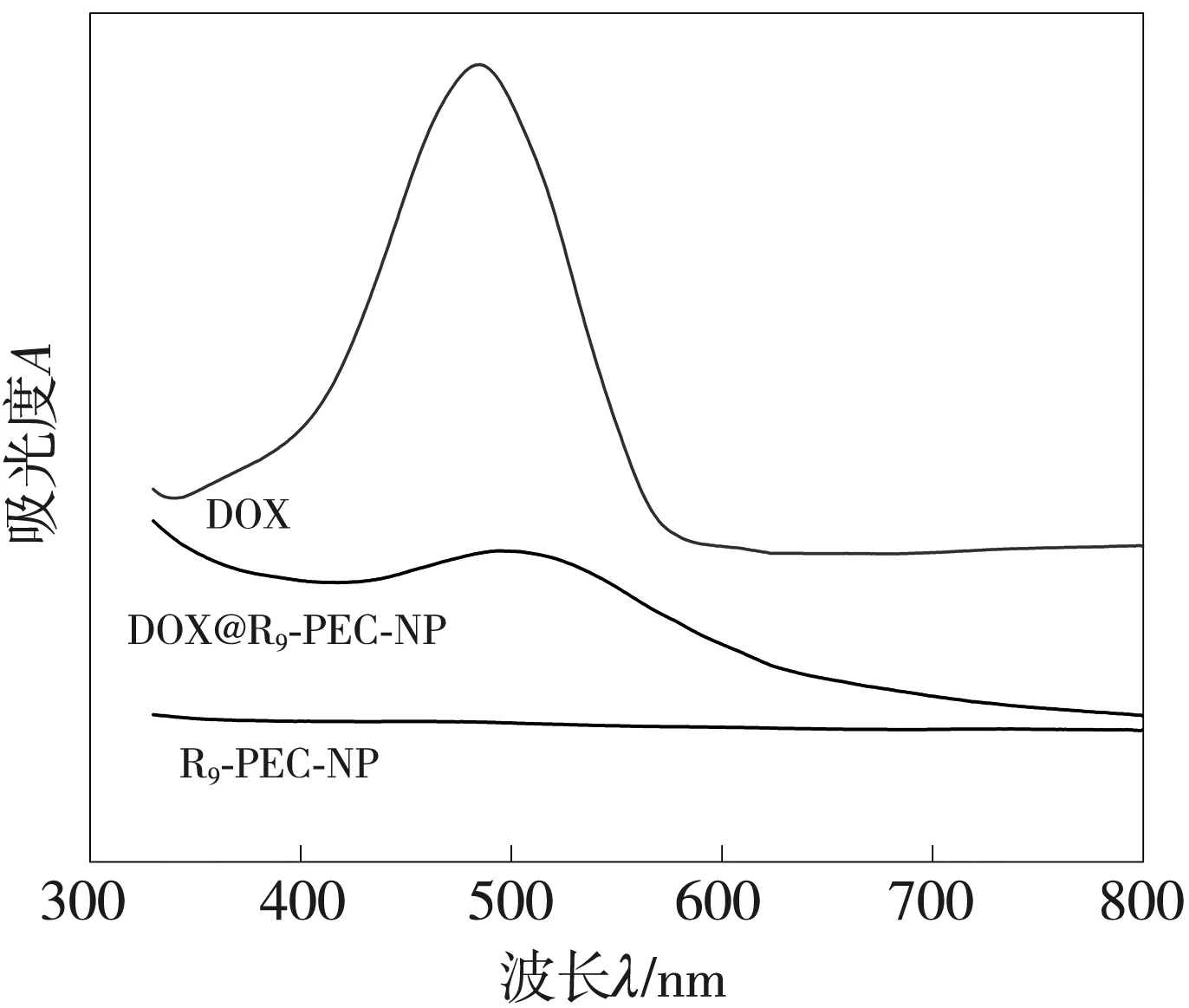
图6 R9-PEC-NP负载DOX前后的全波长扫描
2.4 R9-PEC-NP的载药性能评估
DOX的ω(DL)和ω(EE), 分别为(8.15±0.12)%和(88.70±3.56)%, 高效的DOX装载由于载药微粒制备过程中形成的特殊“Egg-Box”结构和PEC的-COO-与DOX的-NH+的静电相互作用, 从而将DOX载入R9-PEC-NP。
2.5 R9-PEC-NP体外释药实验
R9-PEC-NP在pH为5.0和7.4的PBS缓冲液中释放DOX的情况如图7 所示。DOX@R9-PEC-NP在酸性条件(pH为5.0)下的药物释放率比在正常条件(pH为7.4)下的药物释放率明显增加, 并且在100 h后释放了80%左右的DOX, 是pH为7.4条件下释放药物量的2倍。实验结果表明DOX@R9-PEC-NP在酸性条件下有利于释放DOX, 因为R9-PEC-NP在酸性条件下, 无机成分CaCO3的溶解度增加, 使纳米球中的DOX迅速暴露, 有利于促进DOX的释放, 所以在微酸性的肿瘤细胞环境下, 更有利于实现药物的释放, 其释放速率也因pH不同而得到控制, 有利于达到缓释给药目的。因此, 在低pH的癌细胞环境中, 这种药物释放模式更有利于促进药物的释放, 以实现靶向功能。在到达肿瘤组织后, CaCO3的溶解可以使纳米粒子释放DOX, 实现靶向功能。本文制备的R9-PEC-NP与前期研究中的果胶载药系统相比, 药物的载药量与包封率相近[19-20], 但相比受体靶向的载药系统, 本文设计的R9-PEC-NP不依赖于肿瘤细胞上的受体表达, 能够更广泛地应用在肿瘤细胞中; 在载体表面修饰的细胞穿膜肽九聚精氨酸, 为实现药物载体在细胞内部释放药物提供了可能。

图7 DOX@R9-PEC-NP在pH为7.4和5.0的PBS缓冲液中的药物释放曲线
3 结 论
本研究合成了具有穿膜效果及pH响应型的R9-PEC-NP, 且微粒呈现较规则的球形, 大小较均一, 平均粒径为215 nm, R9的取代度为7.01%, 赋予药物载体穿膜能力, 载药量和包封率分别为(8.15±0.12)%和(88.70±3.56)%, pH为5.0条件下的药物释放率明显增加, 在100 h后释放了80%左右的DOX, 是pH为7.4条件下释放药物量的2倍。DOX@R9-PEC-NP不仅可以缓控释放DOX, 而且具有较好的pH响应性, 同时, 因R9的连接赋予了药物载体细胞穿膜的性能, 使其成为潜在的智能给药系统载体材料。
