有氧运动抑制心脏Hmox-1/GPX4介导的铁死亡缓解糖尿病小鼠心室重构
2023-05-29王婷邹岩李海燕王永华
王婷,邹岩,李海燕,王永华
1.绍兴市人民医院 浙江大学绍兴医院 超声科,浙江 绍兴 312000;2.温州医科大学附属第一医院心内科,浙江 温州 325015;3.温州医科大学 体育部,浙江 温州 325035;4.温州医科大学附属第一医院 康复科,浙江 温州 325015
糖尿病发病率逐年升高,其对健康影响除了代谢紊乱外还在于导致严重的心血管并发症。糖尿病心肌病(diabetic cardiomyopathy, DCM)是一种独立于冠心病、心脏瓣膜病和高血压心脏病等之外的特异性心肌病,其病理表现为细胞凋亡和坏死增加、心肌细胞肥大、心肌胶原过度沉积,导致左心室舒张期和(或)收缩期功能障碍,与糖尿病患者心功能不全和高病死率密切相关[1]。诸多证据指出,长期适当的有氧运动疗法可以降低糖尿病机体血脂和血糖,上调胰岛素敏感性,减轻心肌细胞炎症、凋亡程度和氧化应激反应水平,从而一定程度上延缓DCM的进展[2-5]。
近年研究发现,铁死亡是一种新型的程序性细胞坏死方式,具有铁依赖性,通过催化细胞膜高表达不饱和脂肪酸,促使脂质过氧化物积累从而损伤杀死细胞。谷胱甘肽过氧化物酶4(glutathione peroxidase-4, GPX4)是铁死亡的重要调节剂,主要通过谷胱甘肽(glutathione, GSH)依赖的方式,还原有毒的过氧化物,从而保护线粒体和细胞免受铁死亡损伤;而血红素加氧酶1(heme oxygenase-1,Hmox-1)的增加可加速血红素降解,同时促进游离铁的释放,导致铁死亡增加[6-8]。近年研究指出铁死亡参与多种疾病如神经退行性疾病、炎症、癌症和缺血再灌注损伤[9]等的进展,同时也参与糖尿病诸多并发症如肾病、脑血管疾病、视网膜病变和动脉粥样硬化性心脏病的发生发展[10]。据报道,铁死亡激动剂可显著降低心肌细胞GPX4的表达,引起铁代谢异常和脂质过氧化[11]。LI等[12]研究结果表明GPX4可以抑制脂质过氧化负向调控铁死亡,在DCM伴缺血/再灌注模型中,铁死亡减少氧化应激反应和细胞凋亡损伤,显著减轻糖尿病心肌梗死面积。
美国糖尿病学会鼓励糖尿病患者进行适当运动用于改善心血管疾病等的并发症。然而,有氧运动训练是否调控心脏铁死亡途径来改善心脏功能尚不清楚。本研究通过对db/db自发糖尿病小鼠及高脂饮食(high fat food, HFD)联合链脲佐菌素(streptozotocin, STZ)诱导的2型糖尿病小鼠进行12周的跑台运动干预,以阐明有氧运动介导心脏铁死亡途径这一新机制发挥其保护DCM的作用。
1 材料和方法
1.1 动物饲养 本研究遵循《实验动物的护理和使用准则》(美国国家研究委员会)。8周龄雄性db/db小鼠、C57BL/6小鼠均从南京模式动物研究所购得。实验期间所有小鼠统一饲养在温州医科大学实验动物中心SPF级动物房。本研究采取的实验方案已得到温州医科大学动物伦理委员会的批准(wydw2016-0266),实验动物许可证号:SYXK(浙)2021-0017。
1.2 主要设备与试剂 ZS-PT小动物实验跑台购自北京众实迪创科技发展有限公司,高分辨率小动物超声影像系统(Vevo 3100)购自加拿大Fujifilm VisualSonics 公司,血糖仪(艾科)购自杭州艾康生物技术有限公司。Hmox-1(ER1802-73)、GPX4(ET1706-45)、转化生长因子β(transforming growth factor-β, TGF-β,ER31210)、GAPDH(ET1601-4)抗体、基质金属蛋白酶9(matrix metalloproteinase 9, MMP9, ER1706-40)和肌球蛋白重链(myosin heavy chain, MyHC,ET1702-88)抗体均购自杭州华安生物技术有限公司。4-HNE(MAB3249)抗体购自美国Bio-techne公司;心房钠尿肽(atrial natriuretic peptide,ANP, sc-515701)和I型胶原蛋白(collagen-I,COL-I, sc293182)抗体均购自美国Santa Cruz Biotechnology公司。STZ由美国Sigma公司提供;HFD购自北京博泰宏达生物技术有限公司。
1.3 动物饲养和分组 所有SPF级实验小鼠均进行1周的适应性喂养。①普通饲料喂养db/db小鼠,构建成自发的2型糖尿病模型。将造模成功的小鼠随机分成db/db糖尿病组(db/db组,n=8)和db/db糖尿病+运动组(db/db+EX组,n=8)。C57BL/6小鼠作为对照,随机分成空白对照组(WT组,n=8)和单纯运动组(EX组,n=8)。②STZ联合HFD诱导的2型糖尿病小鼠模型。分别采用脂肪含量45%的饲料HD001(高脂组)和脂肪含量10%的普食饲料(对照组)喂养8周,然后以STZ[30 mg/(kg·d)],共5 d;腹腔注射C57BL/6小鼠破坏胰岛β细胞引起2型糖尿病。C57BL/6小鼠随机分成空白对照组(WT组,n=8)和单纯运动组(EX组,n=8)。HFD+STZ诱导的小鼠随机HFD+STZ糖尿病组(HFD+STZ组,n=8)和HFD+STZ糖尿病+运动组(HFD+STZ+EX组,n=8)。
1.4 实验运动方案 本研究参考FERNANDO等[13]的研究,使用小动物实验跑台,首先对造模所用小鼠进行为期1周的适应性训练:设置坡度为0°,跑步速度为8 m/min,持续20 min/d,共5 d。对实验小鼠分组后开始12周的正式训练。运动组(db/db+EX组、EX组、HFD+STZ+EX组):设置坡度为0°,速度为10 m/min,60 min/d,5 d/周。对照组(db/db组、WT组、HFD+STZ组):将小鼠置于静止的跑道上,不予额外刺激。跑台运动干预在下午2:00—4:00进行。
1.5 无创超声心动图 提前剃去小鼠心前区毛发,充分暴露心前区,予异氟烷麻醉,保证小鼠心率在400~500次/min,使用高分辨率小动物超声仪进行超声心动图扫描,检测小鼠心脏结构和功能,采集M型和短轴超声图像,记录心功能相关指标。
1.6 动物取材 实验小鼠处死前12 h禁食,不控制其饮水量。在末次跑台结束后24 h记录小鼠体质量、血糖等指标,使用戊巴比妥钠麻醉后充分暴露胸腔,切取部分心脏组织常规石蜡包埋,用于免疫组化等染色检测4-HNE表达,观察心肌组织形态变化和纤维化,另留取部分心脏组织置于-80 ℃冰箱中备用,用于检测心肌组织的相关指标。
1.7 HE染色、马松染色和天狼星红染色 心脏组织的石蜡切片先进行脱蜡脱水处理,再依次用苏木素染液、伊红染液对心肌组织进行HE染色;依次用饱和苦味酸和苏木素对组织进行天狼星红染色。马松染色用新配置的Weigert铁苏木素染色液染色,分化反蓝,丽春红品红染色,酸洗后放入苯胺蓝染色液中染色。天狼星红染色分析和马松染色分析为计算胶原容积分数,分别为计算胶原阳性红色面积或胶原阳性的蓝色占总面积的百分比。
1.8 免疫组化 心脏石蜡切片脱蜡处理后置于枸橼酸钠缓冲液(pH=6.0,0.01 mol/L)中,用铁饭盒或锅煮沸,温度控制在96~98 ℃,保持15 min,等自然冷却后,漂洗干净,用3%过氧化氢(80%甲醇稀释)室温孵育10 min,用于灭活内源酶活性。用PBS洗涤3 min/次,共3次。滴加一抗(4-HNE,1:100稀释)充分覆盖心脏组织,室温孵育1 h后漂洗,滴加二抗(1:100稀释)室温孵育1 h,再次漂洗,滴加新配置的DAB显色液,观察组织显色,及时终止,脱水封片。
1.9 Western blot检测 剪碎心脏组织,加入RIPA裂解液(含蛋白酶抑制剂和磷酸酶抑制剂),充分匀浆,低温高速离心得到上清液即为蛋白样本。在凝胶样本孔中加入20 μg样本,进行电泳,使用Bio-Rad湿式转膜,电流为300~600 mA,时间30~60 min。再用5%的脱脂奶粉室温封闭1 h,洗涤后加一抗(1%的BSA稀释)置于4 ℃冰箱孵育过夜。再次洗涤后二抗室温下孵育1 h。随后加入显色剂,曝光存照。使用软件ImageJ 11.0分析条带灰度值。以GAPDH为内参分别计算所测蛋白的相对表达量。
1.10 动物组织总RNA的提取与实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction, RT-qPCR) 取小鼠心脏组织置于冰上,依次用TRIzol、氯仿抽提RNA,高速离心取上层水相,沉淀洗涤倒置晾干,用适量DEPC水溶解,得到的溶液即为RNA,置于-80 ℃冰箱中待测。所用引物由上海生工生物工程有限公司制备。引物序列如表1所示,用2-ΔΔCt法分析mRNA的相对表达量。

表1 RT-qPCR相关引物的序列
1.1 1 统计学处理方法 采用SPSS 22.0软件进行统计分析。用Shapiro-Wilk检验数据正态性,用Levene方差齐性检验判断等方差性,正态分布计量资料采用±s表示,采用双因素方差分析评价糖尿病和运动对心脏功能、心脏重构和心脏铁死亡等的影响。P<0.05为差异有统计学意义。
2 结果
2.1 有氧运动改善糖尿病小鼠心脏功能障碍 小鼠经胸无创性超声心动图检查心脏功能发现,与WT组相比,db/db组小鼠舒张末左室后壁明显增厚,心脏射血分数和左心室缩短分数明显下降,差异有统计学意义(P<0.05)。与db/db组小鼠相比,db/db+EX组心肌肥厚减轻,心功能障碍得到显著改善(P<0.05),见图1A、图1B。在HFD+STZ诱导的2型糖尿病小鼠模型中我们观察到这些指标具有相同的变化趋势(P<0.05),见图1C、图1D。可见,有规律的有氧运动可有效改善糖尿病小鼠的心功能障碍。

图1 各组小鼠的心超图及分析图
2.2 有氧运动训练缓解小鼠心脏纤维化和心脏肥大 小鼠心脏HE染色结果显示,与对照组小鼠相比,单纯EX组心脏组织无显著变化,db/db组小鼠和HFD+STZ组小鼠心肌纤维粗大,排列明显紊乱;运用马松染色检测各组小鼠心肌纤维化,db/db组小鼠和HFD+STZ组小鼠心脏组织可见更多的胶原和纤维组织的沉积,而db/db+EX组和HFD+STZ+EX组这些异常征象得到显著改善,差异有统计学意义(P<0.05),见图2。同样地,Western blot检测发现心肌纤维化分子标记物TGF-β、COL-1、MMP9和心肌肥大标记物指标MyHC、ANP在db/db组和HFD+STZ组小鼠心脏组织中表达显著升高,而db/db+EX组和HFD+STZ+EX组明显逆转了这些指标变化,且差异有统计学意义(P<0.05)。在mRNA水平观察到同样的结果。见图3和图4。这些研究结果显示有氧运动可以改善小鼠心脏纤维化、肥大,缓解糖尿病小鼠的心脏重构。

图2 小鼠心肌组织HE和马松、天狼星红染色及统计分析图

图3 db/db自发糖尿病小鼠心肌组织肥大和纤维化指标的表达

图4 HFD+STZ诱导小鼠模型的心肌肥大和纤维化相关的蛋白和mRNA的表达
2.3 有氧运动显著增加了心脏组织铁死亡指标GPX4的表达,减少了Hmox-1、4-HNE水平 与WT组相比,EX组心脏组织的Hmox-1和GPX4表达未见显著变化,db/db小鼠心脏组织中铁死亡指标GPX4表达显著下降,Hmox-1表达显著增加,相应地,在HFD+STZ诱导糖尿病小鼠中,心脏组织的Hmox-1和GPX4表达趋势呈现一致的趋势,其差异有统计学意义(P<0.05);心脏免疫组化结果同样指出:糖尿病小鼠组心脏组织的4-HNE表达显著增加,而有氧跑台运动12周后小鼠心脏组织的Hmox-1和4-HNE表达量显著下调,GPX4的水平明显增加,差异有统计学意义(P<0.05)。见图5。这些数据提示有氧运动显著降低了糖尿病小鼠心脏组织铁死亡水平。
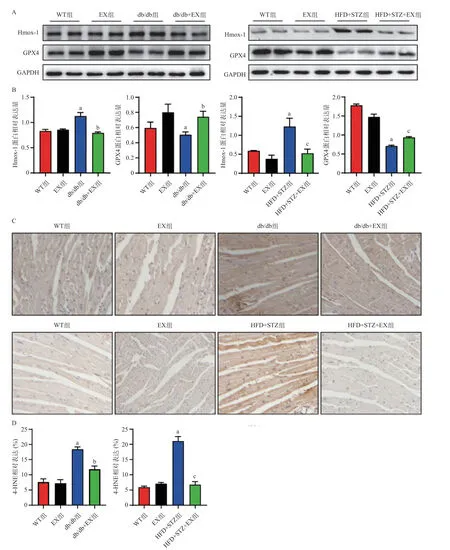
图5 小鼠心肌组织GPX4和Hmox-1的表达和4-HNE免疫组化结果
3 讨论
糖尿病作为一种慢性代谢性疾病,目前导致了严重的全球健康问题[14],可因心肌细胞肥大,成纤维细胞增殖,细胞外基质过度沉积,或因心肌细胞死亡导致心肌质量减少,促使心肌顺应性下降、心室重构等,最终导致心脏收缩和舒张障碍。既往研究指出:糖尿病大鼠心脏成纤维细胞的COL-I、IGF-1受体表达明显增加,导致心脏胶原沉积明显,而黄连素的处理能抑制COL-I和IGF-1受体有效缓解糖尿病诱导的心脏纤维化[15]。本研究同样发现,自发糖尿病的db/db小鼠和高脂喂养联合STZ诱导的糖尿病小鼠中,心脏组织TGF-β、COL-I上调,心肌纤维排列显著紊乱,且伴随相应的心脏舒张、收缩功能障碍,这些数据均表明糖尿病小鼠存在心肌重构,进而影响了心脏功能。
已明确心肌细胞死亡可导致心肌质量减少,细胞外基质合成和降解失衡,心肌顺应性降低,心功能受损,是启动DCM心脏病理重塑的关键步骤[16-17],靶向抑制细胞死亡是有望成为今后减轻或逆转心脏重构的治疗或联合治疗的重要干预途径。新近研究指出五味子乙素[18]、长编码RNA-ZFAS1[19]或卡格列净[20]等通过抑制铁死亡途径改善心肌氧化应激进而减轻糖尿病心肌损伤。已有研究表明,有氧运动时核因子E2相关因子2增加细胞核中GPX4的表达,抑制心肌铁死亡的发生[21]。且Hmox-1在调节心血管功能起着重要作用,初步小样本临床数据指出Hmox-1基因多态性与次剂量运动后心脏反应参数改变具有一定的相关性[22]。本研究发现糖尿病小鼠的心脏组织铁死亡指标Hmox-1表达显著增加,而GPX4水平明显下降,提示DCM中存在铁死亡增加,而这些数据佐证了在DCM发生发展过程中,心脏铁死亡促进心肌损伤这一环节扮演着重要角色,而靶向心肌铁死亡也将可能成为DCM的新机制和防治的新策略。
诸多证据表明有氧运动可通过抗炎、减少凋亡或自噬等不同机制来缓解慢性病及其并发症的发生发展[3,23],通过改善线粒体功能[24],降低ROS水平来保护心肌[25-27],改善心肌功能。比如LEW等[26]研究指出,有氧运动能够调节糖尿病小鼠心脏保护作用的重要效应因子miRNA-126,改善心肌微血管灌注,改善糖尿病心血管疾病的预后;运动通过调节胰岛素样生长因子1或磷脂酰肌醇3磷酸激酶水平[28],抑制磷酸化组蛋白去乙酰化酶4和上调葡萄糖转运蛋白表达[29]等,影响心肌损伤反应中的增殖和修复机制。有规律的有氧运动可作为一种有效的干预手段,有助于防止或延缓糖尿病及其并发症的发生发展。本研究表明,与糖尿病组小鼠相比,糖尿病运动组小鼠心肌胶原纤维沉积显著减少,心肌排列紊乱缓解,心肌重构改善,心功能也得到明显提升。如前所述,DCM小鼠模型提示有氧运动通过调控Hmox-1与GPX4的水平,有效抑制DCM的心脏铁死亡。除此之外,4-HNE作为与氧化应激密切相关的一种细胞活性醛,可通过线粒体涉及多种疾病的进展,如促使心肌细胞损伤,导致糖尿病介导的心力衰竭,因此,4-HNE可作为糖尿病心肌损害的生物标志物[30]。与此类似,本研究免疫组化结果显示糖尿病心脏组织4-HNE水平明显上调,而糖尿病运动组可有效降低心脏4-HNE的表达水平,提示有氧运动可通过调控心脏4-HNE减少脂质过氧化。
综上所述,在DCM小鼠中,有氧运动降低心脏Hmox-1和4-HNE水平,促使GPX4表达增强,抑制了心脏铁死亡,进而缓解心肌肥大及纤维化,减缓心室重构。可见,通过运动抑制心脏铁死亡有望成为新的心脏保护靶点。
