基于Keap1/Nrf2信号通路研究电针对神经病理性疼痛大鼠线粒体自噬的影响
2023-05-29程博屠文展楼新法杨观虎蒋松鹤吴巧云
程博,屠文展,楼新法,杨观虎,蒋松鹤,3,吴巧云,3
1.温州医科大学附属第二医院育英儿童医院 康复医学中心,浙江 温州 325027;2.温州医科大学中美针灸康复研究所 整合优化医学研究中心,浙江 温州 325035;3.温州市康复重点实验室 浙江省针灸康复重点实验室,浙江 温州 325027
神经病理性疼痛现今还难以完全治愈[1]。目前对神经性疼痛的治疗包括药物疗法、神经调节疗法及手术治疗等[2]。尽管有多种治疗选择,由于其病因的复杂性,目前治疗效果并不十分满意。电针因其不良反应小,在神经病理性疼痛治疗方面得到广泛应用[3],但其作用机制还有待进一步研究。线粒体自噬在保护受损细胞方面起着重要的作用[4]。线粒体自噬的诱导可缓解周围神经损伤引起的神经病理性疼痛[5]。同时有研究表明,Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein-1, Keap1)/核因子E2相关因子2(nuclear factor erythroid-related factor 2, Nrf2)信号通路的激活可促进线粒体自噬并缓解神经病理性疼痛[6-7],但电针是否通过调控线粒体自噬改善神经病理性疼痛尚不明确。本研究通过检测电针对L5脊神经结扎(spinal nerve ligation, SNL)大鼠疼痛阈值、脊髓背角线粒体形态结构及自噬相关蛋白表达量的影响,研究电针治疗神经性疼痛疾病的部分机制。
1 材料和方法
1.1 实验动物 选取健康成年雄性Sprague-Dawley大鼠,体质量200~250 g,购于温州医科大学实验动物中心[SYXK(浙)2020-0014]。大鼠饲养于22~24 ℃、50%~70%相对湿度、昼夜交替规律变化的房间中,自由饮水及饮食。39只大鼠通过抽签随机平均分为3组:假模组、模型组及电针组。
1.2 SNL模型制作 对模型组大鼠腹腔注射2%戊巴比妥钠使大鼠麻醉,后背部去毛备皮,以L5棘突为中心纵向切开皮肤及肌肉组织约1 cm,暴露右侧L5横突。将L5横突去除后对右侧L5脊神经进行结扎。对造模大鼠进行单笼饲养,正常饮水及饮食。对假模组大鼠进行相同操作但不进行神经结扎。
1.3 干预方法 将大鼠固定于本实验室设计的专用大鼠固定器(专利申请号:201110021482.5,国家知识产权局)上,采用韩氏电针仪对大鼠右侧“足三里”及“昆仑”穴进行电刺激,针刺深度为2~3 mm,频率2/100 Hz,强度1.5 mA,时间30 min,从术后第8天开始每天治疗1次,连续治疗7 d。
1.4 检测方法
1.4.1 热阈检测:于造模前(0)及造模后第3、5、7、10、12、14 天(同一时间段:14:00—17:00)对大鼠进行热阈检测。检测仪器为37370型爪热觉测试仪(意大利UGO公司)。大鼠于仪器内安静状态下适应30 min,红外光对准右侧足底中心,足部因热感出现疼痛反应时引起足部上抬,仪器热源自动切断,记录此时热阈值。检测方法每隔5 min进行1次,连续进行5次,结果为去掉最大和最小值后的平均值。
1.4.2 机械痛阈检测:于造模前(0)及造模后第3、5、7、10、12、14天(同一时间段:14:00—17:00)对大鼠进行痛阈检测。检测仪器为2450型爪痛觉测试仪(美国IITC LifeScience公司)。大鼠于仪器内安静状态下适应30 min,探针头部对准大鼠患侧足底中心并缓慢加压,当大鼠足部出现逃避性反应偏离探针头部时,记录此时痛阈数值。检测方法每隔5 min进行1次,连续进行5次,结果为去掉最大和最小值后的平均值。
1.4.3 HE染色:电针治疗后第7天对各组大鼠腹腔注射2%戊巴比妥钠(30 mg/kg)使其深度麻醉。用0.9%氯化钠溶液经主动脉对大鼠进行灌注,直至大鼠肝肺变白,后转为4%多聚甲醛对大鼠进行灌注使其身体僵硬。取大鼠L4-6脊髓节段于4%多聚甲醛中固定24 h。取出组织置于不同浓度乙醇中进行梯度脱水,之后将组织用石蜡进行包埋,冠状切面切下系列切片。每连续4张切片取一张行HE染色。切片先用苏木素对其进行染色,之后经伊红染液染色,之后配置不同浓度的乙醇进行梯度脱水,从二甲苯中取出后进行封片处理,最后在显微镜下观察组织结构。
1.4.4 透射电镜观察:术后第14天腹腔注射2%戊巴比妥钠(30 mg/kg)对大鼠进行深度麻醉,取L4-6脊髓节段(约1 cm),沿脊髓背角纵向将标本切成1 mm×1 mm×2 mm的长条若干,迅速放入戊二醛内保存于4 ℃冰箱进行固定。经PBS漂洗后于1%锇酸内震荡处理5 min,后将组织浸于1%醋酸铀内震荡5 min,梯度脱水后将组织进行包埋。经半薄切片观察组织的固定效果后进行超薄切片,线粒体结构通过透射电镜进行观察,并拍摄采集图片。
1.4.5 蛋白质印迹(Western blot)法检测:术后第14天腹腔注射2%戊巴比妥钠(30 mg/kg)对大鼠进行深度麻醉,取L4-6脊髓节段(约1 cm),将脊髓置于蛋白裂解液中进行匀浆,充分裂解后取上清进行BCA蛋白浓度检测。对蛋白进行电泳,后将蛋白转移至PVDF膜上,5%脱脂牛奶室温封闭2 h,之后将条带放入一抗中4 ℃孵育16 h:兔源性Keap1一抗(1:1 000;美国Affinity公司);兔源性Nrf2 一抗(1:1 000;美国Affinity公司);兔源性BCL2和腺病毒E1B19 kDa相互作用蛋白3类似体(NIX)一抗(1:1 000;美国Affinity公司);兔源性BCL2和腺病毒E1B19 kDa相互作用蛋白3(BNIP3)一抗(1:1 000;美国Affinity公司);兔源性GAPDH一抗(1:5 000;美国Bioworld公司)。之后将条带转入山羊抗兔IgG二抗(1:5 000;上海碧云天生物技术有限公司)中1 h。化学发光仪曝光后,AlphaEaseFC 4.0软件分析获取条带灰度值。
1.5 统计学处理方法 采用SPSS23.0软件进行统计分析。正态分布计量资料以±s表示,疼痛阈值检测采用双因素方差分析,Bonferroni's进行事后检验。其余多组间比较采用单因素方差分析,方差齐者予Tukey进行组间两两比较,方差不齐者予Dunnett'sT3进行组间两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 行为学观察
2.1.1 大鼠患侧热缩足反射潜伏期:与假模组相比,模型组大鼠在造模后患侧后肢的热阈明显降低(P<0.01),并在后期保持在较低水平;电针治疗组大鼠患侧后肢热阈逐渐升高,与模型组相比,差异有统计学意义(P<0.01)。见图1。
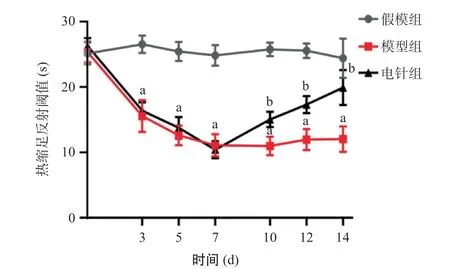
图1 热缩足反射潜伏期结果
2.1.2 大鼠患侧机械缩足反应阈值:与假模组相比,模型组大鼠在造模后患侧后肢的机械痛阈明显降低(P<0.01),并在后期保持在较低水平;电针治疗组大鼠患侧后肢机械痛阈逐渐升高,与模型组相比,差异有统计学意义(P<0.01)。见图2。
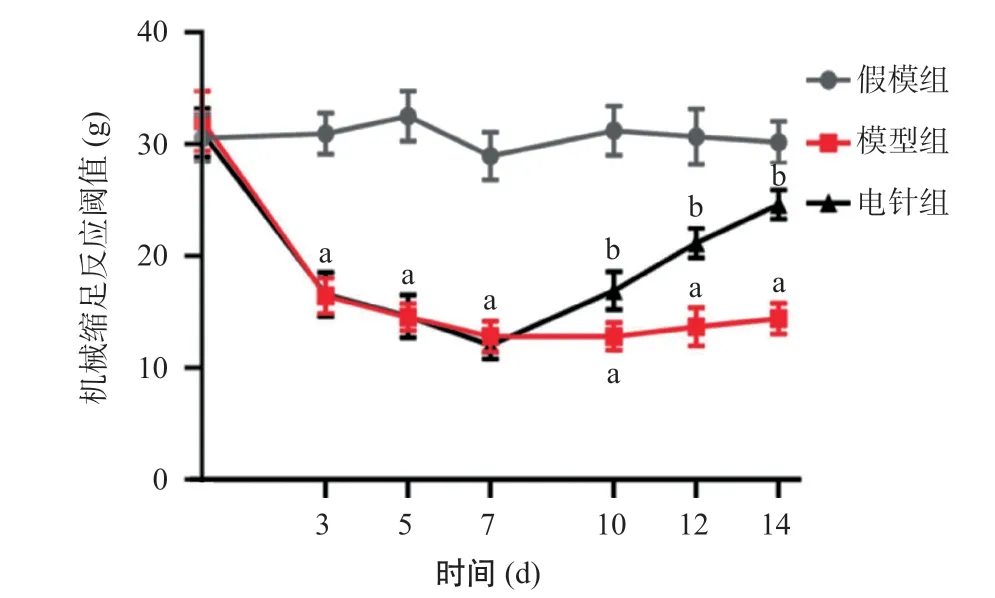
图2 机械缩足反应阈值
2.2 HE染色 假模组大鼠脊髓背角神经元形态结构正常,组织致密。模型组大鼠脊髓背角神经元核固缩明显,细胞变性,组织疏松。电针治疗后,大鼠脊髓背角神经元形态结构改善,核固缩减少。见图3。
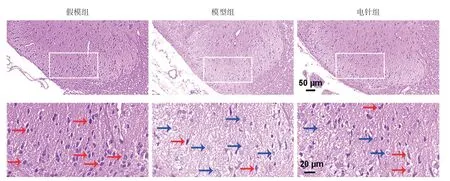
图3 HE染色结果
2.3 透射电镜观察 假模组可见正常形态的线粒体,细胞内未见自噬体及溶酶体;模型组脊髓背角线粒体数目增多,肿胀变形,可见自噬溶酶体结构,细胞出现坏死及凋亡;与模型组相比,电针治疗组大鼠脊髓背角细胞结构较完整,肿胀减轻,细胞内可见明显的自噬溶酶体结构,细胞坏死及凋亡现象减少。见图4。

图4 透射电镜结果
2.4 Western blot检测 与假模组相比,模型组大鼠Keap1、Nrf2、NIX、BNIP3蛋白表达升高,差异均有统计学意义(P<0.05);电针治疗后Keap1蛋白表达降低,Nrf2、NIX、BNIP3蛋白表达升高,差异均有统计意义(P<0.05)。见图5。
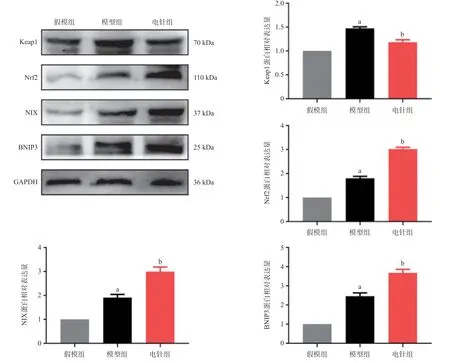
图5 各组大鼠Keap1、Nrf2、NIX、BNIP3蛋白表达结果
3 讨论
神经病理性疼痛以痛觉超敏、痛觉过敏及自发性疼痛等为特征,临床上治疗效果有限,严重影响患者的生活质量。线粒体自噬是一种选择性自噬,能够在一定程度上清除受损的线粒体,在细胞形态及功能维持方面起着重要作用[8]。同时有研究表明,线粒体自噬与神经病理性疼痛密切相关[7]。目前研究线粒体自噬的方法主要为透射电镜下观察线粒体的形态结构的变化情况及细胞自噬溶酶体的形成情况。同时NIX、BNIP3都是线粒体膜蛋白,NIX及BNIP3 的表达量变化可以反映线粒体自噬的情况[9-11]。本研究结果发现,SNL造模后,大鼠随即出现患侧疼痛症状,脊髓背角线粒体数目增多,周围出现自噬溶酶体结构,细胞破坏严重,伴随着NIX、BNIP3蛋白表达量的升高。以上结果表明线粒体自噬在神经病理性疼痛中发挥重要的调节作用。
Nrf2 是碱性亮氨酸拉链家族转录因子的一份子,正常情况下,胞浆中的Nrf2与Keap1结合,受Keap1泛素化修饰,进而被蛋白酶体系统降解[12]。在细胞受刺激时,ROS可对Keap的半胱氨酸残基进行修饰,从而使Nrf2进入细胞核,与转录因子组成异二聚体,从而与抗氧化还原反应元件结合,启动下游靶基因转录[13]。Keap1的自噬降解可激活抗氧化转录因子Nrf2并保护细胞免受ROS的侵害[14]。同时有研究表明Keap1/Nrf2与疼痛密切相关。LIU等[15]发现在坐骨神经慢性压迫损伤模型中,Keap1 过表达伴随着Nrf2 水平上升以及疼痛阈值的降低,Keap1基因沉默减轻了CCI大鼠的神经性疼痛。LAN等[16]研究表明Nrf2 基因敲除阻断了Keap1/Nrf2/HO-1信号传导,并部分减弱了右美托咪定的镇痛和抗炎作用。本研究通过Western blot观察到SNL大鼠损伤14 d后,脊髓背角Keap1、Nrf2表达升高,表明Keap1、Nrf2可能参与了周围神经损伤引起的疼痛反应。
电针已在临床上被广泛应用于治疗各种慢性疼痛性疾病。针灸(包括普通针刺、电针等)具有多途径传导的反馈调节作用(多元针灸反馈规律)[17]。不同穴位不同强度电针刺激所产生的效果可能不同。本研究选取的“足三里”和“昆仑”穴为治疗下肢疼痛的常用有效穴[18-19]。“足三里”和“昆仑”穴分别属于足阳明胃经及太阳膀胱经,有强筋骨、调气血、舒筋活络、镇痛等功效。同时作为坐骨神经分支的腓深神经及腓肠神经分别从“足三里”和“昆仑”穴深层经过,电针可对其产生刺激,同时作用于邻近血管,将刺激信号上传到脊髓直至大脑,调节机体的疼痛反应[20]。有研究表明,电针可通过调节miR-206-3p/BDNF通路发挥抗炎和抗凋亡作用,从而缓解神经性疼痛[21]。ZHAO等[22]研究表明电针治疗可通过抑制脊髓胶质细胞和TLR4/NF-κB通路减轻紫杉醇诱导的大鼠神经性疼痛。然而,脊髓背角线粒体自噬变化与电针镇痛效果的关系尚未得到充分的验证。本研究结果表明,电针提高了SNL大鼠的疼痛阈值,脊髓背角神经元结构明显改善,线粒体肿胀减轻,周围可见自噬溶酶体结构,无明显坏死或凋亡现象。同时电针治疗抑制了SNL大鼠Keap1的蛋白表达量,促进了Nrf2、NIX、BNIP3蛋白表达量。这些结果提示电针的镇痛作用可能部分是通过Keap1/Nrf2信号通路促进线粒体自噬达到的。
综上所述,电针的镇痛作用可能与Keap1/Nrf2信号通路参与的线粒体自噬有关。但其具体机制有待于后续应用Keap1/Nrf2抑制剂或基因敲除技术进行进一步研究。
