物质结构与性质核心考点测试题(A卷)参考答案
2023-05-28
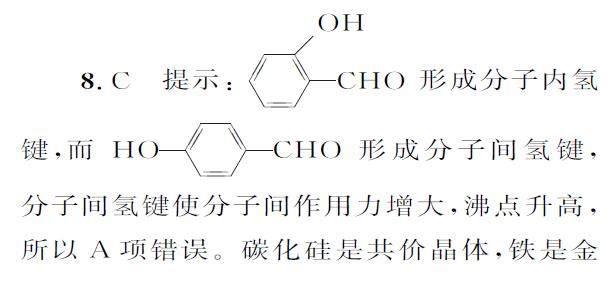

1.B 提示:AlCl3 中心原子价层电子对数为3+1/2(3-1×3)=3+0=3,其价层电子对互斥模型为平面三角形,故A 项错误。H2O 分子是“V”形结构,故C项错误。Ni原子的原子序数为28,其基态原子的价电子排布为3d84s2,故D项错误。
命题意图:本题考查常见化学用语的规范书写与判断,要求考生熟练掌握原子结构的表示的各种方法,能够应用价层电子对互斥理论判断物质的空间构型,考查考生对化学学科基本概念和基础理论的理解与认识。
2.C 提示:A 项中光谱应为发射光谱。电子云通常是用小黑点来表示电子出现的机会多少,但小黑点不表示电子,B 项不正确。d区元素的基态原子都含有d轨道电子,故C项正确。22Ti的电子排布式1s22s22p63s23p10违反了能量构造原理,故D项不正确。
命题意图:本题考查考生对电子云与原子轨道的概念的理解,以及对电子排布式的书写的基本原理的辨析,检验考生灵活应用基础知识的能力。
3.C 提示:SO3 中S上的孤电子对数为1/2×(6-3×2)=0,σ键电子对数为3,价层电子对数为3,SO3 的空间构型为平面正三角形,分子中正负电中心重合,SO3 属于非极性分子;NF3 中N 上的孤电子对数为1/2×(5-3×1)=1,σ键电子对数为3,价层电子对数为4,NF3 的空间构型为三角锥形,分子中正负电中心不重合,NF3 属于极性分子,A 项错误。SO23- 的孤电子对数为1,CO23- 的孤电子对数为0,所以SO23- 的空间构型为三角锥形,CO23- 的空间构型为平面三角形,B项错误。非金属性N>P>As,因此氢化物的还原性由强到弱的顺序为AsH3、PH3、NH3。NH3、PH3、AsH3 分子中,N、P、As均形成3个共用电子对和1 个孤电子对,原子半径As>P>N,键长As—H>P—H>N—H,因此σ键电子对之间的排斥力由强到弱的顺序为N>P>As,即键角由大到小的顺序为NH3、PH3、AsH3,C 项正确。ClO- 3 的中心原子Cl 有3 个σ 键,孤电子对数为(7+1-3×2)/2 =1,价电子对数为4,故D 项错误。
命题意图:本题是对价层电子对互斥理论的具体应用,对分子的极性、微粒的空间结构、键角的大小比较以及中心原子价电子数的计算方法进行考查,检验考生利用所学知识,解决问题的能力。
4.A 提示:1个C2H4O 中含有6 个σ键和1 个π 键(乙醛)或7 个σ键(环氧乙烷),4.4 g C2H4O 的物质的量为0.1 mol,则含有σ键数目最多为0.7NA,A 项正确。一个CO2 分子含有2个π键,题中没有说是标准状况条件下,气体摩尔体积未知,无法计算π键个数,B项错误。根据N60 分子结构图可知,一个氮原子平均1.5条键,28 g N60 即含有2 mol氮原子,含有的N—N 数目为3NA,C项错误。金刚石中每个碳原子与4个其他碳原子相连,两个碳原子共用一条键,1 mol金刚石实际拥有2 mol碳碳键,则12 g金刚石中含有的共价键数目为2NA,故D 项错误。
命题意图:本题设计了高考常见题型中以物质结构为中心的关于NA 的考点,主要体现在不同条件下对σ键、π键的计算方法,考查考生对共价键类型的判断以及对均摊法的应用能力。
5.A 提示:X、Y、Z、W 四种短周期主族元素,原子序数依次增大。X、Y 与Z位于同一周期,且只有X、 Y 元素相邻。X基态原子核外有2个未成对电子,则X为C,Y 为N,Z为F,W 原子在同周期中原子半径最大,则W 为Na。
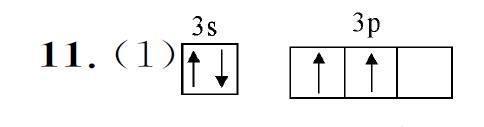
根据同周期从左到右第一电离能呈增大趋势,但第ⅡA 族大于第ⅢA 族,第ⅤA 族大于第ⅥA 族,则第一电离能Z>Y>X,故A项错误。根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,则电负性Z>Y>X>W,故B项正确。根据同电子层结构“核多径小”,则Z、W 原子形成稀有气体电子构型的简单离子的半径W 命题意图:本题是对元素周期表与元素性质的考查,具体体现在对元素的第一电离能、电负性以及离子半径大小的比较,建立基于“位”“构”“性”关系的系统思维框架,可提高分析和解决问题的能力。 6.C 提示:配合物[TiCl(H2O)5]Cl2·H2O中配位体是Cl- 和H2O,配位数是6,故A 项错误。该配合物的中心离子是Ti3+ ,故B项错误。配合物内界和外界中Cl- 的数目比是1∶2,故C项正确。加入足量AgNO3 溶液,外界离子Cl- 与Ag+ 反应,内界离子Cl- 不与Ag+ 反应,1 mol该配合物只能生成2 molAgCl沉淀,故D项错误。 命题意图:考查配合物的基础知识,对配位体、配位数、中心离子进行辨别,进一步强化了内界与外界离子与相关反应的联系,注重考查考生对基本概念的迁移理解与实际应用能力。 7.B 提示:C 和O 分别失去一个电子后的价层电子排布式为2s22p1 和2s22p3,O的2p能级是半充满结构,比較稳定,所以O的第二电离能大于C 的第二电离能,A 项错误。杯酚分子中含有苯环结构,具有大π键,B项正确。C60 中只含有C元素,无法形成氢键,C 项错误。金刚石是共价晶体,C60 为分子晶体,D项错误。 命题意图:以新物质超分子为情境素材,从原子、分子、晶体等角度考查考生获取信息与应用信息解决问题的能力。 碳化硅是共价晶体,铁是金属晶体,氯化钠是离子晶体,C60 是分子晶体,则硬度碳化硅>铁>氯化钠>C60,B项错误。 BN 为原子晶体,MgBr2 为离子晶体,SiCl4 为分子晶体,故熔点BN>MgBr2>SiCl4 ,C 项正确。有手性异构体的分子被称为手性分子,当分子中存在两个或两个以上的手性碳原子时,会出现内消旋体,这种含有内消旋体的分子不是手性分子,D项错误。 命题意图:考查考生对物质熔沸点大小的判断,区分分子间氢键与分子内氢键对物质沸点的影响,强化对手性分子的理解,考虑内消旋体的情况,丰富了考生的认识,同时比较了不同类型的晶体在硬度上的区别,巩固了对晶体类型的判断。 命题意图:考查原子分数坐标和晶胞计算,考生通过分析晶胞的堆积模型,用均摊法找到各原子的个数关系,并应用公式进行常见晶胞的密度计算,提升了考生证据推理与模型认知的能力。 (2)共价晶体 sp3 高 (3)SiCl4 SiX4 都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大 正四面体形 (4)A、B 提示:(1)硅元素的原子序数为14,价电子排布式为3s23p2,则价电子排布图为 (2)与金刚石类似,该晶体属于共价晶体;每个C 原子与4 个Si原子形成4 个σ键,C原子没有孤电子对,所以C的杂化类型为sp3;原子晶体的熔点取决于共价键的强弱,晶体硅和碳化硅都是原子晶体,碳原子的原子半径小于硅原子,非金属性强于硅原子,碳硅键的键能大于硅硅键、键长小于硅硅键,则碳硅键强于硅硅键,碳化硅的熔点高于晶体硅。 (3)由题给熔沸点数据可知,0 ℃时,四氟化硅为气态,四氯化硅为液态,四溴化硅、四碘化硅为固态;分子晶体的沸点取决于分子间作用力的大小,SiX4 都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大,则SiX4 的沸点依次升高;SiX4分子中硅原子的价层电子对数为4,孤对电子对数为0,则分子的空间构型为正四面体形。 (4)电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,可推知分别为基态Si原子、Si+ 离子、激发态Si原子。激发态Si原子有四层电子,Si+ 离子失去了一个电子,根据微粒电子层数及各层电子数多少可推知,微粒半径:③>①>②,选项A 正确。根据上述分析可知,电子排布属于基态原子(或离子)的是①②,选项B 正确。激发态Si原子不稳定,容易失去电子;基态Si原子失去一个电子是硅的第一电离能,Si+ 离子失去一个电子是硅的第二电离能,由于I2>I1,可以得出电离一个电子所需最低能量:②>①>③,选项C错误。由C 可知②比①更难失电子,则②比①更容易得电子,即得电子能力:②>①,选项D错误。 命题意图:以硅元素为载体对原子结构和分子性质进行综合考查,宏观上注重知识的整体性与联系性,微观上问题设置注重培养考生思维的灵活性。 12.(1)①F的电负性大于N,N—F成键电子偏向F,导致NF3 中的N 原子核对孤电子对的吸引力增强,难以形成配位键②A、C (2)①[Co(NH3)6]Cl3 [Co(NH3)4Cl2] Cl ②6 (3)①非极性分子 ②sp3d 10 提示:(1) ①F 的电负性大于N,N—F成键电子偏向F,导致NF3 中的N 原子核对孤电子对的吸引力增强,难以形成配位键,故NF3 不易与Cu2+ 形成配离子。②阴、阳离子之间存在离子键,非金属元素之间存在共价键,含有空轨道和含有孤电子对的原子之间存在配位键,水分子之间存在氢键,该配合物中含有离子键、配位键、共价键和氢键,故A项错误。该复合物中Cl原子含1对共用电子对和3个孤电子对,所以其价层电子对数是4,根据价层电子对互斥模型判断Cl的杂化类型为sp3,故B项正确。该复合物中Cl、CO 和H2O 为配体,故C项错误。CO 与N2的价层电子总数相同,为等电子体,等电子体结构和性质相似,所以其结构式为C≡O,故D项正确。 (2)①每个CoCl3·6NH3 分子中有3个Cl- 为外界离子,配体为6个NH3,化学式为[Co(NH3)6]Cl3;每个CoCl3·4NH3(绿色和紫色)分子中有1个Cl- 为外界离子,配体为4 个NH3 和2 个Cl- ,化学式均为[Co(NH3)4Cl2]Cl。②这几种配合物的化学式分别是[Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl,其配位数都是6。 (3)①Fe(CO)5 结构对称,是非极性分子。 ②铁的杂化轨道数为5,Fe(CO)5 中Fe原子是以sp3d 杂化方式与CO 成键,碳与氧、铁与碳之间均形成配位键,1 molFe(CO)5 含有10 mol配位键。 命题意图:以铁、钴及铜的重要配合物为载体,承载了化学学科必备知识,从形成配合物的离子,配体、配合的化学性质,所含共价键的类型、数目、原子的杂化类型等角度,对配合物进行综合性的考查,强化了化学学科思维的考查。 提示:(1)Ti为22号元素,钛有2个未成对电子,Mn为25号元素,锰有5个未成对电子,所以基态Ti和Mn原子中未成对电子数之比为2∶5。 (2)二氧化碳为直线型,结构式为O=C=O ,没有孤电子对,碳原子采取 sp杂化,—CHO 中碳原子形成3个σ键,没有孤电子对,杂化轨道数目为3,碳原子采取sp2 杂化。 (3)HCHO 中碳原子含有3个σ键,碳原子采取 sp2 杂化,不含孤电子对,所以其空间构型是平面三角形。 (4)面心立方晶胞中原子位于顶点和面心,俯视时上下底面的面心原子位于俯视图正方形中心,顶点原子位于正方形顶点,其他侧面的原子位于正方形四边中点,故俯視图为c。 (5)铁是26号元素,其原子核外有26个电子,Fe原子的3d、4s电子为其价电子,其价电子排布为3d64s2。 (6)乙二醇分子中羟基比丙醇分子中的羟基多,分子间的氢键比丙醇的多,分子间的作用力较大,故其沸点较高。 (7)由图可知,2个Cl原子在晶胞内部,4个Cl原子在晶胞的边上,则该晶胞中Cl原子数目为2+4×1/2=4,则晶胞的质量m =nM =4M/NAg,晶胞体积V =abc×10-21cm3 =0.72×1.0×0.56×10-21cm3,晶体密度ρ=m/V = 4M ×1021/1.0×0.72×0.56×NAg·cm-3。 命题意图:本题考查物质结构与性质,涉及核外电子排布、化学键、分子构型、晶胞计算等内容,其中晶胞计算为解题难点,需要结合均摊法进行分析。 (责任编辑 谢启刚)
