MTHFR 基因多态性对低剂量甲氨蝶呤单药治疗低危妊娠滋养细胞肿瘤疗效与药品不良反应的影响*
2023-05-26倪文琳吴颖其
倪文琳,童 彤,吴颖其△
(1. 安徽省铜陵市妇幼保健院,安徽 铜陵 244000; 2. 安徽省立医院,安徽 合肥 230001)
妊娠滋养细胞肿瘤(GTN)包括侵蚀性葡萄胎和绒癌[1]。侵蚀性葡萄胎恶性程度一般不高,预后较好,而绒癌反之。低危[国际妇产科联盟(FIGO)妇科肿瘤委员会临床分期(简称FIGO 分期)中预后评分(简称FIGO 评分)小于6 分]妊娠滋养细胞肿瘤(LR- GTN)多采用单药治疗[2-3]。2018 年的FIGO 癌症报告和美国国立综合癌症网络(NCCN,2020 年)推荐LR - GTN 可选择的药物均主要为甲氨蝶呤(MTX)。MTX 属叶酸还原酶抑制剂,最少引起严重毒性[4]。亚甲基四氢叶酸还原酶(MTHFR)是人体叶酸代谢中的重要酶。有研究显示,MTHFR基因多态性可降低酶活性,引起叶酸缺乏,从而导致细胞周期不正常等系列异常生化反应,增加MTX清除及使用风险[5]。大量证据表明,MTHFRC677T 位点与A1298C 位点的基因多态性与高剂量MTX 在血液系统疾病中出现的药品不良反应(ADR)存在关联[6-8]。在类风湿关节炎的治疗过程中,MTHFR基因多态性与ADR 相关[9-11]。但目前未见关于MTHFR基因多态性对低剂量MTX治疗LR-GTN的疗效与ADR影响的研究。因此,本研究中探讨了MTHFR基因多态性对低剂量MTX 治疗LR-GTN 的疗效和ADR 的影响,以期为患者提供个体化用药服务。现报道如下。
1 资料与方法
1.1 一般资料
选取安徽省立医院2017 年9 月至2021 年9 月收治行MTX 单药治疗的LR -GTN 患者30 例,排除FIGO 评分≥7 分,单用MTX 前采取其他化学药物治疗(简称化疗)方案,采用MTX 周给药法或MTX 8 日给药法的患者。患者侵蚀性葡萄胎含Ⅰ期6 例,Ⅲ期22 例;绒癌含Ⅰ,Ⅲ期各1 例。详见表1。本研究经安徽省立医院医学伦理委员会批准,患者签署知情同意书。
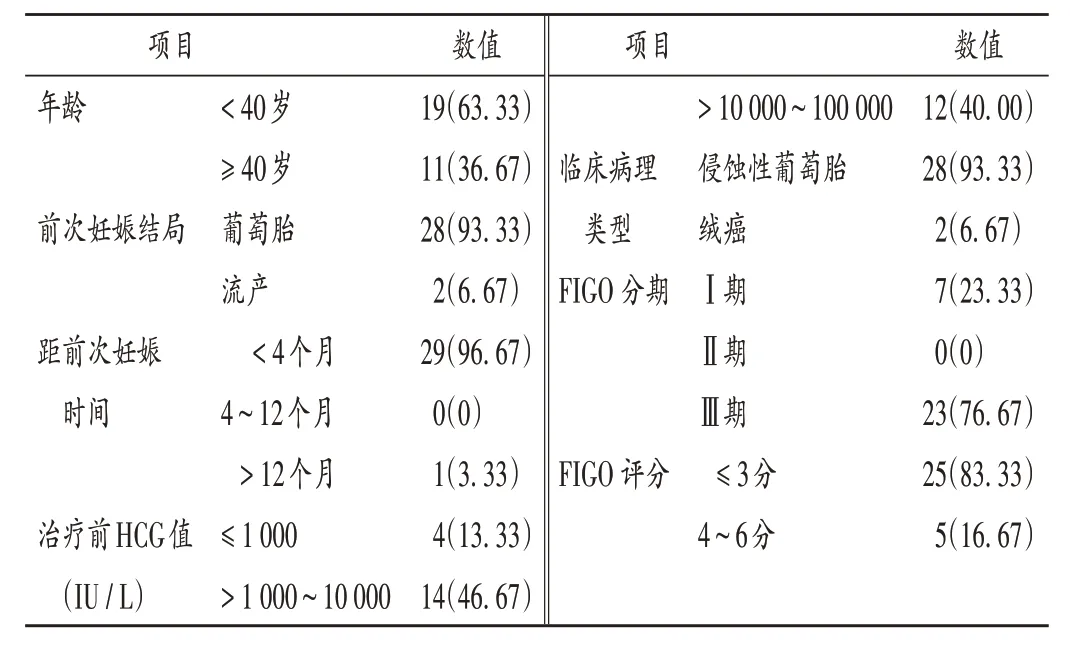
表1 患者一般资料[例(%),n=30]Tab.1 General data of patients[case(%),n=30]
1.2 MTHFR 基因多态型测定和治疗方法
治疗前,采用乙二胺四乙酸(EDTA)抗凝管采集患者静脉血2 mL,应用DNA 提取试剂盒提取DNA(安徽省立医院基因检测室),置- 20 ℃冰箱保存。采用聚合酶链式反应(PCR)法检测MTHFR基因型,并进行焦硫酸测序。根据C677T 及A1298C 双位点的基因型将MTHFR 酶活性进行分类,详见表2。采用MTX 5 日疗法,予注射用甲氨蝶呤(山西普德药业有限公司,国药准字H14022462,规格为每支500 mg∶20 mL)0.4 mg/(kg·d),肌肉注射[12]。以人绒毛膜促性腺激素(HCG)降到2 IU/L 并维持2~3 个疗程为缓解,并以缓解定义为有效;未缓解、耐药及更换药物为无效。参照美国卫生及公共服务部颁布的常见不良事件评价标准(CTCAE)5.0 版对骨髓抑制、口腔黏膜炎、肝损伤等不良反应进行分级。
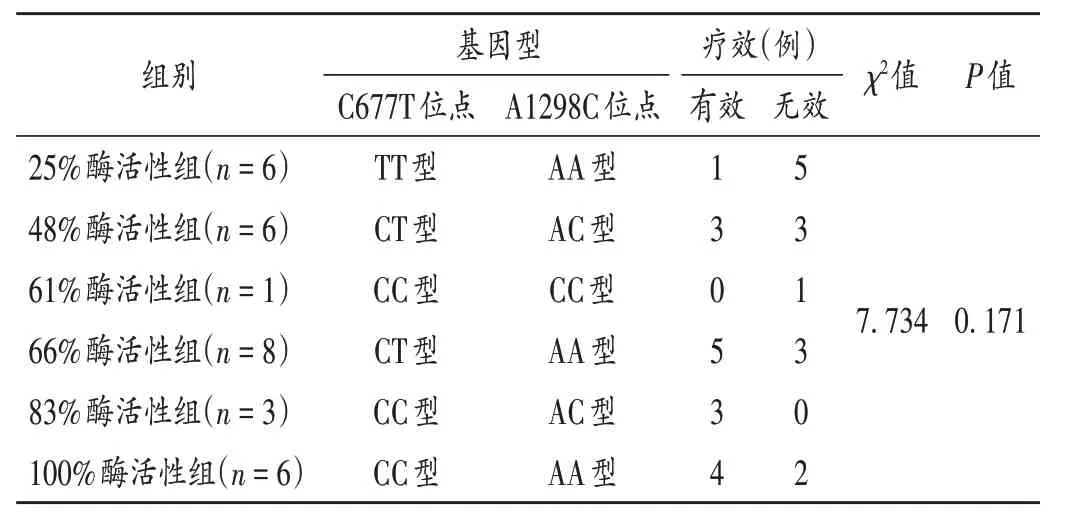
表2 不同MTHFR酶活性患者MTX疗效Tab.2 Efficacy of MTX in patients with different activities of MTHFR enzyme
1.3 统计学处理
采用SPSS 25.0 统计学软件分析。计数资料以率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
16例(53.33%)患者达缓解。MTHFR 不同的酶活性组间MTX 疗效无显著差异(P>0.05)。MTHFRC677T(χ2=4.439,P=0.109)及A1298C(χ2=1.875,P=0.392)位点的不同基因型间MTX 疗效无显著差异。详见表2、表3。14 例(46.67%)患者因不良反应严重、耐药而更换治疗方案;发生ADR 28 例(96.67%),Ⅰ-Ⅳ级均有涉及,详见表4。25%,48%,61%,66%,83%,100%酶活性组分别发生ADR 11例次(36.67%)、16例次(53.33%)、1 例次(3.33%)、14 例次(46.67%)、8 例次(26.67%)、14 例次(46.67%)。发生率排名前3 的ADR 为骨髓抑制、口腔黏膜炎和肝损伤,MTHFR不同的酶活性组间骨髓抑制(χ2= 2.050,P= 0.842),口腔黏膜炎(χ2=4.887,P= 0.430)和肝损伤(χ2= 3.047,P= 0.693)的发生率均无显著差异,详见表5。MTHFRC677T 位点各基因型组间骨髓抑制(χ2= 1.544,P= 0.462),口腔黏膜炎(χ2= 1.707,P= 0.426)和肝损伤(χ2= 0.268,P=0.875)的发生率均无显著差异。MTHFRA1298C位点各基因型组间骨髓抑制(χ2= 0.932,P= 0.628),口腔黏膜炎(χ2= 3.303,P= 0.192)和肝损伤(χ2= 1.875,P=0.392)的发生率均无显著差异。详见表6。
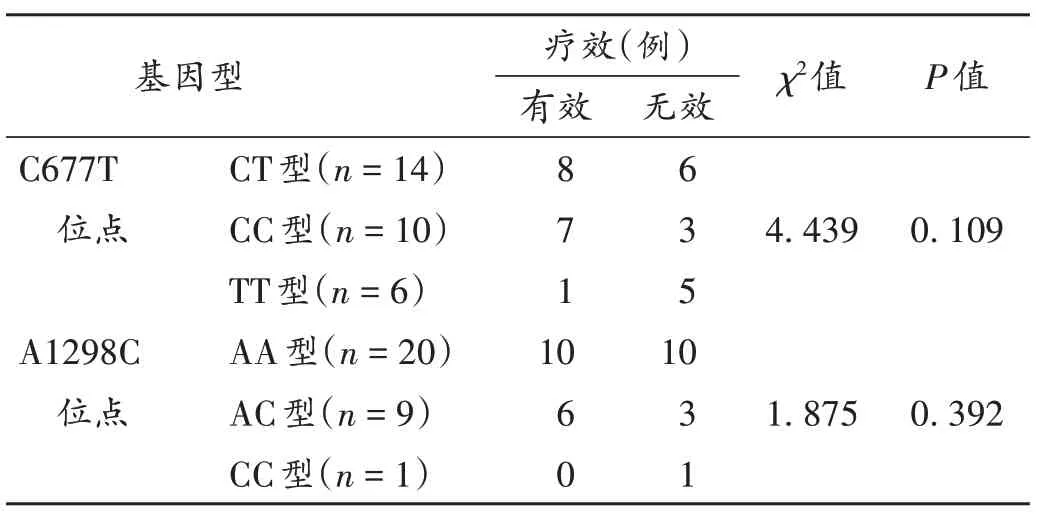
表3 不同MTHFR基因分型患者MTX疗效(例,n=30)Tab.3 Efficacy of MTX in patients with different genotypes of MTHFR(case,n=30)

表4 患者药品不良反应发生情况[例(%),n=30]Tab.4 Incidence of ADRs in patients[case(%),n=30]

表5 不同MTHFR酶活性患者药品不良反应发生情况[例(%)]Tab.5 Incidence of ADRs in patients with different activities of MTHR enzyme[case(%)]

表6 不同MTHFR基因分型患者药品不良反应发生情况[例(%),n=30]Tab.6 Incidence of ADRs in patients with different genotypes of MTHFR[case(%),n=30]
3 讨论
FIGO/ 世界卫生组织(WHO)制定了GTN 临床分期,并建议预后评分≤6分的Ⅰ-Ⅲ期低危患者予单药化疗。虽然对LR-GTN 单药化疗耐药后予更改化疗方案绝大部分患者仍有效,但会给患者带来更多的药品不良反应,影响将来生育,增加住院费用,延长住院时间等[13]。MTX 为LR - GTN 一线治疗药物,临床研究发现,5 d 给药方案至今仍是包括耶鲁研究中心等在内的多个医学中心的标准治疗方案[12,14],其缓解率最高,毒副作用相对较低。但对MTX,4.00%~46.73%的患者产生耐药性,1.41%~3.69%的患者产生难以忍受的毒性反应,需挽救性化疗甚至手术[15]。因此,治疗效果和毒性间的平衡仍是MTX临床使用中亟待解决的问题。
QU 等[16]首次报道了GTN 患者肿瘤组织中MTHFRC677T 与MTX 的耐药有关,这一发现将MTHFR基因多态性与MTX 疗效联系在一起。进一步研究表明,编码叶酸代谢酶的基因多态性,特别是2 个常见的非同义SNPs677CNT 和1298ANC,与MTHFR 酶活性改变相关,影响MTX 的疗效和毒性[17]。本研究中,首先根据患者MTHFRC677T 及A1298C 双位点的基因型进行MTHFR酶活性分类,发现MTX 的疗效和ADR 发生率与酶活性无明显关联。进一步分析单个基因型与MTX 疗效和不良反应的关联,同样发现两者关联性不强。白小红等[18]的研究中采用大剂量MTX 治疗急性淋巴细胞白血病患儿,结果发现CC 型患儿胃肠道反应、黏膜损伤等ADR发生率均显著低于AA 型患儿和AC 型患儿。鉴于本研究中CC 型患儿仅1 例,尚需扩大样本以进一步确认MTHFRA1298C 基因多态性对MTX 单药治疗低危LRGTN ADR的影响。
在使用MTX 治疗时应根据MTHFR基因多态性给予临床指导。低剂量MTX 在治疗MTHFR突变患者的植入性胎盘时,MTHFR 的遗传多态性可能是严重毒性作用预测指标之一[19]。史天陆等[20]的研究发现,C677T突变型更易发生骨髓抑制,A1298C 野生型的患者更易发生白细胞减少。但近期的研究证据提示MTHFR基因多态性检测临床效用较低,日本[16]和欧洲[21]的两项临床研究均发现MTHFR基因多态性无法预测MTX 的疗效。MTX 进入机体后,其代谢和排泄过程受到许多重要的酶和转运蛋白(如FPGSG 和GGHSLCO1B1 等)影响[5],但目前的证据尚无法表明这些酶和转运蛋白基因多态性对MTX 在体内的治疗作用和ADR 发生率的影响。美国医学遗传学和基因组学学会(ACMG)实践指南[22]明确指出,MTHFR基因多态性检测对MTX 临床应用指导效果的影响很小,且MTX 膜转运蛋白(流入和/ 或流出)被认为是MTX 发挥疗效的主要决定因素[23],故临床在使用MTX 治疗时可能无需检测MTHFR基因多态性。
MTX 药品说明书(国内、欧美)中未推荐MTX 治疗与代谢基因多态性相关联。大量证据表明,MTX 的吸收、分布、代谢和排泄过程存在较大的个体差异,少数患者MTX 血药浓度偏高,维持时间较长,这是其导致ADR 发生的主要因素[24-25]。故在使用MTX 进行治疗时,血药浓度监测已被临床广泛认可[26]。刘娟等[27]的研究显示,在使用MTX 治疗侵蚀性葡萄胎过程中,以血药浓度监测结果为依据开展个体化用药治疗,能有效控制ADR 发生率,且MTX 毒性取决于体内药物浓度超过阈浓度(0.2 μmol/ L)的持续时间,而非体内药物峰浓度[27]。
综上所述,本研究中发现MTHFR中C677T 和A1298C 基因多态性对低剂量MTX 治疗LR-GTN 的疗效与ADR 未产生影响。故建议临床不应根据MTHFR基因多态性结果指导MTX 的个体化用药。但鉴于本研究的样本量较少,MTHFR基因多态性对MTX 单药治疗LR - GTN 的疗效与ADR 发生率的影响尚需进一步扩大样本量加以确认。
