白细胞介素-1β 通过IL-6/JAK2/STAT3轴促进脑胶质瘤细胞的侵袭
2023-05-26陈硕硕束汉生
王 棒,吴 娟,陈硕硕,程 哲,束汉生
(蚌埠医学院第二附属医院 神经外科,安徽 蚌埠233000)
脑胶质瘤是起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤。我国脑胶质瘤约一半为恶性程度最高的胶质母细胞瘤(GBM)。高级别胶质瘤由于增殖率高、肿瘤细胞高度异质性和弥漫浸润等特点,尽管目前采用了以手术为主,结合放化疗、免疫治疗、电场治疗等综合治疗手段,但治疗效果仍不理想,其中胶质母细胞瘤患者的中位生存期仅为14.4月,5年生存率约为5.5%[1-3]。目前已经有大量的研究揭示了胶质瘤可能的发病机制[4-5],但其确切发病机制仍不明确,因此,需要寻找胶质瘤治疗的新靶点。
肿瘤微环境中白细胞介素1β(IL-1β)和白细胞介素6(IL-6)的增加会导致肿瘤的显著进展[6]。有研究指出,胶质瘤微环境中含有的大量的免疫细胞、血管内皮细胞和肿瘤干细胞等,可分泌大量的炎症因子,比如细胞因子IL-1β、IL-6、白细胞介素23(IL-23)和肿瘤坏死因子(TNF)等。这些炎症因子可调控胶质瘤细胞的生长、侵袭等,甚至使胶质瘤抵抗放化疗[7-8]。IL-1β是一种强有力的促炎细胞因子,产生IL-1β的肿瘤患者一般预后较差[9]。有研究指出其在体内外均可促进胶质瘤细胞的增殖[10]。IL-6亦是一种关键的促炎细胞因子,可以直接刺激肿瘤细胞的增殖、转移、侵袭及血管生成等,其在慢性炎症、大量的造血系统恶性肿瘤以及实体肿瘤患者中水平均有所升高[11-12]。
之前有研究指出IL-1β可以刺激神经胶质瘤细胞中核因子κB(NF-κB)、p38丝裂原活化蛋白激酶(p38 MAPK)、细胞外信号调节激酶 1/2(ERK1/2),以及信号转导和转录激活因子(STAT3)等因子的激活[13]。与此同时,IL-6/JAK2/STAT3信号通路已被证实在多种人类癌症的生长和发展中起着关键作用[14]。因此,IL-1β能否通过IL-6/JAK2/STAT3轴促进脑胶质瘤细胞的恶性进展有待研究。
胶质瘤细胞极强的侵袭特性,是导致全切率低、术后复发及预后差的主要原因[15]。在本研究将运用多种分子生物学手段观察不同浓度的IL-1β对人脑胶质瘤细胞侵袭的影响,同时检测IL-6的生成及JAK2、STAT3等信号分子的表达情况。重点解析在胶质瘤细胞侵袭过程中IL-1β与IL-6的关系及其下游信号通路。
1 材料与方法
1.1 实验材料
重组人IL-1β蛋白、IL-6蛋白购自苏州novoprotein科技有限公司;重组人IL-6中和蛋白、酶标山羊抗兔IgG单克隆抗体、Lipofectamin2000购自美国Thermo Fisher Scientific;兔抗人抗体总JAK2(t-JAK2)、Phospho-JAK2-Tyr 221(p-JAK2)、总STAT3(t-STAT3)、Phospho-STAT3-Tyr705(p-STAT3)购自武汉Abclonal生物科技有限公司;Jak2 siRNA(si Jak2)、STAT3 siRNA(siSTAT3)和对照siRNA(siNC)购自上海吉玛科技有限公司;IL-1β、IL-6ELISA检测试剂盒购自深圳达科为公司;CCK-8试剂盒购自合肥BIOMIKY生物科技有限公司;人脑胶质瘤细胞株U87购自武汉赛诺普科技公司,U251、A172、正常人脑星形胶质细胞株NHA由苏州大学第二附属医院惠赠;细胞基础培养基DMEM、减血清培养基Opti-MEM、胎牛血清FBS和胰蛋白酶均购自美国 Gibco公司。
1.2 实验方法
1.2.1细胞培养
人脑胶质瘤细胞 U87、U251、A172和人星形胶质细胞 NHA均在含 10%胎牛血清的 DMEM完全培养基,温度为 37℃、CO2湿度为5%的细胞恒温培养箱中培养,当细胞生长到70%~80%左右时进行传代处理。
1.2.2细胞药物处理和分组
选择高表达IL-1β与IL-6的胶质瘤细胞为实验细胞,第一阶段用不同浓度的重组人IL-1β蛋白刺激胶质瘤细胞的浓度分组为0、0.2 ng/ml、2 ng/ml、20 ng/ml、200 ng/ml,孵育时间24 h。后期验证IL-1β与IL-6生成的关系分组为对照组(Ctrl)、IL-1β组(IL-1β)、IL-1β+IL-6组(IL-1β+IL-6)、IL-1β+IL-6中和蛋白组(IL-1β+Anti-IL-6),药物浓度分别为IL-1β 20 ng/ml,IL-6 100 ng/ml,IL-6中和蛋白1000 ng/ml,孵育时间24 h。
1.2.3细胞转染和分组
根据是否转染及转染 si-RNA的种类将每种细胞分成4组:空白对照组(IL-1β组,不转染,仅予以IL-1β刺激)、阴性对照组(IL-1β+siNC组,转染无意义的siNC序列),实验组1(IL-1β+siJAK2组,转染有意义的阳性siJAK2序列),实验组2(IL-1β+siSTAT3组,转染有意义的阳性siSTAT3序列)。A液:把5 μL siRNA加入到 250 μL的 opti-MEM减血清培养基中并摇晃混匀;B液:在 250 μL的 opti-MEM减血清培养基中加入5 μL Lipofectamine2000并轻轻混匀,室温静置 5 min;将A、B液混匀后室温静置18 min后将混合液分别滴加到各组,轻轻摇匀6孔板后置于恒温孵育箱中温育6 h,更换新鲜完全培养基,细胞继续培养 24 h后用于后续实验。
1.2.4ELISA测IL-1β与IL-6浓度
细胞(500 000/孔)接种于6孔板,2 ml完全培养基中培养。培养24 h后,用药物刺激细胞。给药后1天,每孔共加入100 μL样品,每个试验孔做3个复孔。加稀释后的Biotinylated antibody,盖上封板膜,孵育一定时间,洗板3次。加入稀释后的Streptavidin-HRP,洗板3次。加入TMB孵育20~30 min显色,显色深蓝色后加入Stop solution终止反应。终止反应10 min内酶标仪于波长450 nm处读板。
1.2.5Transwell小室实验检测细胞侵袭能力
取稀释后的生物基质胶 50 μL/孔匀称地铺于Transwell小室底层,放入培养箱孵育1 h待胶凝固。按组别分别取对数生长期的细胞,消化离心后用无血清不完全培养基进行重悬计数。5万细胞/孔加入无血清不完全培养基。培养1天后,细胞予以药物刺激或转染siRNA。24 h后取出小室,先用4%多聚甲醛固定15 min,再用结晶紫染液染色15 min,在 PBS中漂去多余染料,小心擦净小室上层内细胞,在倒置显微镜下拍照观察细胞形态和均匀度并计数。
1.2.6Western blot实验检测蛋白表达水平
收集细胞,使用RIPA裂解细胞,BCA法总蛋白定量。配制6%分离胶和5%浓缩胶,每孔加入等质量等体积目的蛋白(50 μg/10 μl),电压80 V时间30 min上层浓缩胶、电压120 V时间50 min下层分离胶电泳。转膜、洗膜、封闭,采用抗GAPDH、t-Jak2、p-JAK2、t-STAT3、p-STAT3一抗及山羊抗兔IgG二抗检测相应蛋白的表达。采用Image J软件分析条带的光密度值,每个条带重复3次,计算目的蛋白相对表达量。
1.3 统计学方法

2 结果
2.1 IL-1β、IL-6在胶质瘤细胞培养液中的表达情况及IL-1β刺激下IL-6的生成情况
ELISA结果显示,与NHA相比,U87、U251的培养液中IL-1β水平明显升高;与NHA相比,U87、U251、A172的培养液中IL-6水平均明显升高(图1A、B)。这表明某些胶质瘤细胞具有在体外自发分泌IL-1β和IL-6的能力。因此,选择表达水平高的U87、U251细胞进行后续实验。

图1 IL-1β、IL-6在人脑胶质瘤细胞培养液中的表达情况及IL-1β刺激下IL-6的生成情况
在U87、U251细胞中,IL-1β可以以剂量依赖性的方式促进IL-6的生成(图1C、D)。
2.2 IL-1β促进脑胶质瘤细胞的侵袭
Transwell小室侵袭实验表明,IL-1β可以以剂量依赖性的方式增强U87和U251细胞的侵袭能力(图2)。
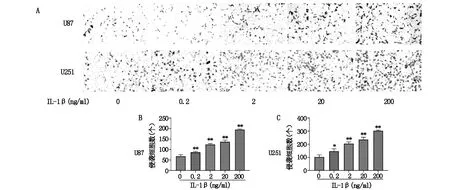
图2 不同浓度的IL-1β刺激下胶质瘤细胞侵袭能力的变化情况
2.3 IL-1β通过IL-6促进脑胶质瘤细胞的侵袭
Transwell小室实验表明,IL-6可以在IL-1β促进胶质瘤细胞侵袭的情况下进一步促进细胞侵袭,而IL-6中和蛋白可以显著地抑制IL-1β的促侵袭作用(图3)。这表明IL-1β是通过刺激IL-6的分泌来促进人脑胶质瘤细胞的侵袭的。

图3 改变IL-6含量后U87、U251细胞侵袭能力的变化情况
2.4 IL-1β通过IL-6/JAK2/STAT3轴促进脑胶质瘤细胞的侵袭
Western印迹实验结果表明,IL-1β可以促进JAK2和STAT3磷酸化蛋白的表达,IL-6可以进一步促进它们的表达,而IL-6中和蛋白则显著下调其表达水平。siJAK2可以下调JAK2和STAT3磷酸化蛋白的表达水平,而siSTAT3则不能下调JAK2磷酸化蛋白的表达水平,这验证了JAK2和STAT3之间的上下游关系(图4)。这表明IL-1β通过刺激IL-6的生成来促进JAK2/STAT3通路磷酸化蛋白的表达。

图4 不同条件下胶质瘤细胞内JAK2、STAT3磷酸化蛋白表达水平的变化
同时Transwell小室实验结果表明,下调JAK2、STAT3基因表达水平可以显著地地抑制IL-1β的促侵袭作用(图5)。这表明JAK2/STAT3通路是IL-1β促进人脑胶质瘤细胞侵袭所必需的。以上数据清楚地说明IL-1β是通过IL-6/JAK2/STAT3轴促进脑胶质瘤细胞的侵袭的。

图5 下调JAK2、STAT3表达水平后U87、U251细胞侵袭能力的变化情况
3 讨论
脑胶质瘤是一种致命性的脑肿瘤,近年来,关于脑胶质瘤的基础及临床研究有了一定进展,但病人的预后却没有因此明显改善[16-17]。分子标记、IDH突变、MGMT启动子甲基化、1p/19q共缺失、PTEN突变、EGFR扩增等,在调节肿瘤细胞增殖和侵袭等方面发挥着核心作用,且已经用于胶质瘤患者的分子病理学诊断、治疗选择和预后评估,针对这些分子标志物的许多神经胶质瘤疗法已被用于临床实验,但最终成功的寥寥无几[18],因此需要寻找新的治疗靶点。
针对胶质瘤微环境的研究是一种全新的思路。胶质瘤微环境中含有的大量的免疫细胞、血管内皮细胞和肿瘤干细胞等,可分泌大量的炎症因子和外泌体等,它们可以单独或协同调控肿瘤的生长[19]。IL-1β是一种多效性的细胞因子,是启动免疫反应的关键因子,同时它也是肿瘤微环境中的中心介质[20]。有研究指出,IL-1β对于恶性细胞的发生发展是必不可少的,恶性肿瘤细胞的进展与其分泌的IL-1β量密切相关[21-22]。IL-1β可由肿瘤间质中的细胞分泌,也可由恶性肿瘤细胞分泌。各种星形胶质细胞、恶性胶质瘤细胞均有在体内外自发产生皮克级的IL-1β的能力[23]。本研究证实,在细胞培养液上清中,NHA及胶质瘤细胞均能产生微量的IL-1β,且U87、U251细胞分泌的量较NHA明显增加,而A172细胞则变化不明显,这可能与不同胶质瘤细胞的恶性程度、基因突变不同有关。
IL-1 β几乎影响肿瘤进展的每一步[24],白细胞介素-1β在IL-1 β恶性胶质瘤中是一种肿瘤促进剂[25]。本研究证实, IL-1β可以以剂量依赖性的方式促进胶质瘤细胞的侵袭。
IL-1β除了在肿瘤发生发展中的直接作用外,它还通过上调其他促炎细胞因子,包括环氧化酶2(COX-2)、IL-6、IL-8等其他细胞因子等,以及增加血管生成来推动肿瘤的生长和进展[26]。其中IL-6已被证实是许多慢性炎症性疾病的强力驱动,同时它在许多癌症的发展中起着关键的作用[27]。本研究证实,在细胞培养液上清中,NHA及胶质瘤细胞均能产生微量的IL-6,且胶质瘤细胞分泌的量均较NHA明显增加。同时,IL-1β可以以剂量依赖性的方式促进IL-6的生成。在给予IL-1β刺激的基础上,发现IL-6可以进一步刺激胶质瘤细胞的侵袭,而IL-6中和蛋白则明显抑制了IL-1β的促侵袭作用。这表明IL-1β是通过刺激IL-6的分泌来促进胶质瘤侵袭作用的。
IL-1β介导的IL-6/STAT3和NF-κB这两个关键炎症信号通路的正反馈环被广泛认为是炎症和癌症之间的联系[28]。JAK2/STA3T信号是近年来发现的一条与细胞因子密切相关的细胞内信号转导通路,参与了细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程[29]。本研究发现,IL-1β可以促进JAK2、STAT3的磷酸化蛋白的表达,IL-6可以进一步促进它们的表达。进一步,通过小室实验发现敲低了JAK2、STAT3表达水平可以显著抑制胶质瘤细胞的侵袭能力。这说明在IL-1β/IL-6刺激胶质瘤细胞侵袭的过程中,JAK2、STAT3的激活是必需的。与此同时,敲低JAK2明显抑制了JAK2和STAT3蛋白的磷酸化,而敲低STAT3则对STAT3蛋白的磷酸化没有影响,这验证了JAK2和STAT3信号的上下游关系。以上数据表明,IL-1β是通过IL-6/JAK2/STAT3轴来促进胶质瘤细胞的侵袭的。
综上所述,本研究验证了IL-1β在体外脑胶质瘤细胞侵袭中的作用,并发现IL-1β是通过刺激IL-6的分泌来促进脑胶质瘤细胞侵袭的。同时,在暴露于IL-1β/IL-6的脑胶质瘤细胞侵袭过程中, JAK2/STAT3磷酸化蛋白的激活是必需的。总之,IL-1β通过IL-6/JAK2/STAT3轴促进脑胶质瘤细胞的侵袭作用。
