金汁粪菌移植对湿热型溃疡性结肠炎小鼠疾病活动指数及炎症反应的影响
2023-05-26杨苏琴葛巍张磊昌
杨苏琴,葛巍,张磊昌
江西中医药大学附属医院,江西 南昌 330006
溃疡性结肠炎(UC)是一种多因素起源的慢性炎症性肠病,其病因和发病机制尚不完全清楚。近几十年来,UC 发病率在我国呈上升趋势[1]。研究表明,UC 出现腹痛、血性腹泻以及肠道炎症可能与肠道微生物群与免疫系统间的相互作用相关[2],然而大多数治疗UC 的药物会干扰代谢和免疫反应,往往会引起一些严重的不良反应。因此,调节肠道菌群紊乱,恢复肠道微生物稳态成为治疗UC 的新策略,例如Sznurkowska 等[3]发现UC 患儿肠道炎症Treg细胞比例显著增加,采用益生菌缓解UC 取得了较好的效果[3-4]。粪菌移植(FMT)是近年开发的新治疗方式,该疗法将人体粪便功能菌通过口服或灌肠等方式转移到患者胃肠道,目的在于重塑肠道菌群结构,在多项大型研究中均表现出对UC 的积极作用[5]。中药金汁是最早应用于FMT 疗法的药物,具有清热解毒凉血的作用,研究表明其对肠道感染、肠道炎症、肠易激综合征、代谢综合征等具有一定的临床应用价值[6]。本研究的目的是探究金汁FMT 对湿热型UC 小鼠疾病活动指数以及炎症反应的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级C57BL/10 小鼠,6 周龄,体质量范围20±2 g,由江西中医药大学实验动物科技中心提供。
1.1.2 主要药品与试剂 葡萄糖硫酸钠(DSS,翌圣生物科技股份有限公司),美沙拉秦肠溶片(葵花药业集团佳木斯鹿灵制药有限公司,国药准字H19980148,规格:0.25 g),小鼠酶联免疫吸附剂测定(ELISA)试剂盒(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 动物分组和造模 将49 只C57BL/10 小鼠随机分为正常对照组和湿热型模型组各13 只(每组随机选取3 只进行模型验证),湿热型FMT 组和湿热型5-ASA 组各10 只,模型验证组3 只。造模方法对周长琳等[7]的方法进行了改良,除正常对照组小鼠和3 只模型验证小鼠外,其余小鼠饲养于独立通气笼盒系统,温度36℃,湿度80%,每天12 时给予高脂高糖饲料和2%DSS 蒸馏水溶液自由饮食;正常对照组小鼠普通环境饲养,给予普通饲料和饮用水;3 只模型验证小鼠普通环境饲养,给予普通饲料和2%DSS 蒸馏水溶液自由饮食。
所有小鼠连续饲养10 d 后进行模型验证,(1)观察小鼠一般情况,包括是否出现体质量降低、脓血便、腹泻、背毛无光泽、拱背、懒动、嗜睡、食欲不振、大便腥臭、肛周红肿、肛温升高等情况。(2)计算疾病活动指数(DAI),从体质量变化、大便性状、便血程度三个方面进行综合评分。评分标准:体质量减少百分率0、1~5、6~10、11~15、大于15分别对应0~4 分,大便性状正常、松散、腹泻分别对应0、2、4 分,便血阴性、+、++、+++和大出血分别对应0~4 分。DAI=(体质量减少分数+大便性状分数+便血分数)/3。(3)正常对照组和湿热型模型组每组随机选取3 只和3 只模型验证小鼠一同进行组织学病理观察,HE 染色观察结肠病理变化并进行组织病理评分。结合以上3 点进行综合分析判断造模是否成功。
1.2.2 药物干预方法 以正常对照组10 只非模型验证小鼠作为粪菌移植供体来源,提前制备粪菌液,收集正常对照组小鼠新鲜粪便,按1∶2 比例(g/mL)溶解于无菌磷酸缓冲盐溶液(PBS)中,经多次网筛过滤(10 目、20 目、32 目、50 目)所得滤液以6 000 r/min 离心15 min 获得菌体,无菌PBS 清洗菌体3 次后,25 mL 无菌PBS 重悬菌体制成粪菌液,-4 ℃保存。
模型验证后开始药物干预,各组均改为普通环境普通饲料饲养,正常对照组不做任何处理,湿热型模型组予以0.2 mL 无菌PBS 灌肠,湿热型FMT 组小鼠予以0.2 mL 粪菌液灌肠,湿热型5-ASA 组予以美沙拉秦PBS 溶液(0.26 g/kg)灌肠。小鼠乙醚麻醉后,用预先涂抹液状石蜡的塑胶软管插入小鼠肛门至结肠,倒置小鼠并灌肠,灌肠后拔出塑胶管用棉签轻压肛门促进闭合,小鼠保持倒置状态60 s,2次/d,治疗10 d,进行DAI 评价后处死,沿腹正中线打开腹腔,分离结肠段并分为两部分,分别用作组织病理检测和细胞因子检测。
1.2.3 疗效指数计算 末次治疗1 h 后计算各组小鼠疗效指数,评估治疗后各组小鼠DAI 得分并根据尼莫地平法计算FMT 和5-ASA 的疗效指数,疗效指数=(DAI 治疗前-DAI 治疗后)/DAI 治疗前×100%。
1.2.4 HE 染色观察病理变化 将结肠组织固定于4%多聚甲醛中48 h 后修整组织块(1 cm2),常规脱水透明后采用石蜡包埋,制作3 μm 厚连续切片,用苏木精和伊红染色,再进行梯度乙醇水化和透明后,用树脂封片,显微镜下观察结肠组织病理变化并进行组织病理评分。评分标准:无炎性浸润为0 分;轻度炎性浸润为1 分;中度炎性浸润,轻微出血为2 分;高度炎性浸润,存在出血性溃疡,结肠壁增厚,杯状细胞减少,隐窝部分性破坏为3 分;出现跨壁炎性浸润,杯状细胞大量减少,组织大面积纤维化,隐窝大量破坏为4 分。
1.2.5 ELISA 检测结肠组织细胞因子 将结肠组织进行匀浆,检测结肠组织INF-γ、IL-2、IL-4、IL-17、TGF-β、IL-10 水平,操作方法严格按照试剂盒要求进行,设置3 复孔取平均值,最后在酶标仪上检测450 nm 波长吸光度并计算细胞因子水平。
1.3 统计学方法
2 结果
2.1 湿热环境和高脂高糖饮食促进UC 进展
造模后,模型验证组和湿热型模型组小鼠均出现了明显体质量降低、大便不成形甚至腹泻、活动度降低、食欲不振、背毛无光泽等情况,其中湿热型模型组小鼠有2 只有明显脓血便、大便腥臭和肛温升高的情况。比较3 组小鼠的结肠组织病理损伤情况,正常对照组小鼠结肠组织无明显异常,模型验证组小鼠出现明显炎性浸润,以单核细胞为主,局部黏膜出现水肿、溃疡、肠壁增厚和隐窝损伤,而湿热型模型组小鼠上述表现进一步加重。与正常对照组比较,模型验证组小鼠DAI 指数和HPS 评分均升高(P<0.05),体质量显著降低(P<0.05),与模型验证组比较,湿热型模型组小鼠DAI 指数和组织病理评分均升高(P<0.05),体质量显著降低(P<0.05)。见图1、表1。
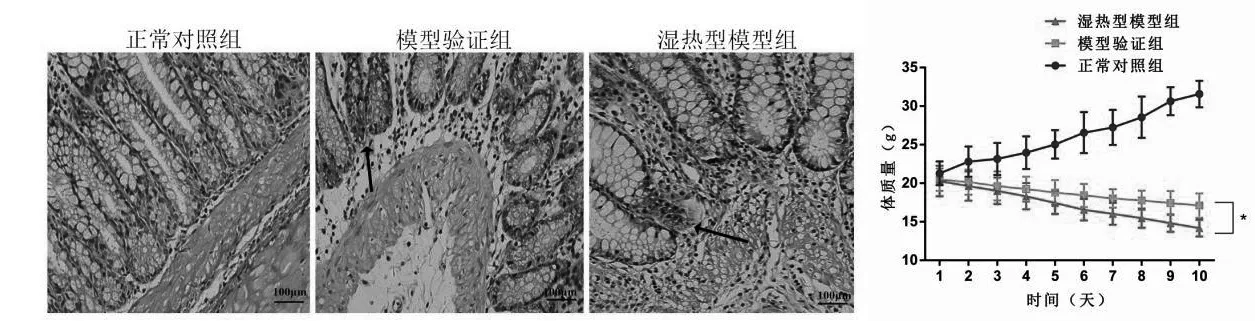
图1 小鼠结肠组织病理HE染色图(×400)和体质量变化(n=3)
表1 小鼠DAI指数和组织病理评分比较()

表1 小鼠DAI指数和组织病理评分比较()
注:与正常对照组比较,aP<0.05;与模型验证组比较,bP<0.05。
2.2 金汁FMT 减轻DSS 诱导的UC 小鼠症状
实验过程中各组均无小鼠死亡。治疗期间,与正常对照组比较,湿热型模型组小鼠体质量显著降低(P<0.05),DAI 指数升高(P<0.05);与湿热型模型组比较,湿热型FMT 组和湿热型5-ASA 组小鼠体质量呈先缓慢降低后升高趋势(P<0.05),DAI指数降低(P<0.05);湿热型FMT 组疗效指数显著高于湿热型5-ASA 组(P<0.05)。见图2、表2。

图2 各组小鼠治疗期间体质量变化情况
表2 各组小鼠DAI指数和疗效指数比较()
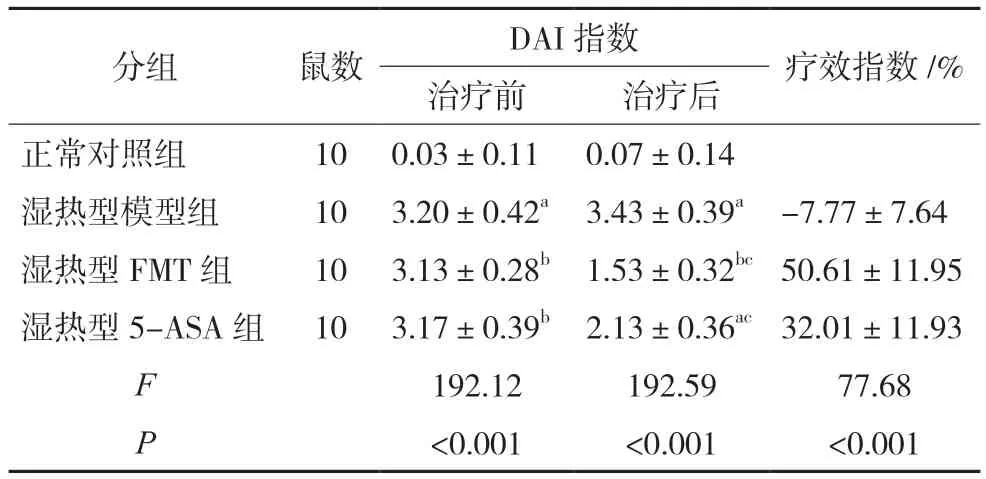
表2 各组小鼠DAI指数和疗效指数比较()
注:与同时间正常对照组比较,aP<0.05;与治疗前同组比较,bP<0.05;与同时间湿热型模型组比较,cP<0.05。
2.3 金汁FMT 减轻DSS 诱导的UC 小鼠结肠病理损伤
治疗后观察各组小鼠结肠组织病理情况。正常对照组肠壁结构完好无异常,隐窝无破坏;湿热型模型组炎性浸润加重,肠壁黏膜层增厚并出现溃疡出血点;湿热型FMT 组和湿热型5-ASA 组炎性浸润有明显改善,隐窝破坏程度减轻。见图3。

图3 各组小鼠结肠组织病理变化(×200)
2.4 各组小鼠结肠组织细胞因子水平比较
治疗后,与正常对照组比较,湿热型模型组小鼠结肠组织INF-γ、IL-2、IL-4 和IL-17 水平均上升(P<0.05),TGF-β 和IL-10 水平降低(P<0.05);与湿热型模型组比较,湿热型FMT 组和湿热型5-ASA 组小鼠结肠组织INF-γ、IL-2、IL-4 和IL-17 水平均降低(P<0.05),TGF-β 和IL-10 水平升高(P<0.05)。见表3。
表3 各组小鼠结肠组织细胞因子水平比较() pg/mL

表3 各组小鼠结肠组织细胞因子水平比较() pg/mL
注:与正常对照组比较,aP<0.05;与湿热型模型组比较,bP<0.05。
3 讨论
UC 相关大肠癌的发病率逐年上升,是UC 患者死亡的主要原因。UC 的临床表现为腹泻、咳痰、脓血便、腹痛等,多见于青壮年。近年来,随着生活方式和饮食习惯的改变,我国UC 发病率逐年上升,主要与遗传、感染、环境和免疫有关[8-9]。中医认为UC 属“久痢”范畴,大肠湿热内蕴,气血搏结壅滞,热灼肠络,可见便脓血;气血升降不利,大肠传导失司,可见腹痛、腹泻。湿热型UC 是最常见的UC 证型,但目前相关的动物模型研究较少。因此本研究在DSS 诱导UC 小鼠模型的基础上,加以湿热环境以及高脂高糖饮食等饲养条件共同建立湿热型UC 小鼠模型,结果发现湿热型UC 小鼠模型比常规DSS 诱导UC 模型小鼠DAI 评分更高,且出现明显脓血便、大便腥臭和肛温升高等湿热表现,表明湿热型UC 小鼠模型建立成功。
目前UC 的一线临床用药主要为5-氨基水杨酸(5-ASA)类药物,但存在治疗效果有限以及治疗周期长等问题,若加用激素治疗则在激素依赖性风险的同时造成肠道菌群紊乱[10],而平衡肠道菌群正是UC 近年来的研究热点。FMT 是对中药金汁继承和创新而来,研究表明FMT 是一种有效的肠道微生物稳态干预手段,可改善肠道炎症,且鲜少有不良反应的报道[11]。Costello 等[12]研究发现,采用厌氧制备供体FMT 灌肠治疗8 周可明显在不使用激素药物的情况下缓解UC,不良反应的总发生率为6.85%。本研究初步评估了金汁FMT 对湿热型UC 小鼠模型肠道炎症的作用,发现金汁FMT 干预后,小鼠体质量、大便性状以及便血程度有了明显好转,这与周瑞等[13]的研究结果一致,表明金汁FMT 对湿热型UC 有较好疗效。同时本研究发现金汁FMT 的疗效指数约为50.61%,显著高于5-ASA 治疗组,过去的研究表明金汁FMT 与5-ASA 类药物在降低UC 小鼠的DAI 指数方面无明显差距[14],这可能与金汁性苦寒,清热凉血效力较强,治疗湿热型UC 符合中医辨证论治的原则,因而比5-ASA 类药物疗效更佳。
UC 的病理学特征为炎性CD4+细胞浸润肠道,主要为辅助性T 细胞Th1 和Th17 细胞,且伴随着Th2 细胞数量增加和调节T 细胞(Treg)等免疫抑制细胞数量的减少[15]。CD4+T 细胞介导的迟发性超敏反应,导致Th1 和Th2 细胞亚群免疫调节失衡,促进UC 发生发展[16]。INF-γ 和IL-2 由Th1 细胞分泌,IL-4 由Th2 细胞分泌,其血清水平与UC 病情程度成正比[17-18]。Th17 细胞和Treg 细胞与UC 发展也有关联,其中Th17 细胞分泌IL-17,而UC 患者血清和肠黏膜中IL-17A 水平显著升高,Treg 细胞则起关键性抗炎和免疫调节作用[19]。本研究中湿热型UC小鼠结肠组织INF-γ、IL-2、IL-4 和IL-17 水平上升,TGF-β 和IL-10 水平降低,而经金汁FMT 治疗后这些炎性细胞因子表达水平趋于正常,这与翁剑锋等[20]的研究结果类似,表明金汁FMT 能够调节CD4+T 细胞相关促炎、抗炎因子水平,降低UC 小鼠结肠组织炎性反应,推测可能与调控平衡Th1/Th2以及Th17/Treg 比例,介导机体免疫反应相关。
综上所述,金汁FMT 对湿热型UC 小鼠治疗效果优于5-ASA 药物,可改善其结肠病理状况,降低湿热型UC 小鼠DAI 评分,调控结肠组织INF-γ、IL-2、IL-4 和IL-17、TGF-β 和IL-10 水平,改善结肠组织炎性反应,推测可能与调控平衡Th1/Th2以及Th17/Treg 比例,介导机体免疫反应相关。
