丁香酚对异丙肾上腺素诱导的大鼠心肌梗死保护作用
2023-05-25黄潇潇黄连军
黄潇潇 黄连军
心肌梗死是由冠状动脉缺血而引起的心肌坏死,其急性期具有很高的死亡风险,而慢性期则以心室重构和心力衰竭为特征。研究表明,心肌缺血缺氧后会导致氧化应激反应过度激活,而受损心肌的氧化应激会进一步诱导心肌细胞凋亡,加重心脏功能障碍[1]。心肌细胞凋亡在整个心脏重塑过程中持续存在,并显著影响抗心肌缺血治疗疗效[2]。因此,抑制心肌细胞凋亡对于减轻心脏功能障碍具有重要意义,是修复受损心脏和治疗缺血性心脏病的关键[1]。丁香酚是丁香的主要活性成分之一,具有抗炎、抗纤维化、抗凋亡、抗氧化和抗癌等多种药理作用[3]。此外,丁香酚包合物可通过抑制核因子κB 信号通路的活化起到抗心肌缺血再灌注损伤的作用[4]。而丁香酚对急性心肌梗死(acute myocardial infarction,AMI)的保护作用及其机制仍然未知。本研究探讨了丁香酚对异丙肾上腺素(ISO)诱导的AMI 模型大鼠的潜在保护作用及其可能作用机制,旨在为治疗AMI 提供思路。
1 实验材料
1.1动 物 40 只健康SPF 级雄性Wistar 大鼠(250~280 g)购自杭州子源实验动物科技有限公司,动物生产许可证号:SCXK(浙)2019-0004。由浙江海康生物饲养,实验饲养室许可证号:SYXK(浙)2021-0005。饲养条件:温度(22±2)℃,12 h 光暗环境交替,大鼠自由进食饮水,实验开始前适应性饲养1 周。动物实验方案经温州医科大学伦理委员会审批(伦理批号:wydw2023-0094)。
1.2主要药物、试剂和仪器 丁香酚(纯度≥98%,批号246719)和ISO(批号1351005)购自美国Sigma公司;肌酸激酶(CK,批号210116)、肌酸激酶同工酶(CK-MB,批号210415)、乳酸脱氢酶(LDH,批号210117)、心肌肌钙蛋白T(cTnT,批号210716)、肿瘤坏死因子-α(TNF-α,批号210125)、白介素-6(IL-6,批号210307)、丙二醛(MDA,批号210107)、超氧化物歧化酶(SOD)试剂盒(批号201202)、Annexin VFITC 细胞凋亡检测试剂盒(批号C1062)和2,3,5-氯化三苯基四氮唑(2,3,5-Triphenyltetrazolium chloride,TTC)试剂(批号D025-1)购自南京建成生物工程研究所。RIPA 裂解液(批号89901)、BCA 蛋白定量分析试剂盒(批号23227)、增强型化学发光(ECL)试剂盒(批号32106)购自美国Thermo Fisher Scientific 公 司。iNOS(批 号ab178945)、Cleaved Caspase 3(批号ab2302)和β-actin 抗体(批号ab8226)及辣根过氧化物酶标记的山羊抗兔IgG 二抗(批号ab150077)购自美国Abcam 公司。多导生物记录仪(型号:BL-420F)购自成都泰盟科技有限公司、离心机(型号:HC-2518R)购自安徽中科中佳科学仪器有限公司。
2 实验方法
2.1AMI 模型的建立与分组 40 只大鼠按随机数字表法分为五组:对照组、模型组、丁香酚低剂量组(1 mg/kg)、丁香酚中剂量组(10 mg/kg)和丁香酚高剂量组(100 mg/kg),每组8 只。丁香酚各剂量组予以相应剂量丁香酚灌胃,对照组和模型组给予等量的生理盐水灌胃,每日1 次,连续7 d。除对照组外,各组大鼠皮下注射100 mg/kg ISO,连续2 d,建立AMI 模型,以心电图ST 段抬高(即高于0.2 mV)为造模成功判断指标[5],对照组注射等量生理盐水。
2.2心肌损伤指标测定 末次给药后,40 mg/kg 戊巴比妥钠腹腔注射麻醉大鼠,切开腹腔,从下腔静脉采集血液标本,4 ℃下2500 r/min 离心10 min 后收集上清液,采用酶联免疫吸附实验(ELISA)根据相应试剂盒说明测定血清CK、CK-MB、LDH 和cTnT 水平。
2.3氧化应激和炎症因子指标测定 取部分心肌组织、称重、加入0.5 mL 磷酸盐缓冲液,研磨后得到匀浆液,以2500 r/min 离心,收集上清液。使用ELISA法测定心肌组织中MDA、SOD、TNF-α 和IL-6 含量。
2.4梗死面积测定 TTC 染色用于评估心肌梗死面积[6]。大鼠安乐死后,取心脏置于-20 ℃冰箱中20 min,称重,切片(2~3 mm),在1% TTC 溶液中于37 ℃避光孵育30 min,4%多聚甲醛固定24 h。梗死区为白色,正常为红色,Image J 软件用于分析梗死面积,心肌梗死率(%)=梗死区面积/总面积×100%。
2.5心肌细胞凋亡测定 各组取部分心肌组织,眼科剪剪成糜状,PBS 冲洗,加入1 mL 胰酶消化液,用移液器间断吹打消化组织,最后用1 mL 预冷PBS 冲洗终止消化,过滤,离心5 min 收集各组心肌细胞。按照凋亡检测试剂盒说明书,每组细胞用结合缓冲液重悬后,将细胞与5 μL Annexin-V-FITC 和5 μL 碘化丙啶(PI)染色剂避光孵育15 min。最后,使用FACS Calibur 流式细胞仪(Becton Dickinson)分析凋亡细胞。初次进行流式细胞仪检测时设置未染色、PI 单染和Annexin V-FITC 单染这3 个对照。
2.6Western blot 将心肌组织在冰上用含有蛋白酶抑制剂的RIPA 裂解液裂解并匀浆。然后,将匀浆液在4 ℃下5000 r/min 离心15 min,取上清液,通过BCA 蛋白定量分析试剂盒测量蛋白浓度。将30 μg蛋白样品在10% SDS-PAGE 上进行电泳,随后转移到聚偏二氟乙烯膜上,封闭,加入一抗iNOS(稀释1∶1000)、Cleaved Caspase 3(稀释1∶500)和β-actin(稀释1∶1000)于4 ℃下孵育过夜,洗涤后,加入二抗于37 ℃下孵育1 h,用ECL 法进行化学发光。用Image J 软件对蛋白表达进行定量,β-actin 作为内参。实验重复3 次测量。
2.7统计学方法 应用SPSS 20.0 统计软件处理数据。符合正态分布的计量资料以均数±标准差()表示,组间比较采用单因素方差分析(ANOVA),组内两两比较采用LSD-t检验。P<0.05 表示差异有统计学意义。
3 实验结果
3.1各组大鼠血清心肌损伤指标含量比较 与对照组比较,模型组大鼠血清CK、CK-MB、LDH 和cTnT水平显著升高(P<0.01),而中、高剂量的丁香酚可显著降低AMI 模型大鼠血清CK、CK-MB、LDH 和cTnT水平(P<0.01)。见表1。
表1 各组大鼠血清心肌损伤指标含量比较()

表1 各组大鼠血清心肌损伤指标含量比较()
注:对照组为健康Wistar 大鼠,予生理盐水;模型组为AMI 模型大鼠,予生理盐水;丁香酚低剂量组为AMI 模型大鼠,予1 mg/kg 丁香酚;丁香酚中剂量组为AMI 模型大鼠,予10 mg/kg 丁香酚;丁香酚高剂量组为AMI 模型大鼠,予100 mg/kg 丁香酚;AMI 为急性心肌梗死;CK 为肌酸激酶;CK-MB 为肌酸激酶同工酶;LDH 为乳酸脱氢酶;cTnT 为心肌肌钙蛋白T;与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
3.2各组大鼠心肌组织梗死面积比较 与对照组比较,模型组梗死面积显著增加(P<0.01)。与模型组比较,丁香酚各剂量组大鼠梗死面积显著减少(P<0.01)。见表2、图1。
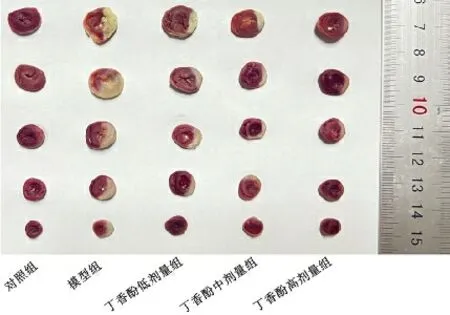
图1 各组大鼠心肌组织梗死情况比较(2,3,5-氯化三苯基四氮唑染色)
表2 各组大鼠心肌组织梗死面积及iNOS 蛋白表达比较()
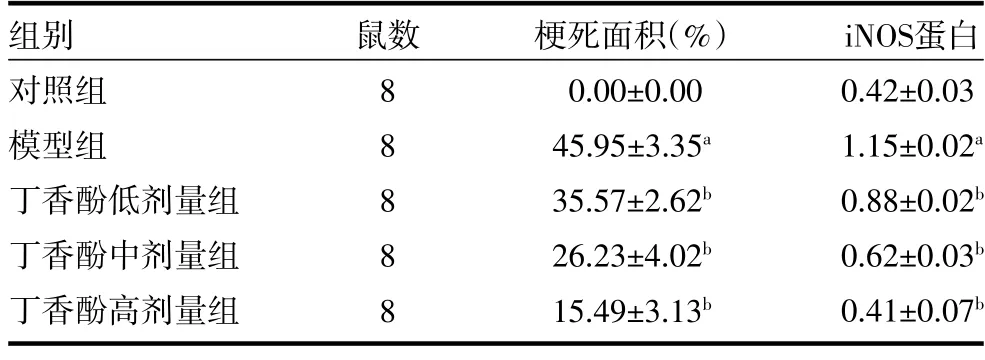
表2 各组大鼠心肌组织梗死面积及iNOS 蛋白表达比较()
注:对照组为健康Wistar 大鼠,予生理盐水;模型组为AMI 模型大鼠,予生理盐水;丁香酚低剂量组为AMI 模型大鼠,予1 mg/kg 丁香酚;丁香酚中剂量组为AMI 模型大鼠,予10 mg/kg 丁香酚;丁香酚高剂量组为AMI 模型大鼠,予100 mg/kg 丁香酚;AMI 为急性心肌梗死;与对照组比较,aP<0.01;与模型组比较,bP<0.01
3.3各组大鼠心肌组织iNOS 蛋白表达比较 与对照组比较,模型组大鼠iNOS 蛋白表达显著升高(P<0.01)。与模型组比较,丁香酚各剂量组iNOS 表达显著降低(P<0.01)。见表2、图2。
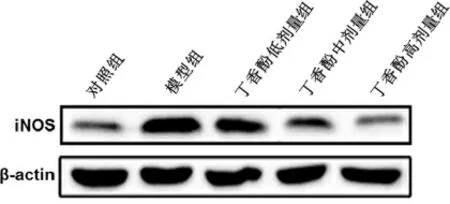
图2 各组大鼠心肌组织iNOS 蛋白表达比较
3.4各组大鼠炎症因子含量比较 与对照组比较,模型组TNF-α 和IL-6 水平显著升高(P<0.01)。与模型组比较,中、高剂量丁香酚组可显著降低TNF-α和IL-6 水平(P<0.01)。见表3。
表3 各组大鼠炎症因子和氧化应激指标含量比较()
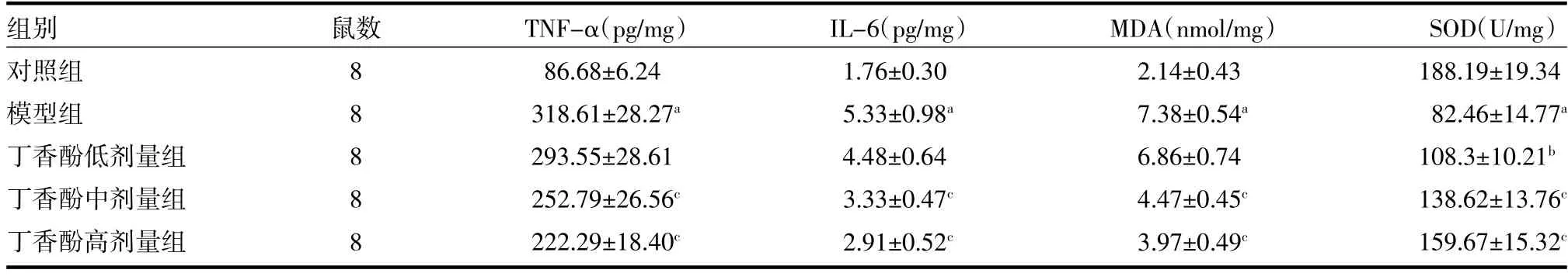
表3 各组大鼠炎症因子和氧化应激指标含量比较()
注:对照组为健康Wistar 大鼠,予生理盐水;模型组为AMI 模型大鼠,予生理盐水;丁香酚低剂量组为AMI 模型大鼠,予1 mg/kg 丁香酚;丁香酚中剂量组为AMI 模型大鼠,予10 mg/kg 丁香酚;丁香酚高剂量组为AMI 模型大鼠,予100 mg/kg 丁香酚;AMI 为急性心肌梗死;TNF-α 为肿瘤坏死因子-α;IL-6 为白介素-6;SOD 为超氧化物歧化酶;MDA 为丙二醛;与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
3.5各组大鼠氧化应激指标含量比较 与对照组比较,模型组MDA 水平升高,SOD 水平下降(P<0.01)。与模型组比较,中、高剂量丁香酚可显著降低AMI 大鼠MDA 水平,上调SOD 水平(P<0.01)。见表3。
3.6各组大鼠细胞凋亡水平比较 与对照组比较,模型组心肌细胞凋亡水平和Cleaved Caspase 3 表达水平显著升高(P<0.01),而中、高剂量丁香酚能显著降低细胞凋亡和Cleaved Caspase 3 水平(P<0.01)。见表4、图3。
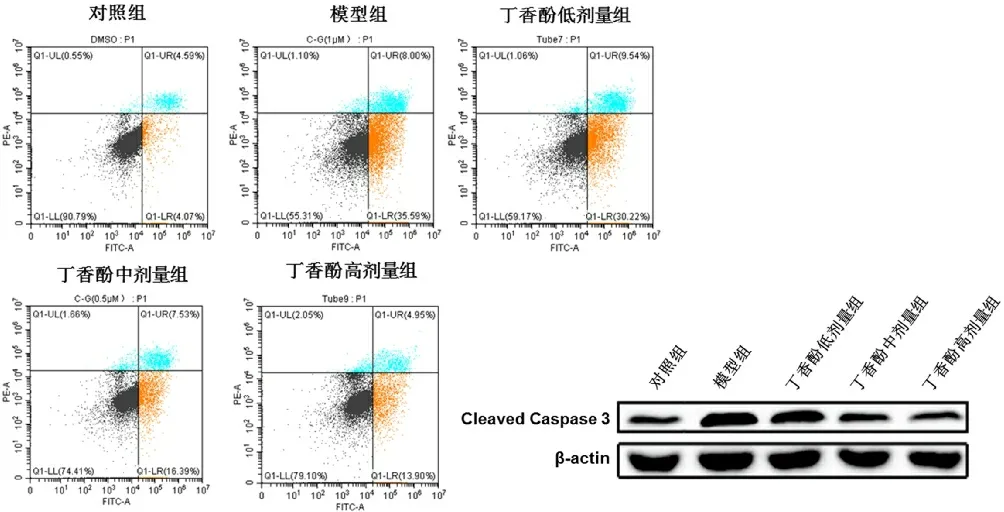
图3 各组大鼠细胞凋亡水平比较
表4 各组大鼠细胞凋亡水平比较()

表4 各组大鼠细胞凋亡水平比较()
注:对照组为健康Wistar 大鼠,予生理盐水;模型组为AMI 模型大鼠,予生理盐水;丁香酚低剂量组为AMI 模型大鼠,予1 mg/kg 丁香酚;丁香酚中剂量组为AMI 模型大鼠,予10 mg/kg 丁香酚;丁香酚高剂量组为AMI 模型大鼠,予100 mg/kg 丁香酚;AMI 为急性心肌梗死;与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
4 讨论
丁香酚具有抗氧化和心脏保护活性,在临床治疗心血管疾病方面具有较大的开发价值[3]。ISO 是一种非选择性β 肾上腺素受体激动剂,可引起心脏过度刺激,导致缺血、严重氧化应激和炎症反应,从而导致AMI。本研究显示给予大鼠ISO 与心肌损伤有关,主要表现为AMI 诊断标志酶CK、CK-MB、LDH和cTnT 水平增加,此外,模型组心肌组织显示大面积梗死区,而丁香酚能显著改善大鼠梗死面积并降低AMI 诊断标志酶水平,提示丁香酚可能是临床应用中潜在的AMI 治疗药物。有研究表明,丁香酚可通过调节LDH、天门冬氨酸氨基转移酶(AST)、MDA和CK 来缓解心肌缺血再灌注损伤[4],与本研究结果一致。
ISO 诱导的心肌损伤机制是多方面的,本研究通过氧化应激、炎症和心肌细胞凋亡等方面来研究其可能机制,并阐明丁香酚的可能保护机制。据报道,给予大剂量的ISO 可增加MDA 并降低SOD 水平,导致严重的氧化应激,并引起大鼠心肌坏死性损伤[7]。与之前研究一致,我们的数据显示在ISO 给药后显著增加MDA 水平并降低SOD 水平,而丁香酚在预防氧化应激引起的心肌损伤中有积极作用,这可能是其具有心脏保护作用的原因。先前的研究也表明,丁香酚具有很强的抗氧化和抑制脂质过氧化作用[4]。同时,受损心肌的氧化应激会进一步诱导心肌细胞凋亡[1]。在本研究中,丁香酚可改善AMI 模型大鼠中的细胞凋亡,说明丁香酚的抗氧化和抗凋亡作用对AMI 具有保护作用。
本研究中,促炎症细胞因子TNF-α 和IL-6 的表达增强提示ISO 诱导的心脏组织中炎症状态加重,而丁香酚处理减少了促炎症细胞因子TNF-α、IL-6 表达,与王娜等[4]结果一致。Ma等[8]研究表明,丁香酚能抑制脊髓损伤大鼠血清中TNF-α、IL-1β 和IL-6 水平,促进其功能恢复。此外,一氧化氮(NO)在心血管疾病的治疗中起着重要作用[9]。在AMI 中,各种心脏细胞中iNOS 的过度诱导,导致介导氧化应激、炎症活动和心肌损伤发展的NO 过度产生[10],表现为作为氧化应激指标的MDA 显著增加及作为炎症介质的IL-6 和TNF-α 显著增加。本研究中,丁香酚处理可以中和iNOS 的异常诱导,降低组织iNOS蛋白表达水平,与前期研究报告类似[10-11]。
综上所述,丁香酚对ISO 引起的AMI 具有改善作用,其机制可能与调节iNOS、炎症和氧化应激有关。
