室间隔缺损介入术后心律失常危险因素的研究现状
2023-05-24郭林静
王 皓,郭林静
室间隔缺损(ventricular septal defect,VSD)是常见的先天性心脏病,占全部先天性心脏病的20%~30%[1]。传统外科手术认为是治疗VSD的金标准,Lock等[2]首次使用介入封堵术治疗VSD。早期的VSD介入封堵术后常发生严重并发症,尤其是完全性房室传导阻滞发生率较高[3],VSD介入封堵术发展缓慢。近年来,随着介入技术的发展和封堵器材的改进,VSD介入封堵术逐渐取代传统外科手术成为VSD的替代治疗。与传统外科手术相比,介入治疗成功率和术后并发症发生率比较差异无统计学意义,但介入治疗创伤更小、住院时间更短、费用更低[4]。一项荟萃分析结果显示,VSD介入封堵术的成功率高达97%以上,但术后并发症发生率为20%~30%[5]。VSD介入术后常见的并发症包括残余分流、心律失常、瓣膜反流、封堵器脱落等[6],其中心律失常是影响病人预后的重要因素。常见的术后心律失常主要有束支传导阻滞、房室传导阻滞、室性期前收缩等[7],多数轻微的心律失常在术后早期恢复正常,而严重的心律失常可能危及生命,需取出封堵器并修补VSD,安装心脏起搏器。通过收集和整理国内外相关文献,从病人一般情况、心脏的结构、封堵器的特点及术者的操作等方面综述介入术后发生心律失常的危险因素,提出其中可能存在的机制,为今后临床工作中减少VSD介入术后心律失常的发生提供参考。
1 病人一般情况
1.1 年龄 低龄是VSD介入治疗术后发生心律失常的危险因素。随着VSD病情的发展,病人逐渐出现左右心室的增大、肺动脉高压乃至最终的艾森曼格综合征,进行失去手术时机。有研究显示,年龄越小VSD介入术后心律失常发生率越高[8]。国内外先天性心脏病介入治疗指南均推荐,不伴有左心超负荷、肺动脉高压、艾森曼格综合征等情况下,年龄≥3岁的VSD病人可接受VSD介入封堵治疗[9-10]。原因可能是婴幼儿心脏传导系统发育不成熟,VSD介入封堵术中导丝、鞘管的刺激、摩擦极易造成心脏传导束损伤,导致术后心律失常发生。由于解剖原因,婴幼儿在房室连接处组织较粗大,至2岁左右房室连接处的组织逐渐发育成熟,发生退行性变被溶解吸收[11]。若早期接受VSD介入封堵治疗,封堵器更易压迫到粗大的房室连接处,影响房室结和房室束,导致术后心律失常发生。
1.2 体重 低体重是VSD介入治疗术后发生心律失常的危险因素。钟庆华等[12]通过对1 069例接受VSD介入封堵术治疗的病人临床资料回顾性分析,结果显示,体重越小的病人术后发生心律失常风险越高。我国先天性心脏病介入治疗指南推荐体重≥10 kg的病人接受VSD介入封堵治疗[9]。原因与低龄病人术后发生心律失常的原因相似,低体重病人的心脏传导系统发育不成熟,易受到导丝、鞘管、封堵器等的影响,发生术后心律失常。低体重常提示病人病情可能较重,缺损面积较大,所需封堵器直径更大,介入封堵术后更易影响到心脏传导束,从而导致术后心律失常发生。
2 心脏结构
2.1 VSD的位置和大小 VSD是由于胚胎期室间隔发育不全所致,根据缺损在室间隔的部位及其与房室瓣、主动脉瓣的关系分为膜周型、肌部型和双下动脉型[13]。其中双下动脉型由于缺损上缘为主动脉瓣环和肺动脉瓣环连接部,不适于介入治疗外,多数膜周型和肌部型的VSD均可接受介入治疗。根据缺损的大小,VSD可分为小型(缺损直径<5 mm或缺损面积<0.5 cm2/m2体表面积)、中型(缺损直径5~10 mm或缺损面积为0.5~1.0 cm2/m2体表面积)和大型(缺损直径>10 mm或缺损面积>1.0 cm2/m2体表面积)。有研究显示,VSD的缺损位置越靠近房室瓣和主动脉瓣,缺损直径或面积越大,介入术后发生心律失常的风险越高[14]。分析可能是由室间隔缺损与心脏传导束的解剖关系决定。房室结位于房室交界区的中央,左下方邻近中心纤维体,房室结前端变细穿入中心纤维体,形成房室束。心脏的纤维体又称为心纤维骨骼,由致密结缔组织构成,是心肌和心脏瓣膜的附着处[15]。中心纤维体位于二尖瓣环、三尖瓣环和主动脉后瓣环之间,是房室瓣和主动脉瓣的瓣膜附着处。中心纤维体向下移行室间隔的肌部,向前移行为室间隔膜部。因此,VSD缺损位置越靠近房室瓣和主动脉瓣,介入封堵术后封堵器越易压迫到瓣环间中心纤维体内走行的心脏传导束,术后发生心律失常风险越高。房室束穿过中心纤维体后,继而走行于室间隔肌部与中心纤维体之间,向前下行于室间隔膜部的后下缘,进而分为左右束支。当VSD缺损直径或面积越大时,缺损边缘与房室束及左右束支的距离越近,介入术后封堵器越易压迫到心脏传导束,从而发生术后心律失常。由于室间隔长期存在从左向右的分流,缺损边缘组织形成继发的纤维化,纤维组织包裹压迫到心脏传导束,这可能是较多VSD病人术前发生心律失常的原因。当VSD的缺损直径或面积越大时,从左向右的分流量越大,缺损边缘更易形成纤维组织,纤维组织较正常室间隔组织脆弱,介入术后更易被损伤影响其中包裹的房室束及左右束支,导致术后心律失常发生。
2.2 膜部瘤 有研究显示,VSD病人术前合并膜部瘤术后发生心律失常风险增加[16]。膜部瘤是室间隔膜部在左室压力作用下向右膨出的瘤样结构,分为真性膜部瘤和假性膜部瘤。真性膜部瘤属于先天性结构畸形,是由于胚胎时期发育异常、主动脉右旋、膜部间隔位移导致室间隔膜部发育薄弱造成的,突出的囊壁薄厚均匀,无破孔或仅一个破孔[17]。假性膜部瘤是由于VSD导致的继发性结构畸形,在VSD自然闭合的过程,30%~60%的VSD病人伴有膜部瘤形成[18]。长期血液分流的冲击下,三尖瓣隔瓣的游离缘和腱索与室间隔的缺损周缘组织黏连、融合、纤维化,进而促进VSD的缺口闭合。融合的纤维组织较正常室间隔脆弱,在左室压力作用下向右膨出瘤样结构,形成了假性膜部瘤[19]。假性膜部瘤常多孔,无完整囊壁,需封堵器完全覆盖瘤体,否则易发生术后残余分流和瘤体增大甚至破裂。分析术前合并膜部瘤的VSD病人术后易发生心律失常的原因可能有以下几方面:膜部瘤距房室结和房室束的距离较近,易受到术中操作的影响发生心律失常;黏连纤维化的膜部瘤组织较正常组织脆弱,介入术后更易被损伤,影响周围走行的心脏传导束;假性膜部瘤多孔,常需较大直径的封堵器,介入术后更易压迫到心脏传导束。
3 封堵器的形态
封堵器呈双盘状结构,通过鞘管输送至VSD处,依靠两侧盘片对缺损周缘组织的夹持,腰部对缺损部位的支撑,从而达到封堵的目的[20]。根据封堵器形态差异分为对称型和非对称型,非对称型封堵器又可分为偏心型和小腰大边型,详见图1。有研究显示,使用非对称型封堵器术后发生心律失常风险高于对称型封堵器[21]。原因可能是由于各型封堵器主要针对VSD结构不同造成的。对称型封堵器左右心室两侧盘片对称,较腰部直径大2 mm,适用于普通VSD病人。偏心型封堵器主要用于VSD边缘距主动脉右冠瓣<2 mm的病人[22],为减少封堵术后封堵器对主动脉瓣的影响,主要在左室心盘处进行改动,将面向主动脉瓣的封堵器盘片边缘缩短为0~0.5 mm,同时为了增加封堵器的稳定性,又将指向心尖侧的封堵器盘片边缘增加为5~6 mm[23]。因此,一是使用偏心型封堵器的VSD病人缺损边缘距主动脉瓣较近,是术后发生心律失常的危险因素;二是面向心尖侧的封堵器盘片直径增加,更易压迫到房室束和左右束支;三是使用偏心型封堵器的难度较对称型增加,必须将封堵器的左室短边指向主动脉瓣,延长了手术时间,术中损伤心脏传导束概率增加,因此使用偏心型封堵器术后更易发生心律失常。小腰大边型封堵器主要适用于合并膜部瘤的病人,为了使封堵器完全封堵膜部瘤,在左室盘片处进行改动,将左室盘片的边缘增加为3~4 mm[24]。使用小腰大边型封堵器的VSD病人多合并膜部瘤和封堵器左室盘片直径增大可能是导致术后发生心律失常风险增加的原因。使用相同型号封堵器的情况下,封堵器直径越大,术后发生心律失常风险越高[25]。原因可能是术后封堵器边缘更靠近心脏传导束,可直接压迫或导致组织水肿、形成瘢痕,间接影响心脏传导束,进而导致术后心律失常发生。我国的先天性心脏病介入治疗指南推荐,使用比缺损直径大1~2 mm的封堵器有利于减少术后传导阻滞发生[9]。
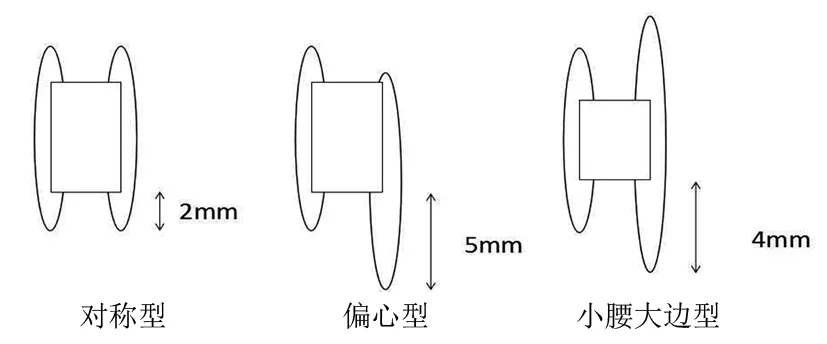
图1 3型封堵器示意图
4 术者操作
术者操作是影响病人术后发生心律失常的重要因素。术者在术中的暴力操作可直接损伤心脏传导束,导致心律失常发生。有病例报道,4岁VSD病人接受介入治疗,经股动静脉途径建立轨道后,输送鞘管时因过度牵拉导丝致3度VSD的发生[14]。有研究显示,VSD介入封堵术的手术时间>60 min,术后发生心律失常风险增加[26]。由于房室束及左右束支与室间隔的缺损位置关系密切,在VSD介入封堵术的操作过程中,导丝及鞘管刺激缺损周缘组织,造成组织水肿或渗出压迫到心脏传导束,对心脏传导系统造成不同程度损伤。术者的操作越生疏,手术时间越长,术中导丝及鞘管对心脏传导束的损伤越大,术后心律失常发生率越高。
5 小结与展望
VSD介入封堵治疗相较于传统外科手术创伤小,恢复快,但术后心律失常发生率较高。为了减少术后心律失常的发生,临床医生术前需严格掌握手术适应证,对低龄、低体重的VSD病人在心功能允许条件下可暂缓手术。通过多种影像学手段(如经食管心脏超声、心脏造影等)评估心脏的结构,选择合适型号和大小的封堵器。术中精细操作,规范手术流程,尽量缩短手术时间。术后若发生心律失常,需及时处理。近年来,随着三维心脏超声的普及,陶瓷膜、生物可降解封堵器等新材料封堵器的问世及先天性心脏病介入治疗相关规范的提出,相信VSD介入封堵术将会安全、高效地治疗VSD病人。
