CT 引导下经皮微波消融治疗四肢骨样骨瘤的临床研究
2023-05-24巩春甫旷甫国苟亚伟罗林张闻力段宏
巩春甫 旷甫国 苟亚伟 罗林 张闻力 段宏
骨样骨瘤最先由学者 Jaffe 于 1935 年提出,是一种病灶较小的良性肿瘤。骨样骨瘤通常伴有疼痛,主要由骨样组织和编织骨组成,其发生率较高,约占良性骨肿瘤的 10%~12%[1-2]。骨样骨瘤生长能力有限,肿瘤直径一般 < 2 cm[3]。该肿瘤在年轻患者中较为常见 (占所有原发性骨肿瘤的 3%),好发于男性,男女比例约为 2∶1,5 岁以下及 30 岁以上人群罕见[4]。本病常见于四肢,除脊柱之外的躯干部罕见 (在脊柱主要发生在后弓)[5]。疼痛是骨样骨瘤的主要临床表现,通常也是惟一的临床症状,常伴有夜间疼痛加重的特点,可由非甾体抗炎药缓解。目前针对此类疾病临床治疗手段包括:(1)药物治疗:非甾体抗炎镇痛药、双磷酸盐;(2) 外科手术治疗:开放手术治疗、CT 引导下外科手术治疗、关节镜下外科治疗;(3) 经皮 CT 引导下射频消融术 (radiofrequency ablation,RFA)、经皮 CT 引导下冷冻消融术、MRI 引导下聚焦超声术 (MRI guided focused ultrasound,MRgFUS)[6]。目前越来越多的手术开始向微创发展,笔者团队利用 CT 引导下经皮穿刺微波消融术 (microwave ablation,MWA) 治疗骨样骨瘤 23 例,现报道如下。
资料与方法
一、纳入标准与排除标准
1.纳入标准:(1) 2019 年 7 月至 2021 年 4 月,在四川省第四人民医院经 CT 引导下经皮穿刺 MWA治疗的骨样骨瘤者;(2) 经病理明确诊断者;(3) 在本院完整随访者。
2.排除标准:(1) 术后病理诊断证实非骨样骨瘤者;(2) 存在心、脑、肾、肺、肝等重要脏器严重疾患不能耐受手术或麻醉者;(3) 因智力障碍、精神异常或其它原因不能配合治疗者。
二、一般资料
本组共纳入 23 例,男 19 例,女 4 例;包含脊柱 1 例 (T8),髋关节周围 (髋臼、股骨头、股骨颈)9 例,肘关节周围 (肱骨髁、尺骨鹰嘴) 3 例,膝关节周围 (胫骨平台、股骨髁) 2 例,踝关节周围1 例,胫骨干 3 例,股骨干 3 例,肱骨干 1 例。病程 15 天至 18 个月。年龄 6~37 岁,平均 (19.87±2.21) 岁。瘤巢 0.5~2.5 cm,平均 (1.15±0.31) cm。所有患者均有不同程度的局部疼痛症状,其中 4 例髋周病变患者合并有下肢放射痛及跛行。19 例夜间痛明显,18 例对口服 NSAIDs 药物治疗有效。术前疼痛视觉模拟评分 (visual analogue scale,VAS)3~9 分,平均 (7.21±1.35) 分。术前均行 X 线、CT、同位素骨扫描检测,X 线片及 CT 影像上表现为一个小的圆形骨溶解区域 (瘤巢),外围包绕一圈硬化骨。骨扫描多表现为中心单个小圆形强浓聚区域,外周为浓聚范围较大的晕圈,类似于汽车大灯在雾中的景象。MRI 中病灶常不明显,故不作为常规检查 (图1~3)。
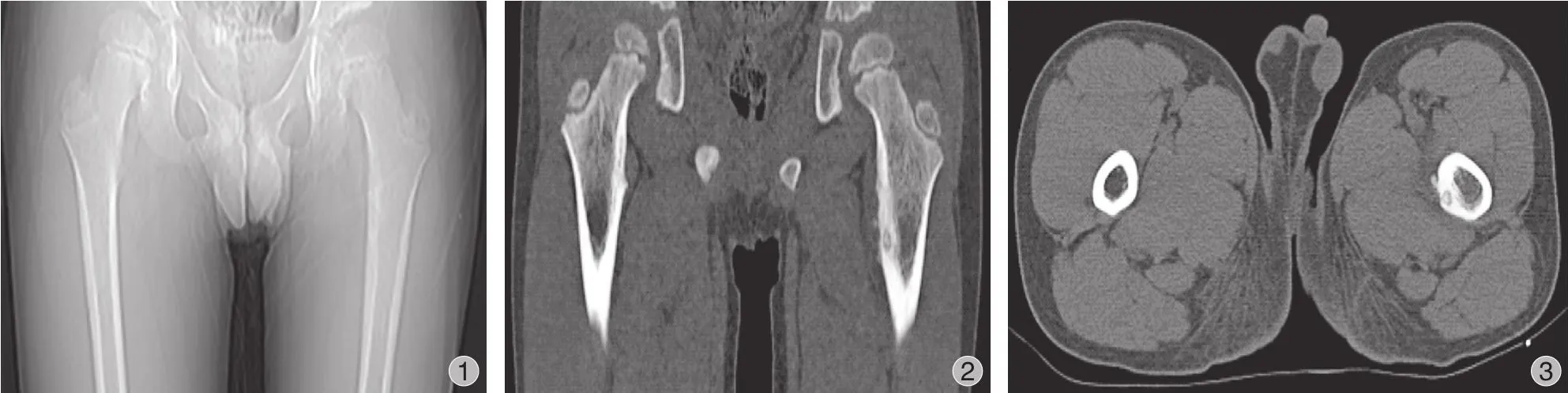
图1 X 线片显示,左侧股骨上段内侧缘卵圆形低密度瘤巢影,周围骨质硬化图2 CT 冠状位平扫显示,左侧股骨上段内侧缘瘤巢边界清晰,周围骨质硬化增生,直径约 1.2 cm图3 CT 轴位平扫显示,左侧股骨上段内侧缘瘤巢边界清晰,周围骨质硬化增生Fig.1 The X-ray of the nest shadow of oval low-density tumor on the medial edge of the left upper femur.The bone around the tumor nest was scleroticFig.2 The coronal CT scan of upper femur The CT scan showed the border of the tumor nest on the medial edge of the upper segment of the left femur was clear.Osteosclerosis and hyperplasia were observed.The diameter was about 1.2 cmFig.3 The axial CT scan of upper femur showed the border of the tumor nest on the medial edge of the upper segment of the left femur was clear.Osteosclerosis and hyperplasia were observed
三、设备与方法
1.设备:本研究中采用南京长城医疗设备有限公司的微波治疗仪,型号:MTI-5A,微波输出功率:0~120 W,微波输出频率:2450 MHz,微波热凝消融针型号:HD6206001M,匹配阻抗 50 欧姆。
2.方法:根据患者病灶部位,分别采取合理体位,体表粘贴专用定位栅格,对病灶进行薄层CT 扫描,根据 CT 图像确定最佳穿刺点及进针路线(图4、5),局部常规消毒铺巾,沿穿刺表面予 1%利多卡因逐层麻醉至骨膜,对部分疼痛不可耐受患儿加用静脉麻醉。避开重要血管神经作一开口,大小约 5 mm,骨穿针沿定位方向穿刺至瘤巢。取骨穿针内组织送病检。经骨穿通道植入微波消融针,微波作用点置于瘤巢内,再次运用 CT 定位确认消融点位置,设置功率参数为 40 W,持续时间约 2 min。治疗结束后缓慢取出微波消融针,局部穿刺点缝合包扎,术后复查 CT 观察穿刺部位周围有无出血等情况,定期创面换药。术后第 2 天恢复正常行走,术后 2 周恢复正常活动。
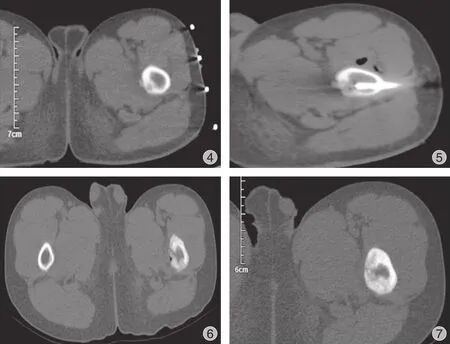
图4 穿刺前 CT 定位相图5 穿刺中的 CT 平扫显示,微波针准确位于瘤巢中央图6 术后 3 个月复查瘤巢已消失图7 术后 6 个月复查瘤巢消失,穿刺针道已硬化Fig.4 CT location before punctureFig.5 CT scan of the upper femur during puncture The CT scan showed the microwave needle was accurately located in the center of the tumor nestFig.6 The CT scan showed the tumor nest disappeared 3 months after operationFig.7 The tumor nest disappeared and the puncture needle path hardened 6 months after operation
四、疗效评价
利用 VAS 评分于术前、术后 1 个月、3 个月、6 个月、12 个月评估患者疼痛缓解情况,术后 1 年内每 3 个月行病灶区 CT 检查 (图6、7),观察消融区骨密度及临近组织恢复情况,参考 VAS 评分综合评估治疗效果。
五、统计学处理
采用 SPSS 19.0 统计学软件对数据进行分析,术后 VAS 评分及术前比较采用配对设计资料t检验,以P< 0.05 为差异有统计学意义。
结 果
本组 23 例均成功完成 CT 引导下的微创 MWA治疗,术后均行病理检测证实诊断,术后第 2 天,大多数患者疼痛不适均有明显好转,术后 1 周22 例不再服用镇痛药。1 例术后并发手术部位局部脓肿,予清创后痊愈。VAS 评分:术前 (7.21±1.35) 分、术后 1 个月 (1.82±0.97) 分、术后 3 个月 (0.81±0.43) 分、术后 6 个月 (0.77±0.34) 分、术后 12 个月 (0.60±0.41) 分。术前与术后随访 VAS评分分别行配对t检验显示,术后与术前比较,均有明显降低,差异有统计学意义 (P< 0.05),证实MWA 对四肢骨样骨瘤的镇痛效果明确,能较大程度的降低患者的疼痛。
讨 论
骨样骨瘤是一种比较常见的病因不明的良性骨肿瘤,约占良性骨肿瘤的 10%~12%[1-2],常为单发,极少恶变,青少年人群中发病率较高,尤其是 5~20 岁人群,可能与骨成长与骨代谢在这个年龄段活跃有关。疼痛是本病就诊的主要原因,尤以夜间疼痛为主。瘤体主要是由瘤巢和周围增厚的骨质组成。对于本病,处理的根本方法是破坏或清除瘤巢[7-8]。
手术曾是主要的治疗方式,直到 20 世纪 90 年代末,病灶刮除术都一直是大多数治疗中心的选择[6]。而现在,治疗方法还有 CT 引导下经皮射频、激光或超声聚焦消融,这些方法缓解疼痛的成功率超过 90%,对于经皮消融治疗无效或病灶瘤巢靠近皮肤或神经根的患者,手术仍是有效的治疗方法[9]。
MWA 是一种利用微波电磁场热效应以达到直接杀伤肿瘤细胞[10],破坏肿瘤血管[11],诱导肿瘤细胞凋亡[12]以及促进机体免疫[13-14]的效果,进而治疗肿瘤的一种热疗学办法。MWA 最先运用于实体肿瘤的治疗,经过多年发展,其疗效也得到了充分的验证和认可[15-16]。MWA 技术运用于骨肿瘤也已经有超过30 年的历史了。同时,因为四肢骨骼的特殊性质,外科手术容易破坏骨的连续性,而 MWA 可以实行原位消融,尽可能多的保留骨的生物力学特性,在四肢骨肿瘤的治疗中,具有独特的优势和特点[17]。
CT 引导下 RFA 相较于 MWA 目前更多的运用于四肢骨肿瘤患者的治疗,且已经成为国际共识,其治疗效果也在很多方面优于传统手术治疗,但 RPA 在实际运用中,仍存在一定局限性。如病灶部位温度过高或灭活时间较长,热量可能会对周围组织产生损伤[18]。随着 MWA 技术的不断发展,更新的观点认为,相较于 RFA,MWA 在治疗四肢骨肿瘤方面具有升温更快、消融时间短、监控温度更方便以避免对周围组织及皮肤的损伤,同时不受心脏起搏器影响的特点,更适合运用于四肢骨样骨瘤的治疗[17,19]。在本次研究中,23 例患者均未发生周围组织、皮肤灼伤及周围重要血管神经损伤等严重并发症,仅有 1 例出现术后局部脓肿,也在清创后迅速好转。
MWA 治疗四肢骨肿瘤也存在一定的限制和风险。其热效应对周围组织、血管、神经的威胁始终是一个不可回避的问题。虽然随着温控及水冷系统的不断发展,目前安全性已经得到了极大的提高和保障,在本次研究的 23 例中也未发现周围重要组织的损伤,但在临床工作中仍须高度警惕。目前临床使用的 MWA 设备并不统一,不同设备,不同部位的消融功率与时间尚无详细的使用参数,不同设备、不同功率对消融范围及消融程度具有一定差异性[20]。同时不同骨组织周围的神经、血管分布情况并不一致,对温度的敏感性及耐受能力也不一样,须根据实际情况进行调整。因此在实际操作中因密切关注消融中心的温度,以肿瘤组织发生凝固性坏死为消融目标而不应一味参考既定数据。同时受限于穿刺通道较小,穿刺所得标本相较于传统开放手术更少,在一定程度上增加了误诊的风险。除此之外,由于 MWA 均需在影像学引导下操作,也将会使患者暴露于射线下,应注意在操作过程中,对患者敏感部位、重要部位的保护。
综上所述,利用 MWA 治疗骨样骨瘤是一种安全、有效的方法,能够明显的减轻患者疼痛,同时相较于传统开放手术创伤更小,住院时间更短,且能更好的保证骨组织的生物活性和连续性。但同时,MWA 治疗骨样骨瘤对操作人员的要求较高,需要有经验的医师进行术前诊断,以防误诊。此外,虽然经过了 30 余年的发展,目前 MWA 的设备和参数仍未完全统一,且不同患者的个体差异性也较大,因此在治疗过程中根据实际情况,调整消融的功率计时间,在保证安全的前提下达到肿瘤的完整灭活。
