临床特征联合血清标志物检测预警模型在肺癌骨转移诊断中的临床价值
2023-05-24马海洋吴琼张勇
马海洋 吴琼 张勇
随着社会经济的不断发展,国民的生活水平得到一定程度的提升,但随即产生的环境污染问题更加严重,在一定程度上造成了空气污染以及空气质量下降的问题,大大提升了我国呼吸道疾病以及肺部疾病的发生比例,间接增加了患者发生肺癌等恶性疾病的发生以及死亡风险[1]。临床中肺癌是发生率较高的恶性肿瘤,支气管黏膜上皮发生严重病变是引发肺癌的主要原因,因此常称为支气管肺癌[2]。临床中肺癌发生后,病情进展较快,临床症状较为严重,包括对患者的生命安全以及健康造成严重威胁,使肺癌成为临床恶性肿瘤中致死率最高的恶性肿瘤疾病。已有相关数据证实,恶性肿瘤患者中发生骨转移的比例在 20%~60% 左右,其中老年肺癌患者是骨转移的高危人群,因此在患有肺癌后及时进行骨转移诊断并采取针对性的有效治疗措施是降低患者骨转移发生风险以及改善患者预后的关键[3]。骨转移主要指的是患者的骨结构发生异常导致骨损伤以及骨性破坏等,人类骨质主要由 Ⅰ 型胶原构成,Ⅰ 型胶原主要由成骨细胞合成,并且合成以及分解的代谢产物会进入血液循环,通过临床多种试剂检测后可以有效反映机体的骨代谢水平,同时对骨基质矿化具有重要作用。目前虽有相关研究是以肺癌患者骨转移的血清标志物以及骨代谢指标诊断价值为中心进行深入分析,但因为研究样本量相对较少以及单一血清标志物的诊断敏感度、特异度较差等导致获得的研究数据参考价值较低,使相关研究结论仍存在一定争议[4]。本次通过临床基线特征联合骨特异性碱性磷酸酶 (bALP)、癌胚抗原(CEA)、Ⅰ 型原胶原氨基端 (N 端) 延长肽 (PINP)、Ⅰ 型胶原交联羧基端 (C 端) 肽 (CTx)、糖链抗原125 (CA125) 等血清标志物和骨代谢指标构建预测模型并应用于患者骨转移诊断中,为后续提升临床肺癌骨转移诊断以及及时预测预防奠定研究基础。
资料与方法
一、纳入标准与排除标准
1.纳入标准:(1) 2018 年 6 月至 2020 年 5 月,我院经治的肺癌骨转移患者;(2) 结合病理学检查结果以及临床影像结果确诊,病理类型均为非小细胞肺癌者;(3) 筛选的患者资料具有较高完整度,年龄 ≤ 70 岁者;(4) ECOG 评分 ≤ 2 分,肝、肾等重要器官的功能运行无异常者;(5) 骨转移诊断时检测血清标志物、骨代谢指标水平者;(6) 诊断前未接受任何可能影响研究结果的干预治疗者。
2.排除标准:(1) 无外伤骨折者;(2) 有高钙血症者;(3) 有甲状腺功能亢进或减低病史者;(4) 有其它恶性肿瘤病史者。
二、一般资料
本研究共纳入 206 例。男 112 例、女 94 例;年龄 32~70 岁,平均 (57.99±3.52) 岁。腺癌 139例、鳞癌 67 例。176 例的 ECOG 评分为 0~1 分,30 例 ECOG 评分为 2 分。肺癌分期标准[5]:Ⅰ 期属于早期,是肿瘤位于肺组织中尚未发生转移。Ⅱ期属于中期,指癌细胞已转移到了肺门附近的淋巴结。Ⅲ 期属于局部晚期,指癌细胞已经进一步转移到纵隔或肺外淋巴结,还包括少部分病灶非常大或侵犯肿瘤器官不利于手术的情况。Ⅳ 期属于晚期,指肿瘤出现胸膜转移,胸腔积液或者全身多处脏器的转移 (表1)。

表1 研究对象基线资料Tab.1 Baseline data of subjects
三、方法
1.肺癌骨转移的诊断标准:以骨显像以及临床症状为金标准[6],诊断内容如下:(1) 排除良性病变与其它外伤因素影响,骨显像结果中超过 3 处的放射性核素出现大量聚集;(2) 骨显像结果中 ≤ 2 处的放射性核素出现大量聚集并存在骨痛、病理性骨折等骨转移临床症状确诊发生转移;(3) 放射性核素检查阴性,但存在骨痛、病理性骨折等骨转移临床症状则为发生骨转移;(4) 骨显像结果中出现大量聚集放射性核素且存在骨痛、病理性骨折等骨转移症状。存在以上 4 条中任何一条均可确诊。
2.标本采集与检测:晨起时间段内采集 3 ml 研究对象的空腹静脉血,按照转速 2000 r / min 设定参数离心 8 min,取上清液并保存在 -20 ℃ 环境中。由专业人员严格按照操作流程对样本进行批量检验,检测方法为电化学发光免疫分析法 (ECLIA)。
3.外周血循环肿瘤细胞 (CTC) 数量测定方法:外周血 CTC 数量检测采用 Cyttel-CTC-imFish 技术完成,收集患者 3.2 ml 晨起空腹前臂静脉血,为防止血液被上皮细胞污染,取中段血 3.2 ml,按照3000 r / min 转速以及 20 cm 离心半径进行离心,去除上层清液并加入细胞裂解液,免疫磁珠包被特异性抗体后吸附白细胞并分离富集肿瘤细胞。用 CD45以及 8 号探针作为细胞荧光原位杂交反应检测的工具,镜检计数,出现 3 倍体及以上信号同时 CD45阴性为肿瘤细胞。
四、统计学处理
对研究出现的数据进行有效处理的软件是运用SPSS 22.0,计量资料进行正态性检验,计量资料中正态分布以x-±s形式表现,采用t检验,使用 (%)表示计数资料并进行χ2检验,多因素 Logistic 回归法分析肺癌骨转移的影响因素,P< 0.05,数据有统计学意义,制订肺癌骨转移的预测模型并进行验证。
结 果
一、骨显像结果
肺癌患者共计 206 例,99mTe-MDP 诊断结果中骨转移确诊例数共计 67 例,骨转移病灶中 1 个热区、2 个热区、热区 ≥ 3 个的例数分别为 10 例、23 例、34 例,共计 171 个;1.94% 的肺癌患者为 1 个热区可疑骨转移,共计 4 例;65.53% 的骨显像未存在异常浓聚,共计 135 例。后经确诊,43 例骨显像阳性患者确诊发生骨转移,假阳性例数为 24 例;可疑病例中骨转移的例数为 1 例;9.63% 骨扫描阴性患者为假阴性,共计 13 例。27.67% 为骨转移确诊比例,共计 57 例;骨显像诊断的特异性为 81.88%、敏感度为 75.44%、漏诊率为 22.81%、假阳性率为35.82%。骨转移组与无骨转移组的骨显像阳性检出率存在统计学意义 (χ2= 66.497,P< 0.001)。42.11%患者的骨转移灶累及肋骨或胸骨,共计 24 例;脊柱 19 例 (33.33%),骨盆 15 例 (26.32%),长骨 9 例(15.79%),颅骨 5 例 (8.77%)。
二、单因素分析骨转移组与无骨转移组血清标志物水平比较
骨转移组的血清标志物 CTC、CEA、CA125、PINP、bALP、CTx 水平均高于无骨转移组 (P<0.001) (表2)。

表2 比较两组患者血清骨转移标志物变化差异 ( x-±s )Tab.2 Comparison of changes in serum bone metastasis markers between the two groups (x- ± s)
三、单因素分析骨转移组与无骨转移组肺癌的临床病理特征
Ⅰ 期、Ⅱ 期、Ⅲ 期、Ⅳ 期的占比分别为10.19%、7.28%、36.89%、45.64%,例数分别为21 例、15 例、76 例、94 例。骨转移组的临床分期、腺癌病理类型占比明显高于无骨转移组,两组差异有统计学意义 (P< 0.05) (表3)。
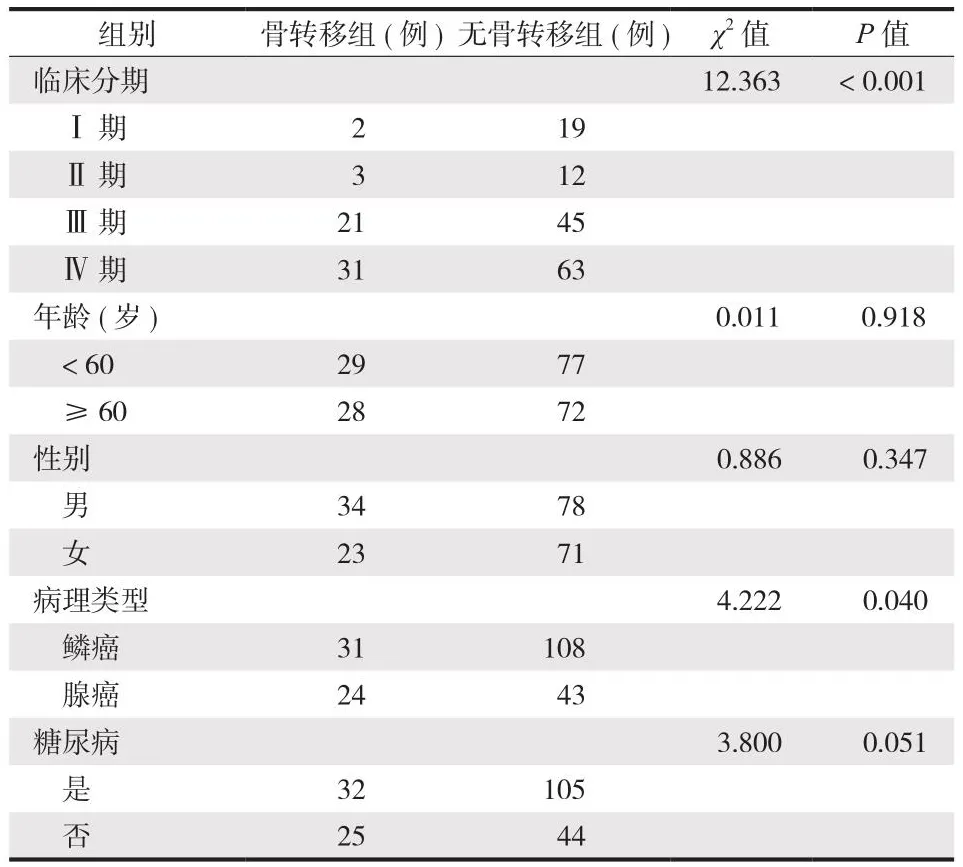
表3 单因素分析骨转移组与无骨转移组肺癌的临床病理特征Tab.3 Univariate analysis of clinicopathological characteristics of lung cancer in the bone metastasis group and the non bone-metastasis group
四、多因素分析肺癌骨转移的影响因素及建立预测模型
将P< 0.05 的 CEA、骨显像、临床病理分期、CA125、PINP、bALP 作为肺癌骨转移变量为自变量,肺癌患者发生骨转移为因变量,数据提示病理类型、病理分期、CEA、CA125、CTC、PINP、bALP为肺癌患者发生骨转移的危险因素 (表4,5)。
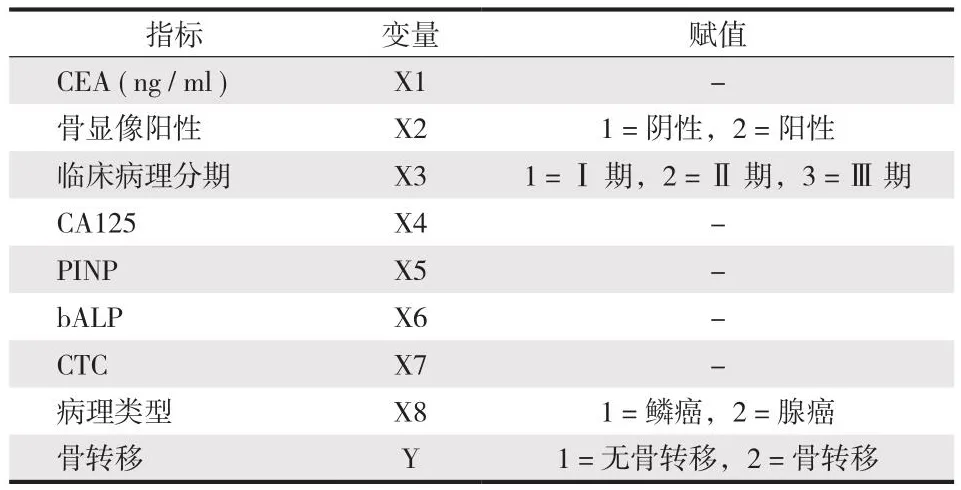
表4 变量赋值表Tab.4 Variable assignment table
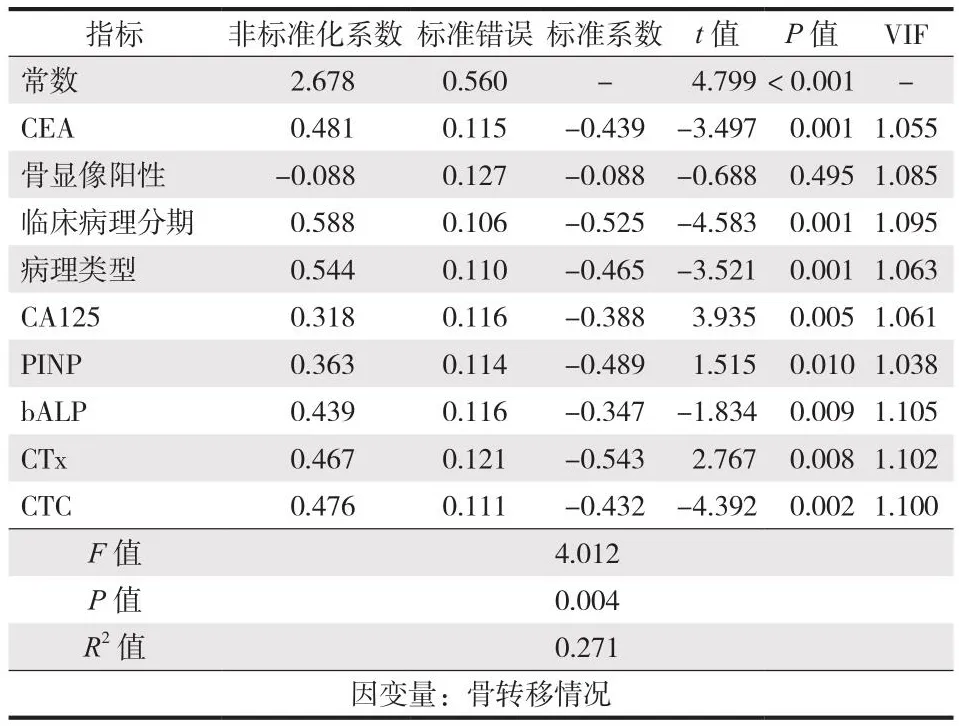
表5 多因素分析肺癌患者骨转移的影响因素Tab.5 Multivariate analysis of the influencing factors of bone metastasis in lung cancer patients
以上回归分析结果准确可靠,回归方程的拟合度R2= 0.271,拟合度显著 (F= 4.012,P< 0.05),说明本回归模型存在有显著意义,即自变量中至少有一个可以显著影响。回归方程的残差情况如图1。
图1 多元线性回归方程标准化残差直方图Fig.1 Histogram of normalized residuals of multiple linear regression equations
五、临床特征联合血清标志物肺癌骨转移预测模型在肺癌骨转移诊断中的价值验证
根据以上的危险因素结果绘制列线图构建肺癌患者骨转移的预测模型,模型为 0.469 + CEA×0.481 +病理类型×0.544 + 临床病理分×0.088 + CA125×0.318 + PINP×0.363 + bALP×0.439 + CTx×0.467 +CTC×0.476。将验证组的肺癌数据代入列线图中计算概率值。以 50% 为预测概率验证的分界值,≥ 50%是骨转移高危患者,< 50% 是骨转移低危患者。临床特征联合血清标志物肺癌骨转移预测模型诊断肺癌骨转移的准确率为 92.23,AUC 为 0.916,敏感度与特异度均在 90% 左右 (表6、7,图2、3)。
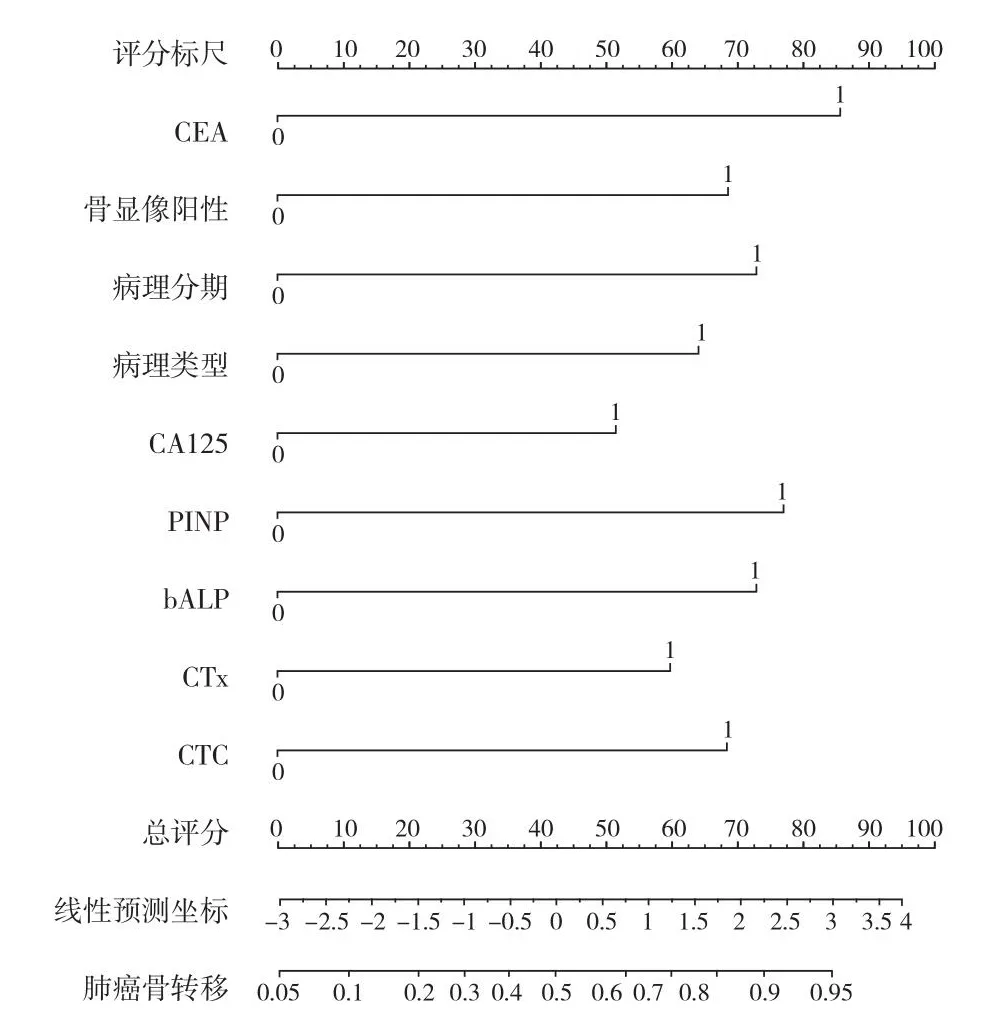
图2 肺癌患者骨转移预测模型列线图Fig.2 Prediction model of bone metastasis in patients with lung cancer
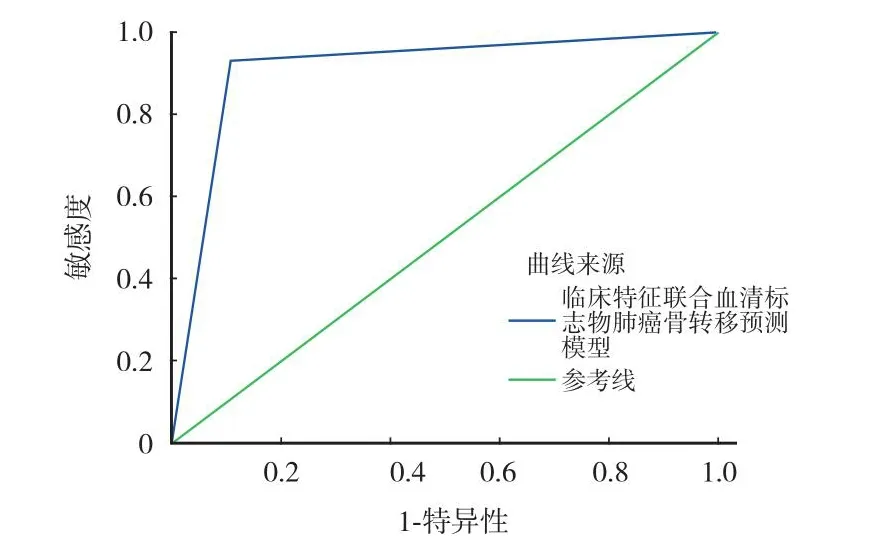
图3 预测模型在肺癌患者骨转移中的诊断效能 ROC 曲线Fig.3 ROC curve of the predictive model for the diagnosis of bone metastasis in lung cancer patients
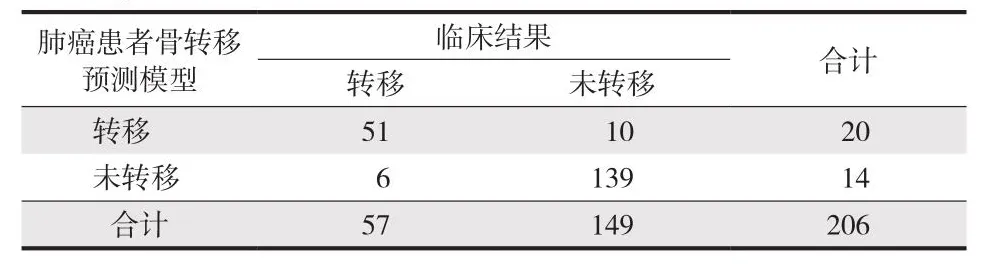
表6 肺癌患者骨转移预测模型检出结果Tab.6 Detection results of bone metastasis prediction model in lung cancer patients

表7 预测模型在肺癌患者骨转移中的诊断效能Tab.7 Diagnostic efficacy of prediction model in bone metastasis of lung cancer patients
讨 论
肺癌骨转移是肺癌患者在中后期常出现的一类疾病,病情严重者如不能及时发现并治疗,极易对患者生命造成影响,严重威胁人类健康。对于此,加强监测与早期治疗至关重要[7]。随着临床检测医学中广泛应用放射性免疫技术以及肺癌血清标志物研究深度的不断增加,血清标志物在肺癌诊断中的应用效能得到进一步挖掘的同时提升了肿瘤诊断结果准确率,而临床相关检测技术在肿瘤临床疗效以及预后诊断中的应用价值也为恶性肿瘤研究发展提供数据支持。
骨形成、骨吸收标志物较多,主要有未羧化骨钙素 (ucOC)、抗酒石酸酸性磷酸酶 (TRAP)、CTx[8]。通过生物化学方法检测血清或尿液的骨代谢指标水平能有效反映骨代谢以及骨转换状态,对肿瘤的疗效评估具有一定的指导意义。已有研究实验结果表示骨代谢水平在一定程度上会影响骨转移以及预后结局,但乳腺癌、前列腺癌是骨转移相关研究的集中点,关于肺癌骨转移的研究案例鲜少且研究结论尚未统一[9]。
成浩等[10]针对 143 例 Ⅰ~Ⅳ 期肺癌患者进行了深入研究,根据单因素以及多因素分析结果指出患者 PINP 或 PICP 升高发生预后不良的比例更高,但 PINP 和 PICP 并不是影响预后的独立因素,在一定程度上可以说明 PINP、PICP 与肺癌患者骨转移预后结局存在关联。本研究中骨转移组患者的 PINP明显更高,PINP 是肺癌患者骨转移的独立影响因素并被纳入预测模型中,与以上研究结果相符,提示PINP 在肺癌骨转移中具有较高诊断价值,分析其原因可能是在 Ⅰ 型前胶原、Ⅰ 型胶原的衍化过程中切断氨基末端结构,因此血清 Ⅰ 型前胶原水平可作为反映 Ⅰ 型胶原合成状态以及骨形成的良好指标,提示 Ⅰ 型胶原合成速度随着 Ⅰ 型前胶原升高而增快,骨转换活跃,因此在骨转移时 PINP 会对应发生变化[11]。成骨细胞分泌产生的 bALP 是一种 ALP同工酶,在成骨细胞活性中具有较高的敏感性。Vimalraj 等[12]指出肺癌患者的 bALP 高水平表达是促进疾病进展对危险因素 (RR:1.77;95%CI:1.19~2.64;P= 0.005),死亡危险是正常者的 1.5倍 (RR:1.53;95%CI:1.15~2.03;P= 0.003),证实预后不良因素中不包括 bALP,本研究中相比于骨转移组,无骨转移组的 bALP 水平更低,并且作为独立影响因素被纳入肺癌骨转移预测模型中,提示 bALP 是可以反映肺癌骨转移发生情况的敏感指标。其主要原因是在恶性肿瘤骨转移的细胞生理进程中血清 bALP 均有参与,因此在肺癌患者的骨转移发生中 bALP 会出现较明显的变化。本研究中 CTx在骨转移组水平更高并且是影响因素之一,其主要是因为 CTx、NTx 等标志物主要由 Ⅰ 型胶原降解产生,二者均具有较高的特异性,CTx 相比于 NTx,CTx 诊断骨吸收的特异性差,但在骨吸收诊断中具有较高的敏感性,因此在肺癌患者的骨转移时具有较高的诊断价值[13]。
肺癌预后临床研究中肿瘤标志物是重点方向。多项研究数据显示肿瘤标志物会影响肺癌患者的预后,但研究对象具有一定局限性,多为早期肺癌,针对晚期肺癌患者的研究案例鲜少,肿瘤标志物对肺癌骨转移患者预后的评估价值尚未明确。肿瘤标志物之一的 CEA 在诊断肺癌中的灵敏度、特异度一般,与早期肺癌患者的预后结局存在密切关联,但有研究不认同该观点[14]。本研究结果显示 CEA 是诊断肺癌骨转移的敏感指标,分析其原因是 CEA 为临床常用的肿瘤敏感标志物,主要形成于细胞浆,经细胞膜传递分泌于细胞外以及周围体液中,在血清、胃液等体液中均可检出,随着患者病情的加重,患者的 CEA 水平会相应增加[15]。早期 CA125在临床诊断卵巢癌、预后判断以及疾病复发预测中较为常用并且具有较高的敏感性和阳性率。已有研究发现 CA125 在肺癌患者血清中呈高水平表达。近几年 CA125 已成为肺癌的临床标志物研究重点,但多数研究是以 CA125 预测早期肺癌患者预后为切入点,关于晚期肺癌预后的研究案例较少。
目前,已文献报道 CTC 在 PCa 患者中表达水平明显高于正常人群,提示其可能对 PCa 诊断具有一定的应用价值[16]。本研究结果显示,CTC 是肺癌骨转移的危险因素,并在呈高水平表达,与以上研究结果相符,提示 CTC 检测能有效反映原发肿瘤的转移,从而起到辅助判断病情进展的作用,主要是因为 CTC 是从机体肿瘤原发灶、转移灶中脱落进入循环系统的肿瘤细胞,大部分 CTC 在短时间内可经机体免疫系统清除或因自身循环周期而死亡,但依然存在少部分细胞聚集生长形成癌栓,并在患者组织中进展为转移灶,从而参与了恶性肿瘤的转移[17]。因 CTC 细胞在不同人群中的水平存在一定差异,所以在后续的不同人群的肺癌骨转移临床诊断中应通过优化 CTC 检测技术以及纳入 CTC 变量校正因素等方式提升一致性。
许玉炫等[18]研究指出肺癌患者若是 N 期就更容易发生骨转移。已有研究表示相比于腺鳞癌、小细胞癌,肺腺癌是骨转移风险最高的肺癌病理类型,与本研究的结果是一致的,原因分析如下:腺癌多发于黏液腺,多数为血液转移,可通过向血管外生长对患者的肋骨、脊椎部位进行直接侵犯,同时经脊柱、肺部的静脉循环向全身的骨骼转移,而临床分期越高,表示患者的病情越严重,因此发生骨转移的风险越高[19]。
本研究的不足:(1) 通过逻辑回归分析结果构建研究模型的相关文献较少;(2) 纳入的研究样本量相对较少;这可能会影响模型的应用准确性。所以后续研究中应扩大样本量并探寻其它的模型构建优化方案,以待进一步深入分析临床特征联合血清标志物检测预警模型能提升肺癌骨转移的实际诊断价值。
综上所述,诊断肿瘤骨转移中,临床特征联合血清标志物检测预警模型对于诊断肺癌骨转移拥有较高的诊断功能,可视为肺癌骨转移的一种筛查方法,拥有较高的临床实用价值。采取临床特征联合血清标志物检测预警模型能提升肺癌骨转移的实际检出率,在临床中具有非常强的实用性。
