应用qPCR研究三峡库区沉积物中拟多甲藻的动态变化
——以汝溪河为例
2023-05-23施军琼向蓉何书晗欧阳添赵璐纪璐璐杨宋琪吴忠兴
施军琼, 向蓉, 何书晗, 欧阳添,赵璐, 纪璐璐, 杨宋琪, 吴忠兴
西南大学 生命科学学院/三峡库区生态环境教育部重点实验室/重庆市三峡库区植物生态与资源重点实验室,重庆 400715
三峡库区175 m 正常蓄水运行后, 从上游至下游, 水位升高约3~100 m, 导致了支流水文情势发生明显变化, 如水面变宽、 水流减缓、 泥沙含量降低等. 流速减缓, 使得支流回水区成为湖泊型水体[1-4]. 此外, 由于氮、 磷的输入, 支流富营养化趋势凸显[5-6], 因此, 部分支流库湾藻类水华现象已成为淡水生态学和水环境科学研究的焦点及水质管理部门关注的重点[7-8].
甲藻是一类能够形成孢囊(休眠细胞)的藻类, 其休眠性孢囊在适宜的环境条件下会迅速启动萌发机制, 并在短时间内大量增殖, 甚至形成水华现象; 当环境条件不适宜时, 又会大量形成孢囊, 在底泥沉积, 躲避不利环境[9], 因此, 甲藻孢囊不仅为甲藻水华暴发提供“种源”, 而且在甲藻水华的发生和消亡中也具有重要作用[10]. 2004年, 三峡库区首次报道了拟多甲藻水华[11]. 紧接着, 库首第一支流香溪河也发生拟多甲藻水华[12]. 据不完全统计, 高岚河、 汝溪河、 彭溪河、 童庄河、 大宁河、 梅溪河、 小江等多条支流回水区均发生了该藻类水华, 且一些支流发生频度较高[8, 13-15]. 拟多甲藻水华在支流回水区中发生范围最广、 持续时间最久[8]. 研究已表明, 水体理化[16-17]、 水文气象[12, 18]、 浮游植物、 原生动物和浮游细菌群落多样性及丰度[19]、 水体热分层与拟多甲藻的种群变化和水华形成具有较大影响[20], 但这些研究主要集中在水体拟多甲藻水华的影响因素, 却很少关注底泥中拟多甲藻的变化, 因而并不能全面揭示库区拟多甲藻水华的生消过程.
目前, 对底泥甲藻进行定性定量分析中, 普遍使用的沉积物处理方法为筛网过滤法和孢粉学处理法[21]. 筛网过滤难免造成损失, 甲藻孢囊又容易与大量的有机碎屑混杂在一起, 从而导致分析结果不能准确反映沉积物中孢囊的分布状况, 因此, 为了准确了解拟多甲藻在底泥中的分布情况, 本文建立了基于qPCR定量分析三峡库区汝溪河支流回水区底泥中甲藻动态变化的方法, 并对其影响因子进行分析, 以期为库区甲藻水华防治工作提供一定的理论基础和技术支撑.
1 材料与方法
1.1 样点设置
汝溪河发源于万州区分水镇, 流经培文镇, 在梁平区境内和汝溪河另一支流交汇, 经忠县汝溪镇, 最后经涂井乡汇入长江. 全流域面积720 km2, 主河道长54.5 km, 在忠县境内流域面积272.9 km2, 主河道长25.4 km. 多年平均径流总量达1.49×109km3, 是三峡库区重要的一级支流之一. 水库蓄水后, 长江水淹没至涂井乡以上, 形成了长达15 km的汝溪河回水区. 汝溪河支流每年3-5月在涂井乡至龙滩大桥回水区常发生严重的甲藻水华[22]. 为了监测汝溪河底泥甲藻的动态特征, 在汝溪河涂井乡至龙滩大桥设置3个断面(T1-T3), 如图1.
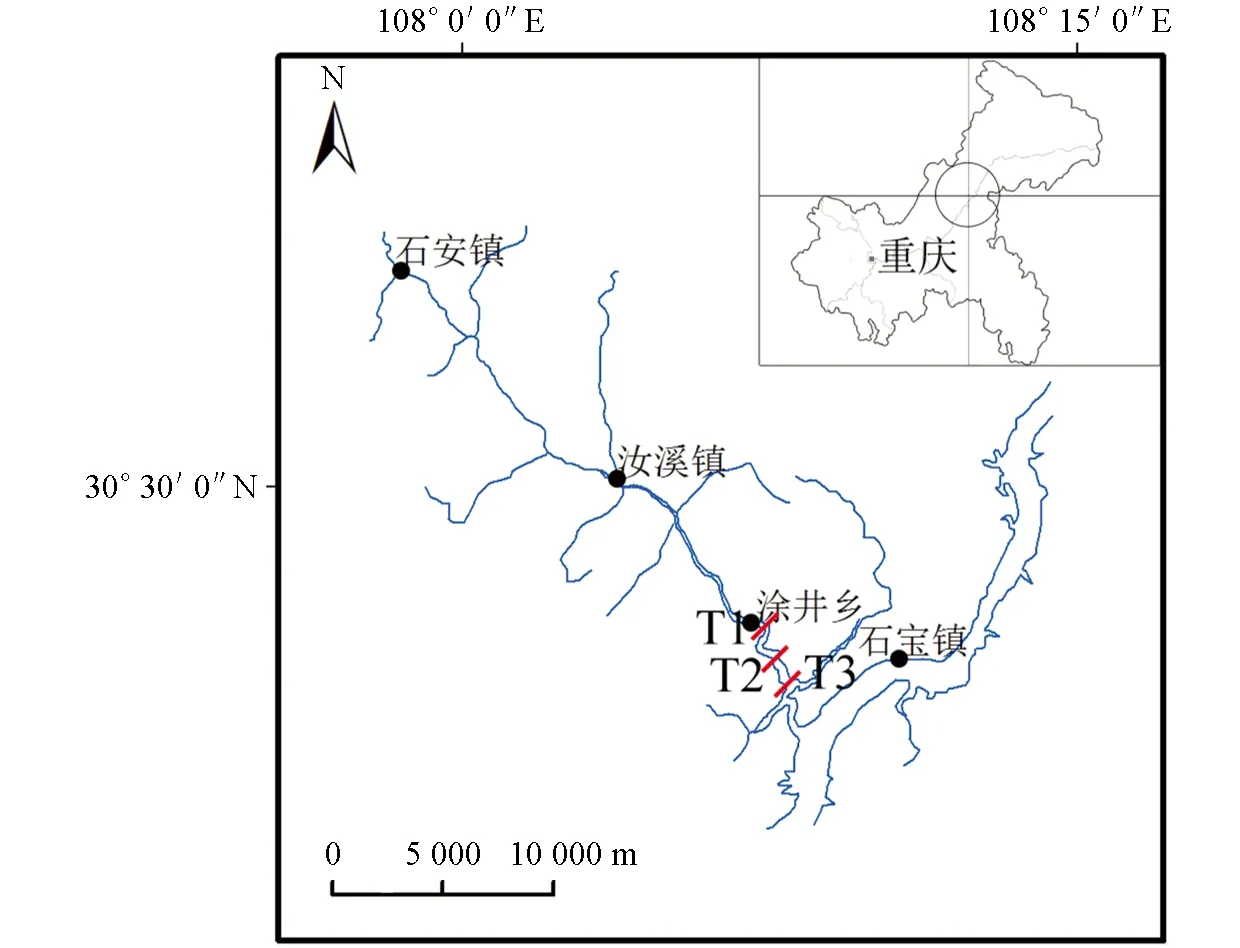
图1 研究断面分布图
1.2 底泥采集及DNA提取
2016年3月至2017年2月的每个月在每个断面的左(S1)、 中(S2)和右(S3)3个样点利用柱状采泥器进行底泥采集. 采集后测定温度并装入自封袋密闭避光保存, 当天带回实验室置于-20 ℃冰箱保存备用. 沉积物经过风干后, 取泥土样2 g于10 mL离心管中, 采取CTAB法提取DNA[23]. 干燥后的DNA溶解于50 μL ddH2O中, 测定吸光度A260和A280, 若A260/A280在 1.8~2.0 之间则置于-20 ℃冰箱保存备用, 否则需要进一步纯化或重新提取.
1.3 PCR扩增及甲藻系统发育树构建
用于PCR扩增28S rDNA基因的引物为DinFif (5′GCATATAAGTAMGYGGWGG3′)和DinRir (5′CCGTGTTTCAAGACGGGTC3′)[24]. 50 μL 反应体系: DNA模板为2 μL, 其余组分按Taq酶(TaKaRa, 日本)说明书的量添加. PCR 反应结束后用1.0%琼脂糖凝胶电泳, 目的片段回收纯化后进行测序(英潍捷基上海贸易有限公司), 获得816 bp序列. 采用Clustal方法进行比对和序列间的遗传变异度分析(Vector10软件, Invitrogen, 美国). 利用获得的816 bp序列与GenBank中的序列进行比对, 通过MEGA5构建最大似然树(Maximum likelihood, ML). 通过自展法分析系统树的稳定性和一致性, 其中各节点代表支的统计置信度以50%为标准[25].
1.4 实时荧光定量PCR
1.4.1 定量PCR引物设计
根据1.3获得的序列, 采用Vector 10软件进行qPCR特异性的引物设计, 引物序列为uPr1(5′GTCAAATTGAGCCGCAAGCTCC3′)和uPf1(5′ATCCGCCTTCGGCACCGTAT3′), 产物片段长度为128 bp, 引物由上海生工合成.
1.4.2 质粒制备
利用挑取的原位水体拟多甲藻作为藻株, 以引物uPf1和uPr1扩增的基因片段回收后通过TA克隆连接到pMD19-T载体(Takara, 日本), 转化感受态Escherichiacoli细胞DH5α, 挑取阳性克隆过夜培养, 质粒的提取采用质粒小提试剂盒(天根, 北京). 选取扩增片段上没有而载体也仅单一酶切位点的DNA内切酶Hind III(Fermentas, 美国)进行酶切, 线性化的质粒电泳回收后溶于ddH2O制备成标准品原液, 其质粒浓度用NanoDrop 1000进行测定(Thermo, 美国), 并根据公式换算成质粒的拷贝数:
Cn=Pc×10-9×6.02×1023/PL×660
式中,Cn为拷贝数(个/L),Pc为质粒浓度(ng/mL),PL为质粒长度(bp). 将重组质粒标准品原液做7个10 倍的梯度稀释, 为qPCR的标准梯度样品, -80 ℃保存.
1.4.3 标准曲线绘制
7个浓度梯度的质粒标准品作为模板, 进行SYBR Green I qPCR反应(ABI7500, 美国). 每个浓度做3个重复, 并加阴性对照. 反应程序: 94 ℃预变性5 min, 94 ℃变性30 s, 54 ℃退火 30 s, 72 ℃延伸40 s, 35个循环; 72 ℃延伸5 min. 为了建立基因拷贝数对数值与qPCR反应循环阈值(荧光信号达到设定的阈值时所经历的循环数,Ct)之间的线性回归方程, 以qPCR反应中相应的Ct值为纵坐标, 模板DNA拷贝数的对数值为横坐标, 绘制标准曲线.
1.4.4 样品检测
环境样品中DNA经过适当稀释, 作为模板进行qPCR反应, 将Ct代入标准曲线获得此样品的拷贝数及其原始环境中的浓度.
1.5 水体理化及底泥营养盐的测定
水体的水温(WT)、 pH、 电导率(EC)、 溶解氧(DO)、 氧化还原电位(ORP)、 浊度(Tur)和水下光照(PAR)现场通过多参数水质分析仪(DS5X, HACH, 美国)进行测定. 将采集的底泥烘干后磨碎, 利用CHNS-O元素分析仪(Hanau, 德国)测定底泥中C和N的质量分数. P, Ca和K质量分数采用硝酸、 双氧水和微波消解仪(Milestone ETHOIS, 意大利)消解后, 用电感耦合等离子光谱仪(ICP-OES, 德国)测定.
1.6 数据分析与处理
汝溪河每季度甲藻拷贝数量与环境因子的关系采用SPSS 22.0软件(IBM, 美国)进行多元逐步回归分析. 甲藻拷贝数和环境因子通过Origin 8.0(Originlab, 美国)进行Pearson相关性分析, 并进行F检验.
2 结果与分析
2.1 汝溪河甲藻系统发育
利用汝溪河甲藻和GenBank藻类的28S rDNA序列构建甲藻系统发育树, 以最大似然法(ML)构建的系统进化树如图2. 结果表明, 汝溪河优势甲藻与倪氏拟多甲藻(Peridiniopsisniei)关系最近, 节点支持率为94%, 且与东湖倪氏拟多甲藻(P.nieiHM596555)和三峡库区香溪河倪氏拟多甲藻(P.nieiFJ 767867)相似度分别为100.0%和99.7%. 该藻细胞卵圆形, 背腹略扁平, 上壳锥形, 下壳略呈锥形且有两根短刺或无刺, 纵沟宽, 上下板片大小几乎相等且板片表面具不规则乳突状, 具红色眼点, 藻细胞长约30 μm, 宽约25 μm. 形态学和分子系统学结果均表明, 汝溪河甲藻为倪氏拟多甲藻.

节点处数字显示高于 50%的节点支持率.图2 28S rDNA 序列的系统进化树

图3 质粒标准品的荧光定量PCR标准曲线
2.2 荧光定量PCR标准曲线
为了验证设计的qPCR引物的特异性, 利用样品DNA进行qPCR扩增, 结果显示溶解曲线峰值单一, 说明该引物对野外样品DNA特异性较好. 克隆质粒标准品经qPCR后结果表明, 各梯度标准品扩增正常, 标准曲线为y=32.58-2.57x,R2=0.999 6, 其中y为Ct,x为模板DNA拷贝数的对数值, 线性良好(图3), 因此, 引物uPr1和uPf1的qPCR可以用于定量汝溪河水华甲藻的拷贝数.
2.3 底泥中拟多甲藻的动态变化
汝溪河底泥样品甲藻的动态变化如图4. 3个断面T1, T2和T3的左(S1)、 中(S2)、 右(S3)样点的底泥甲藻拷贝数均在3-5月间达到最大值. T1和 T3两个断面左样点的每克干燥底泥甲藻基因拷贝数均在4月达到最大值, 为70.18×103个/g和42.77×103个/g; T2断面的S1样点拷贝数在5月达到最大值, 为68.60×103个/g. T1,T2两个断面的S2和S3样点均在4月达到最大值, 而T3断面的S2,S3样点则是在9月和5月达最大值. 随着季节的变化, 底泥甲藻拷贝数也有所不同, 其中春季3个采样断面S1, S2和S3的甲藻拷贝数显著高于夏、 秋、 冬季(p<0.05). 四分位结果表明(图5), 春季拷贝数分布较零散, 但从平均值来看, 春季拷贝数均高于其他3个季节; 夏、 秋和冬3个季节拷贝数差异无统计学意义, 且S1, S2和S3甲藻拷贝数春季差异无统计学意义(p>0.05).
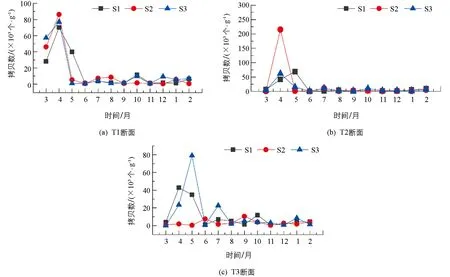
S1, S2和S3分别表示断面的左、 中、 右样点.图4 汝溪河底泥中甲藻的动态变化(2016-2017年)
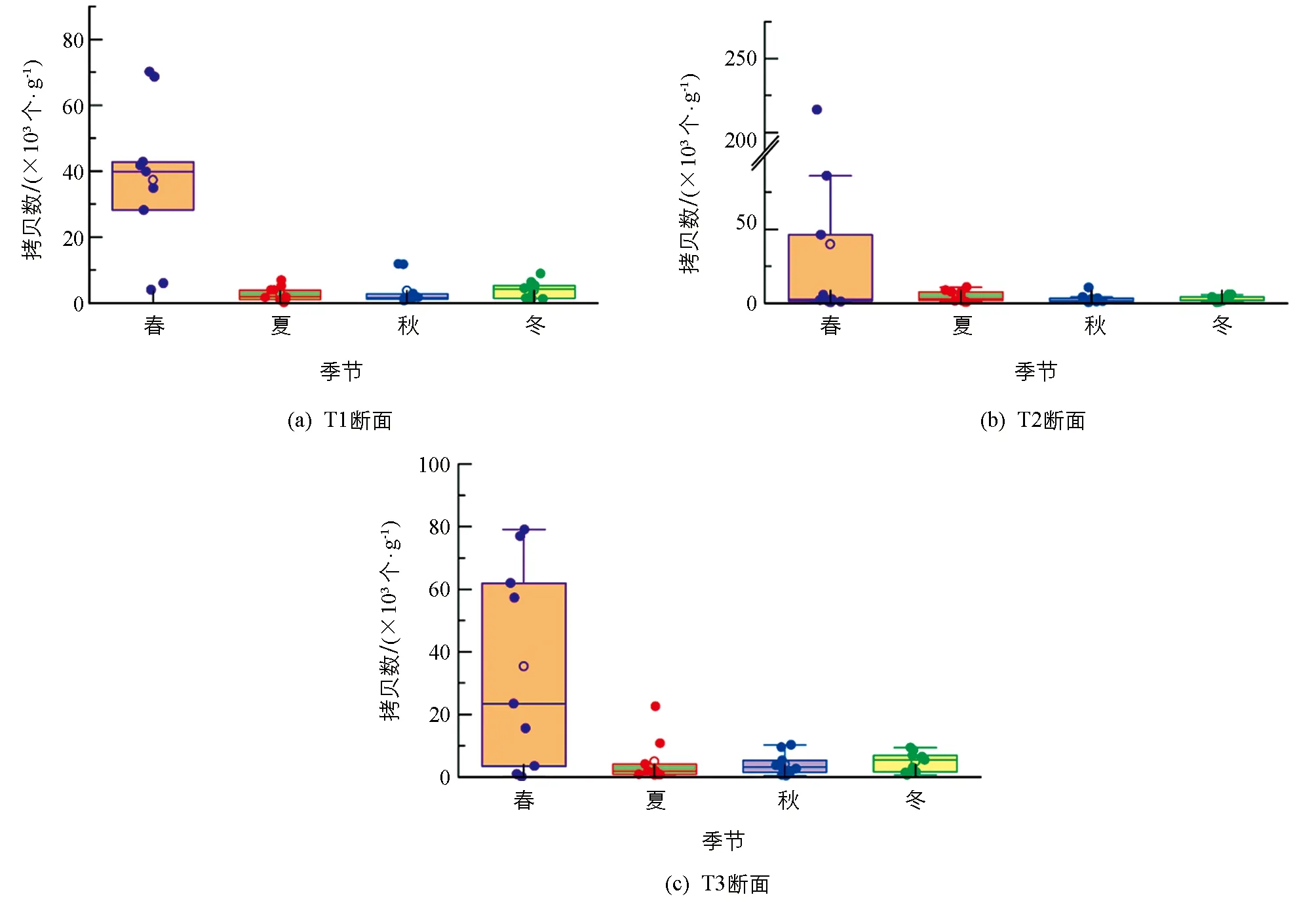
图5 汝溪河底泥中甲藻的季节变化
2.4 底泥拟多甲藻变化与环境因子的关系
各样点底泥的温度均为夏季最高, 保持在30 ℃左右, 其次为秋季、 春季和冬季. 春季底泥的温度维持在20 ℃, 而冬季底泥温度最低, 仅为14.5 ℃. 春季底泥总氮(TN)质量分数最高, 其他3个季节TN质量分数变化不大. 对于总碳(TC)质量分数, 各样点春季底泥最高, 其次为冬季. 冬季总磷(TP)质量分数最高, 保持在0.5 mg/g左右, 其次为秋季、 夏季和春季, 春季保持在0.1 mg/g左右. Ca和K元素4个季节差异无统计学意义. 从全年来看(图6), 底泥中甲藻拷贝数与泥温、 TP和C/P呈线性负相关(p<0.05), 与N/P呈显著正相关(p<0.05), 但与底泥中的TN, TC, Ca和K质量分数无显著相关性(p>0.05). 对不同季节底泥甲藻拷贝数与环境因子进行多元逐步回归分析(表1), 结果发现, 甲藻拷贝数与环境因子之间逐步回归相关系数均在0.7以上, 其中, 春季甲藻拷贝数与泥温显著相关(p<0.05), 相关系数为0.824; 夏季甲藻拷贝数的主要影响因子是Ca和K, 相关系数达0.997; 秋季和冬季的甲藻拷贝数分别与TN和TC显著相关, 相关系数为0.735和0.885.

表1 汝溪河不同季节底泥甲藻拷贝数与环境因子逐步回归分析
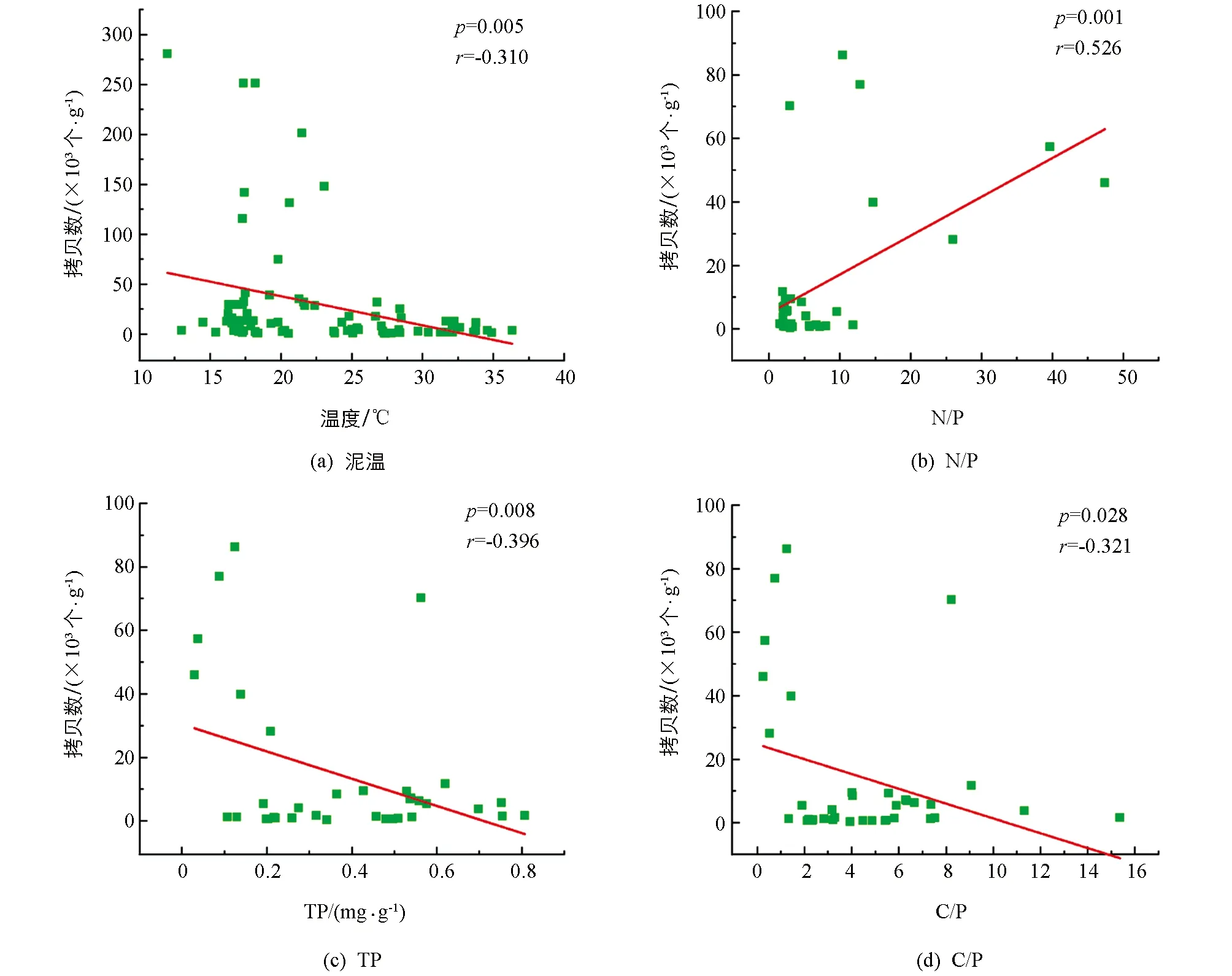
图6 底泥甲藻拷贝数与泥温, TP, N/P和C/P的相关性分析
3 讨论
3.1 实时定量PCR在汝溪河底泥甲藻的应用
孢囊是甲藻生活史中一个特殊且重要的阶段, 在甲藻种群延续及水华形成过程中起着重要的作用[26-27]. 传统的甲藻分类在生态学研究中面临着许多问题: 一方面, 有赖于专业技术及经验性, 并且不同分类学家的分类标准也不完全一致; 另一方面, 因环境的变化而变化的表型特征给鉴定带来一定的困难[21]. 随着分子生物学的发展, Scholin等[28]采用 LSU-rDNA 部分片段序列研究了亚历山大藻(Alexamdrium)的系统进化, 发现A.tamarense,A.catenella和A.fundyense等相似物种能被很好区分开来. Lee等[29]通过LSU-rDNA 系统树分析, 认为韩国水域的Amphidiniummassartii能明显与澳大利亚、 美国和加拿大等地区的藻株区别开来. Saldarriaga等[30]和Zhang等[31]利用LSU和SSU rDNA序列分析了淡水甲藻发育系统, 证实了该序列的甲藻系统发育. 苏玉萍等[32]通过单细胞LSU-rDNA鉴定出福建省九龙江底泥中孢囊优势种为佩氏拟多甲藻(Peridiniopsispenardii). 本研究基于NCBI(https: //www.ncbi.nlm.nih.gov/)甲藻及汝溪河甲藻的LSU-rDNA序列, 构建系统发育树, 结果表明汝溪河的甲藻和拟多甲藻属的多个物种相似性很高, 其中与香溪河和东湖采集的倪氏拟多甲藻相似度分别达到99.7%和100.0%, 因此, 从分子水平上支持了汝溪河的甲藻为倪氏拟多甲藻.
3.2 环境因子对底泥甲藻动态变化的影响
关于拟多甲藻水华的研究已经被广泛报道, 如三峡库区香溪河[14, 33]、 三峡库区童庄河[34]、 贵州省黔东南州三板溪水库[35]、 武汉东湖[12]等. 这些研究发现拟多甲藻水华与TP, TN, NO3-N, N/P, 水体分层等多种因素相关. Pollingher等[36-37]认为甲藻孢囊形成于水华末期, 其他研究表明孢囊形成则发生于整个水华期间[38]. 本研究经过荧光定量PCR方法发现, 汝溪河底泥中每个月均存在甲藻孢囊, 1月、 2月和6-12月底泥甲藻拷贝数差异无统计学意义, 在3-5月不同样点底泥甲藻均达到最大值, 即春季甲藻拷贝数最高(图4和图5), 支持了Pollingher等[36-37]的结论, 即水华末期(5月末)可能是甲藻孢囊形成的重要时期, 而春季应该是甲藻孢囊大量增殖的高峰期.
海底沉积物温度、 生产力也是甲藻孢囊分布的主要影响因素[39-41]. 边归国等[17]研究发现, 甲藻可在10~28 ℃大量繁殖. 本研究发现随着底泥温度的增加, 底泥甲藻呈现出下降的趋势(图6), 春季(3-5月)底泥温度基本维持在20 ℃左右, 因此, 春季底泥甲藻水体温度适宜甲藻的大量繁殖. 通过逐步回归分析(表1)发现, 春季底泥甲藻拷贝数与底泥温度呈显著相关, 夏、 秋季底泥温度相对较高, 而冬季底泥温度相对较低, 对甲藻繁殖均有一定的抑制作用[42]. 郑磊等[43]研究表明, 大鹏湾表层活性磷质量分数高但氮磷比较低的沉积物有利于甲藻孢囊的分布. 研究已发现甲藻水华通常出现在有机物质丰富的水体中[33-34, 44-45], 特别是氮、 磷质量分数丰富的水体中[12]. Sako等[46]发现N, P质量分数对甲藻孢囊的形成具有非常重要作用. 本研究发现, 底泥甲藻变化与TP和C/P比呈负相关关系, 与N/P呈显著正相关, 且回归分析发现, 春、 夏和秋季甲藻拷贝数分别与泥温、 Ca和K, 以及TN的质量分数显著相关(图6, 表1), 支持了郑磊等[43]的研究, 即营养盐变化可能也是汝溪河拟多甲藻动态变化的重要原因之一. 有研究也表明不同的磷浓度和磷形态对拟多甲藻生长具有显著的影响[47], 因此, 推测三峡库区磷浓度及磷形态的变化对三峡库区拟多甲藻水华形成具有重要作用. 此外, 逐步回归分析发现汝溪河底泥冬季甲藻的数量与TC质量分数呈正相关(表1), 说明甲藻水华的发生在一定程度上与有机碳紧密相关. Stéphanie等[48]发现甲藻孢囊的分布与所研究区域的水动力条件、 水文和选择性沉积条件相关, 因此, 要全面揭示三峡库区底泥拟多甲藻的动态变化及水华的形成机制, 需要多种因素综合研究.
3.3 汝溪河甲藻水华的防控
拟多甲藻受光照、 温度、 营养盐成分和其他环境条件的共同影响, 在三峡库区表现出较为复杂的生活史. 研究表明, 拟多甲藻可以在较广温度范围(10~28 ℃)下大量繁殖, 生长的最佳温度为13~15 ℃[17]. 甲藻生长在水流速度较慢的水体中, 临界流速为0.2 m/s, 当水体流速大于临界值时, 甲藻的生长会受到抑制[17]. 甲藻的部分种类可以形成孢囊沉入水底, 在环境条件不利时渡过休眠期, 当条件再次适合时, 孢囊则会迅速萌发, 进入水体进而急剧增加, 形成水华[9, 10]. 三峡库区成库蓄水后, 水库回水区的流速变缓, 营养物质沉降并大量积累, 支流甲藻水华持续发生, 并呈逐年加重趋势[8, 14-15], 因此, 增加水库回水区的流速, 可降低甲藻水华的发生[49]. 此外, 本研究结果发现春、 夏、 秋、 冬季甲藻拷贝数与泥温、 Ca和K, TN, TC显著相关, 表明库区支流水体营养增加会促进甲藻水华的发生, 因此, 为了有效控制库区甲藻水华, 可因地制宜建设农业生态工程. 这样有利于减少流域两岸乡镇生活污水、 垃圾和畜禽养殖场粪便等污染物未达标处理的排入, 减少有机物和含氮物质的污染, 维护并保持完整的水生生态系统的健康, 增加水体的自净能力.
4 结论
1) 基于汝溪河底泥沉积物甲藻的形态学特征及LSU-rDNA系统发育树分析, 此甲藻为倪氏拟多甲藻.
2) 引物uPr1和uPf1可用于汝溪河水华甲藻的实时荧光定量PCR, 其标准曲线为y=32.58-2.57x,R2=0.999 6.
3) 3个采样断面左、 中、 右样点的底泥甲藻拷贝数均在3-5月达到最大值, 且春季底泥中甲藻拷贝数显著高于夏、 秋和冬季.
4) 底泥中甲藻拷贝数与泥温、 TP和C/P呈线性负相关, 与N/P呈显著正相关, 其中, 泥温与春季甲藻拷贝数显著相关, Ca和K显著影响夏季甲藻拷贝数, 而TN和TC则分别是秋、 冬季甲藻拷贝数的主要影响因子.
