受光强调控参与茶树叶绿素代谢的NF-Y家族基因的鉴定与分析
2023-05-23刘珂饴唐千惠张欣韦清俊曾亮吴致君
刘珂饴, 唐千惠, 张欣, 韦清俊, 曾亮, 吴致君
1. 西南大学 食品科学学院,重庆 400715;2. 西南大学 种质创制大科学中心,重庆 401125;3. 西南大学 川渝共建特色食品重庆市重点实验室,重庆 400715;4. 西南大学 茶叶研究所,重庆 400715
核因子Y(nuclear factor Y, NF-Y)转录因子, 又称为CCAAT结合因子(CBFs)或血红素激活蛋白(HAPs), 通过与启动子CCAAT-box元件结合调控下游基因转录[1]. CCAAT-box是真核生物生命活动重要的调控元件, 存在于30%真核启动子中[2]. 植物中NF-Y家族由NF-YA,NF-YB和NF-YC亚家族成员组成[3]. NF-YA蛋白存在A1和A2两个α螺旋结构域组成的保守核心区域, 负责直接与CCAAT-box元件特异性结合[4-5]. NF-YA发挥转录功能还需要NF-YB和NF-YC参与互作, 聚合形成异三聚体复合物[6-7]. NF-YB和NF-YC蛋白的保守结构域由3个α螺旋、 2个β链环和1个短αC螺旋组合而成[5-6, 8-9]. 此外, 异二聚体复合物NF-YB-YC还可以与其他转录因子结合, 形成非典型的三聚体复合物, 结合到目标基因的启动子区域顺式元件上发挥作用[10-12].
光是植物赖以生存的基础,NF-Y家族部分成员响应光且介导了光信号的调控[13-18]. 小麦光照处理后, 叶片中TaNF-YC3/5/8/9/11/12基因表达上调[14]. 在拟南芥中,AtNF-YA5和AtNF-YB9的T-DNA插入突变体表现出蓝光介导的Lhcb基因表达水平降低[13];AtNF-YC1/3/4/9在光照条件下通过与组蛋白脱乙酰酶HDA15相互作用, 调节相关染色单体上的组蛋白H4乙酰化水平, 从而抑制下胚轴伸长相关基因表达[17];AtNF-YC9在光介导下胚轴伸长过程中发挥抑制油菜素内酯生物合成和信号转导的双重作用[16]. 小麦TaNF-YB3和马铃薯StNF-YB3的过表达显著提高叶绿素生物合成途径关键限速酶基因GluTR的表达水平[15, 18]. 研究发现,NF-Y基因的过表达提高了植株对干旱、 高温、 低温、 洪涝、 盐害等非生物胁迫的抗性, 转基因植株中叶绿素质量分数通常更高[19-21].
茶树(CamelliasectThea)是一种山茶科、 山茶属常绿木本经济植物, 广泛种植于世界各地[22]. 叶绿素是茶叶中重要的色素成分, 其含量的高低与茶叶色泽品质密切相关[23]. 茶树中叶绿素易受环境光强的影响, 强光下易发生部分降解, 而适度遮荫可促进其含量增加[24-25]. 研究发现, 茶树叶绿素代谢途径的结构基因, 包括GluTR、POR、CAO等, 受到了光信号调控[24]. 遮荫条件下, 茶树CsPIF7和CsHY5光信号通路转录因子通过调节叶绿素代谢途径基因CsPOR影响叶绿素的合成和降解[26-27]. 然而, 叶绿素代谢途径结构基因光响应启动子元件众多, 仍可能存在其他的光响应调控路径. 研究发现, 茶树NF-Y家族基因启动子区域的光响应元件数量和种类较多[28]. 转录组分析显示, 光强引起了茶树中部分NF-Y家族基因的表达差异[29], 并且茶树叶绿素代谢途径部分结构基因启动子区域存在CCAAT-box元件[30-31]. 因此,NF-Y家族基因可能在光信号中介导了茶树叶绿素的代谢调控.
本研究通过对光强处理样本转录组数据的分析与检索, 获得了茶树NF-Y家族和叶绿素代谢途径中响应光强信号的差异表达基因. 通过生物信息学分析, 以及光强处理茶叶中叶绿素质量分数和基因表达实时荧光定量qRT-PCR检测, 对可能调控叶绿素代谢的CsNF-Y家族成员进行了关联与筛选. 本研究为光介导的茶树叶绿素代谢调控研究提供了新的思路.
1 材料和方法
1.1 植物材料和处理方法
供试材料选用茶树品种“福鼎大白茶”一年生扦插苗, 购自南京雅润茶叶有限公司. 将茶树幼苗种植于蛭石和营养土混合基质的塑料盆中, 放置于人工气候光照培养箱中培养30 d. 培养条件为: 温度25 ℃、 相对湿度75%±5%、 光照160 μmol/(m2·s)、 光周期昼/夜为16 h / 8 h. 将预培养30 d后的茶树幼苗分成4组, 分别暴露于15,160,200,240 μmol/(m2·s)光强下, 其他条件保持一致. 在光处理15 d时取幼苗第一叶和第二叶的混合样品, 液氮速冻后保存于-80 ℃超低温冰箱中, 用于总RNA的提取和叶绿素质量分数的测定. 每个处理设置3次生物学重复, 采集的0 d样品作为空白对照.
1.2 生物信息学分析
茶树CsNF-Y家族基因基于基因组测序数据(https//tpia. teaplant. org/)和之前的鉴定报道[32-33]. 将拟南芥信息资源库(https: //www. arabidopsis. org/)中获得的叶绿素代谢途径结构基因序列用作同源对比, 检索茶树基因组中注释的叶绿素代谢途径结构基因. 从本地茶树转录组数据中获取茶树CsNF-Y家族和叶绿素代谢途径结构基因在光强处理下的FPKM值, 利用Heatmapper网站(http: //www. heatmapper. ca/expression/)绘制热图. 启动子区域的检索采用BioEdit软件完成, 绘图通过TBtools软件完成.
1.3 叶绿素质量分数测定和相关性分析
采用无水乙醇与丙酮(V∶V=1∶2)浸提比色法测定叶绿素质量分数. 将茶树叶片取下用蒸馏水清洗表面, 去掉中脉, 称取约0.1 g放入研钵中. 加入1 mL蒸馏水, 在弱光条件下充分研磨, 转入10 mL试管中. 用乙醇丙酮混合液冲洗研钵, 将所有冲洗液转入10 mL试管中, 用乙醇丙酮混合液定容至10 mL, 置于黑暗条件下浸提3 h. 在645 nm和663 nm波长下测定提取液吸光度值, 每个样品测定3次. 叶绿素质量分数计算公式为: 叶绿素质量分数(mg/g)=2.021×WOD645+0.802×WOD663. 利用SPSS软件分析叶绿素质量分数和基因表达谱皮尔逊相关性.
1.4 基因表达qRT-PCR分析
利用Quick RNA Isolation Kit试剂盒(北京华越洋生物科技有限公司)提取样品中总RNA, 用反转录试剂盒GoldenstarTMRT6 cDNA Synthesis Kit(北京擎科生物科技有限公司)合成cDNA. 利用Primer Premier 5.0软件设计qRT-PCR检测引物(表1). 茶树CsTIP41作为光强处理的内参基因[34]. 荧光试剂为MonAmpTMChemoHS qPCR Mix(Monad). 使用CFX96TMReal-Time System荧光定量PCR仪(美国伯乐公司)测定候选CsNF-Y基因表达谱. qRT-PCR扩增体系(20 μL): 10 μL MonAmpTMChemoHS qPCR Mix(Monad), 各1 μL正、 反向检测引物, 2 μL模板cDNA和6 μL Nuclease-Free Water. 扩增程序为: 95 ℃预变性10 min; 95 ℃变性10 s, 60 ℃退火延伸30 s, 40个循环. 3次生物学重复后, 采用2-ΔΔCt的方法计算基因的相对表达水平[35].
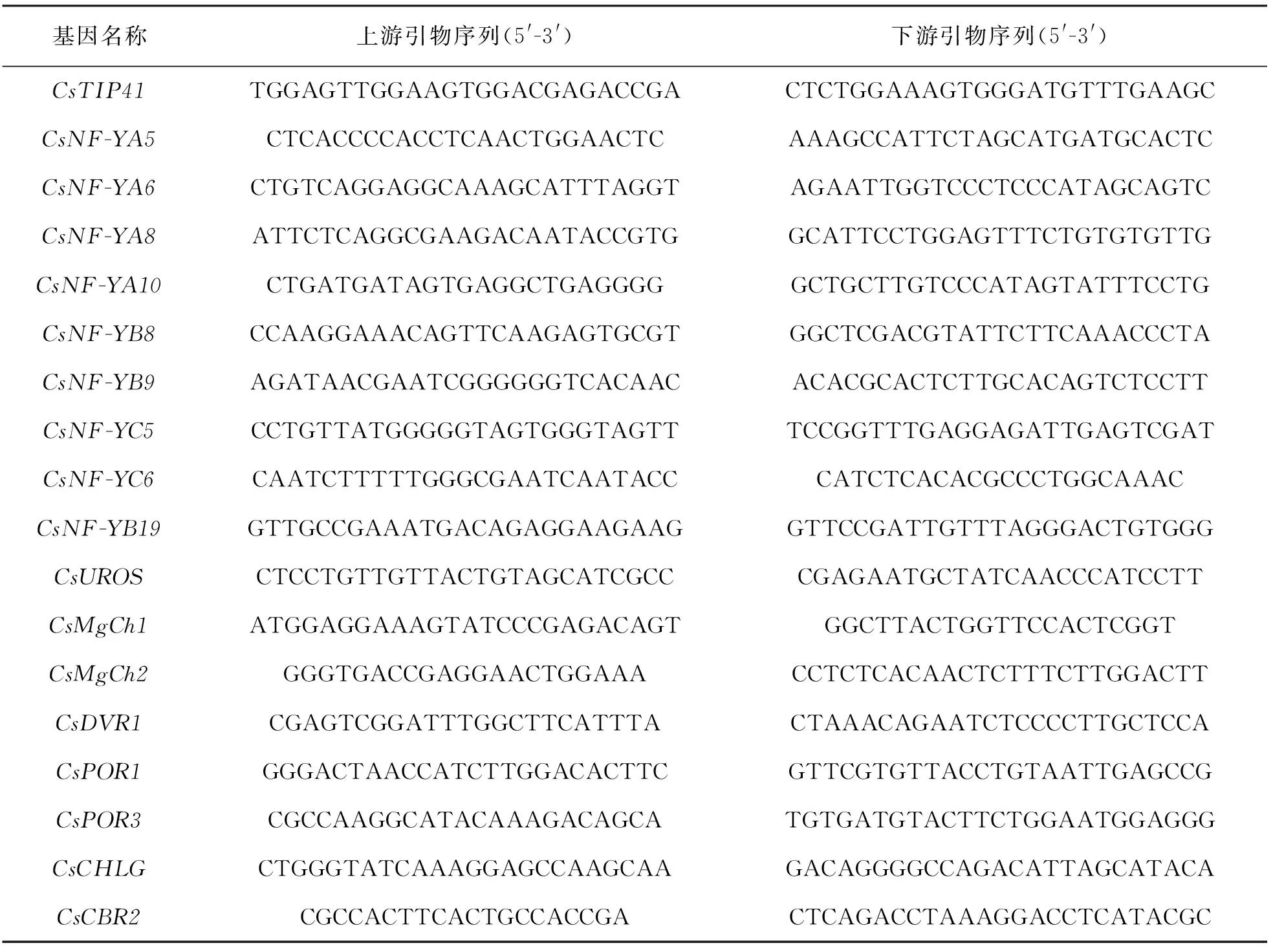
表1 qPT-PCR所用内参基因和引物序列
2 结果和分析
2.1 茶树CsNF-Y家族基因光强响应表达
根据之前的报道, 茶树基因组中存在45个CsNF-Y家族基因[32]. 光强处理转录组数据分析显示, 34个CsNF-Y基因在光照条件下响应表达, 其中9个为差异表达基因(图1a). 在LT4处理中,CsNF-YA5,CsNF-YA10和CsNF-YB19是显著上调的, 而CsNF-YA6,CsNF-YA8,CsNF-YB8,CsNF-YB9,CsNF-YC5和CsNF-YC6是显著下调的. 除此之外, 在LT4处理中,CsNF-YA2,CsNF-YB5,CsNF-YB17,CsNF-YB20,CsNF-YC3和CsNF-YC11呈现上调趋势,CsNF-YA4,CsNF-YA7,CsNF-YB2,CsNF-YB7,CsNF-YB10和CsNF-YC8呈现下调趋势. 进一步通过qRT-PCR方法验证差异表达基因在4组光强条件下(LT1,LT2,LT3和LT4)的表达规律. 结果显示,CsNF-YA5和CsNF-YA10的相对表达水平随光强增加呈上升的趋势, 而其他基因与强光差异的线性关系不明显(图1b).CsNF-YB19的相对表达水平呈先下降后上升的趋势,CsNF-YA6,CsNF-YA8,CsNF-YB8,CsNF-YB9,CsNF-YC5和CsNF-YC6的相对表达水平呈先上升后下降的趋势. 荧光定量结果中CsNF-YA5,CsNF-YA8和CsNF-YA10的表达趋势与转录组数据是一致的. 其他几个基因表达尽管在两种检测中存在差异, 但似乎具有一定的规律: 随光强增加, 转录组中下调的差异基因在荧光定量检测中呈先上升后下降的趋势, 而转录组中上调的差异基因在荧光定量检测中呈先下降后上升的趋势(图1).
LT1,LT2,LT3,LT4光强处理分别为15,160,200,240 μmol/(m2·s).
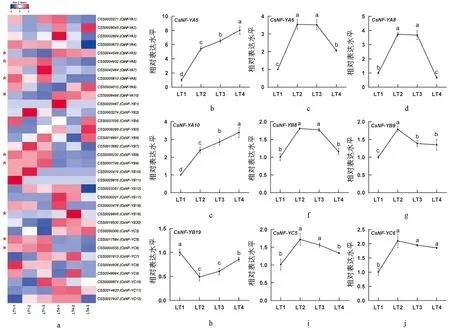
a为茶树CsNF-Y家族基因转录组热图; b-j为差异表达基因的qRT-PCR分析图.图1 不同光强处理下茶树CsNF-Y家族基因转录组热图及差异表达基因的qRT-PCR分析
2.2 茶树叶绿素代谢途径结构基因光强响应表达
通过同源比对, 从茶树基因组中检测到18种酶参与了叶绿素的代谢(图2a). 光强处理转录组数据分析显示, 40个编码基因在光照条件下响应表达, 其中8个为差异基因(图2a). 在LT4处理中,CsUROS,CsMgCh1,CsMgCh2,CsDVR1,CsCHLG和CsCBR2是显著上调的, 而CsPOR1,CsPOR3是显著下调的. 除此之外, 在LT4处理中,CsGluTRs,CsGSA-AM1,CsPBGS1,CsPBGDs,CsUROD3,CsCPOXs,CsCBR1,CsHCAR和CsSGR2等基因呈现上调趋势,CsPBGS2,CsUROD2,CsPPOX和CsCAO等基因呈现下调趋势. 在LT4处理中, 叶绿素代谢途径结构基因表达整体呈上调趋势, 在叶绿素生物合成途径末端几个基因下调表达较明显. 进一步通过qRT-PCR方法验证差异表达基因在4组光强条件下(LT1,LT2,LT3,LT4)的表达规律. 结果显示:CsUROS,CsMgCh1,CsMgCh2,CsCBR2和CsCHLG的相对表达水平随光强增加而呈上升的趋势, 而其他基因与强光差异的线性关系不明显(图2b).CsDVR1的相对表达水平呈先升后降的趋势,CsPOR1的表达水平呈先降后升的趋势,CsPOR3的相对表达水平呈整体下降趋势. 荧光定量结果中, 除了CsPOR1, 其他7个基因的表达趋势与转录组数据是一致的(图2).
LT1,LT2,LT3,LT4光强处理分别为15,160,200,240 μmol/(m2·s).
2.3 茶树叶绿素代谢途径结构基因启动子区域CCAAT-box元件分析
CCAAT-box是NF-Y转录因子发挥转录调控作用的特异结合位点, 有正向和反向两种类型[36]. 为了分析茶树中NF-Y家族对叶绿素代谢途径结构基因可能的转录调控作用, 利用BioEdit软件对叶绿素代谢途径结构基因上游1 000 bp启动子区域内的CCAAT-box元件进行检索(图3). 结果显示, 33个基因启动子区域中共发现114个CCAAT-box元件, 其中正向56个和反向58个. 其他7个基因, 包括CsUROD1,CsCPOX1,CsMgPMT,CsDVR3,CsCHLG,CsHCAR和CsSGR3, 启动子区域不含CCAAT-box元件. 所有检测基因的CCAAT-box元件数量在0~13范围. CCAAT-box元件最多的基因是CsGSA-AM1和CsGSA-AM2, 均含有13个CCAAT-box元件. 其次,CsGluTR3,CsCPOX2,CsMgPMEC1和CsMgPMEC1基因启动子区域含5或6个CCAAT-box元件. 大多数基因启动子区域的CCAAT-box元件数量在3个以内.CsPBGS1,CsUROD2,CsMgCh1,CsMgCh3,CsDVR1,CsCBR1,CsSGR1和CsSGR4只含正向CCAAT-box元件, 而CsPBGD1,CsPBGD2,CsUROS,CsPOR2,CsPOR3和CsCAO只含反向ATTGG-box元件. 此外,CsGluTR1,CsUROS,CsMgCh2和CsSGR2基因上游100 bp内含有CCAAT-box元件.
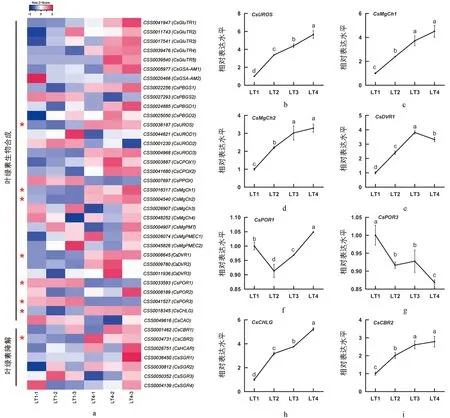
a为茶树叶绿素代谢途径基因转录组热图; b-j为差异表达基因的qRT-PCR分析图.图2 不同光强处理下茶树叶绿素代谢途径基因转录组热图及差异表达基因的qRT-PCR分析
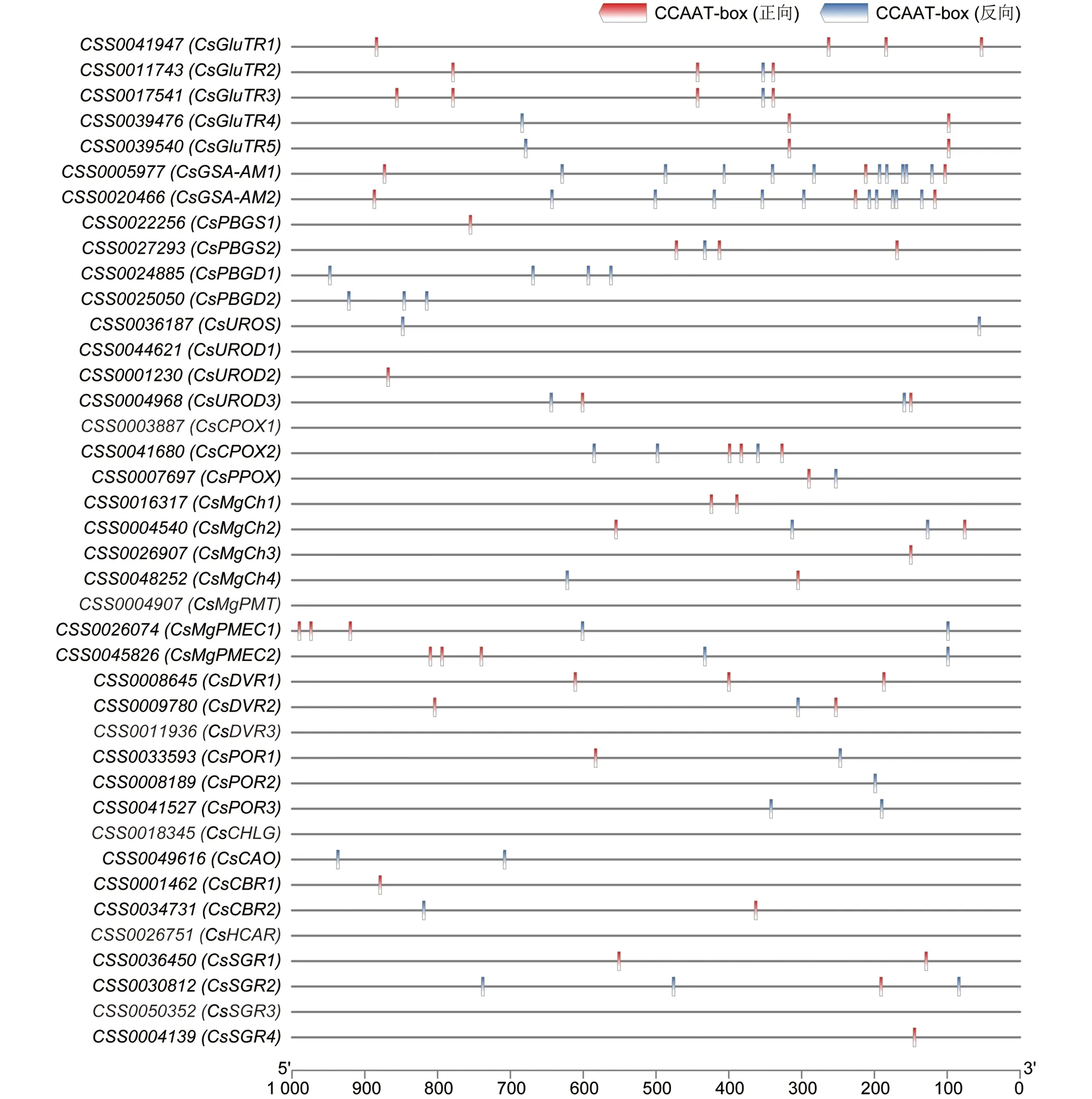
图3 叶绿素代谢途径结构基因启动子区域CCAAT-box元件分析
2.4 茶树叶绿素检测及相关性分析
茶树叶绿素质量分数受到环境光强条件的影响[24-25]. 为了分析茶树叶绿素质量分数受光强影响的变化规律, 通过无水乙醇与丙酮浸提比色法测定了4组光强条件下(LT1,LT2,LT3,LT4)的叶绿素质量分数. 结果显示, 叶绿素质量分数随光强的增加呈下降的趋势(图4c). 为了解CsNF-Y差异基因是否与叶绿素代谢相关, 将4组光强条件下CsNF-Y与叶绿素代谢途径差异表达基因的qRT-PCR结果进行皮尔逊相关性分析. 结果显示,CsNF-YA5,CsNF-YA10的表达水平与CsUROS,CsMgCh1,CsMgCh2,CsCBR2和CsCHLG的表达量呈显著正相关, 与CsPOR3的表达水平呈显著负相关(图4a和4b). 同样采用皮尔逊相关性方法, 对4组光强条件下叶绿素代谢途径差异基因qRT-PCR结果和叶绿素质量分数之间的相关性进行分析. 结果显示,CsUROS,CsMgCh2和CsCBR2的表达量与叶绿素质量分数显著负相关(图4b和4c). 因此, 从相关性角度,CsUROS,CsMgCh2和CsCBR2可能建立了CsNF-YA5,CsNF-YA10与叶绿素代谢之间的网络调控关系.
LT1,LT2,LT3,LT4光强处理分别为15,160,200,240 μmol/(m2·s).
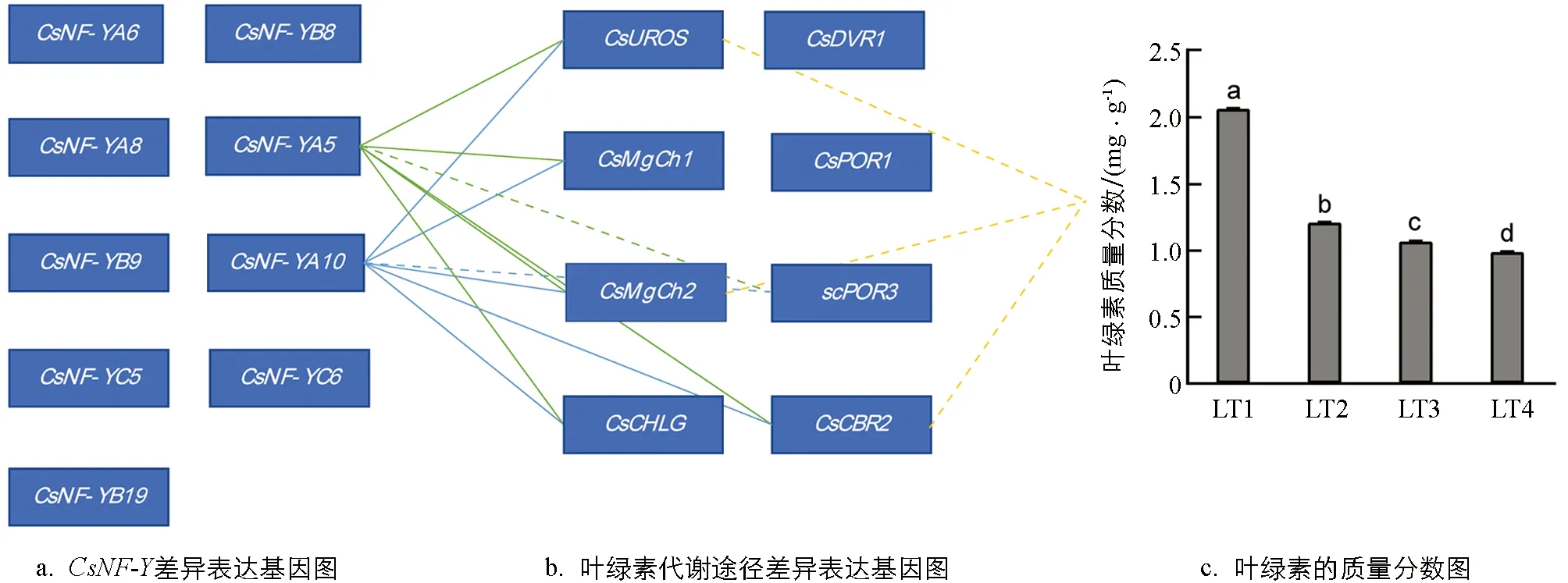
实线代表正相关, 虚线代表负相关(p<0.05).图4 不同光强处理下CsNF-Y家族基因参与叶绿素代谢调控的相关性分析
3 讨论
研究表明, 植物NF-Y家族部分成员参与了光响应调控[13-18]. 本研究发现, 茶树CsNF-Y的转录表达与光强条件密切相关, 其中9个为统计上的差异表达基因, 涉及NF-YA,NF-YB和NF-YC亚家族. 通过同源基因的物种间比较,NF-Y家族基因的光响应调控可能存在物种差异[14,37]. 小麦暴露于500 μmol/(m2·s)光强中, 叶片中TaNF-YC3/5/8/9/11/12的表达水平上调, 而拟南芥暴露于同等光强下, 多个NF-YC亚家族成员(AtNF-YC1,AtNF-YC4和AtNF-YC8)表达水平下调[14, 37]. 在茶树中,AtNF-YC1/4的同源基因CsNF-YC1/2在光照下未检测到表达. 此外,NF-Y家族基因的光响应表达与光照强度也有关. 当拟南芥暴露于20 μmol/(m2·s)光强时, 叶片中AtNF-YC4的表达水平出现了上调[37]. 本研究通过4组光强的检测发现光响应的NF-Y家族基因的确在差异光强中表达水平是不稳定的. 差异表达基因的荧光定量结果显示, 茶树NF-Y家族基因在一定范围内的光强响应存在几种表达模式, 包括上调、 先上调后下调和先下调后上调, 表明茶树NF-Y家族基因在光强响应下可能参与多种生物学过程.
植物中叶绿素代谢受到了光信号的调控已在许多文献中被报道[31, 38-41]. 本研究发现, 茶树叶绿素代谢途径中结构基因的转录表达与光强条件密切相关, 其中8个为统计上的差异表达基因, 对应编码UROS,DVR,MgCh,POR,CHLG和CBR酶. UROS,DVR,MgCh,POR和CHLG参与叶绿素的生物合成, 催化羟甲基胆色素原到叶绿素a/b合成过程, 而CBR是叶绿素降解过程中的关键酶, 催化叶绿素b产生7-羟甲基叶绿素a, 从而激活叶绿素降解过程[42]. 荧光定量结果显示, 这些基因在差异光强中表达模式具有一定的规律, 其中CsUROS,CsMgCh1,CsMgCh2,CsDVR1,CsCHLG和CsCBR2的表达水平随光强增强而上调,CsPOR3的表达水平随光强增强而下调,CsPOR1的表达水平随光强增强呈先下调后上调的特征. 在不同植物中, 叶绿素代谢途径中这些同源基因存在相似的光强响应特征[31, 38-41]. 兰花在光处理后, 叶片中UROS基因表达上调[38]; 拟南芥AtCHLG基因受光诱导表达[39]; 薇甘菊POR基因表达在强光中下调[40]; 盐藻DsCBR基因表达在强光中上调[41]; 茶树品种“黄金芽”遮光处理后, 叶片中CsDVR和CsMgCh基因表达显著下调[31]. 我们注意到在叶绿素合成途径末端茶树CsPORs和CsCAO基因下调明显, 且降解关键酶编码基因CsCBR2显著上调. 研究表明, 拟南芥CBR酶编码基因在强光中上调表达激活了叶绿素的降解程序[42]. 因此, 茶树叶绿素途径结构基因表达尽管受强光诱导整体呈上调趋势, 但这些基因可能在调控光强介导的叶绿素降解过程中发挥了重要作用.
CCAAT-box元件存在于动物、 植物和酵母的基因启动子中, 可以通过与NF-Y转录因子结合进而调控基因的表达[36, 43]. 研究发现, NF-Y转录因子与CCAAT-box的亲和力与CCAAT侧翼序列、 基因距离有关[36, 43]. 高亲和力的CCAAT-box结合位点含有[T/C][A/G][A/G]作为5’侧翼序列, CA作为3’侧翼序列, 侧翼序列含有的核苷酸相似度越高, 亲和力越高[43]. 通常, CCAAT-box主要出现于60~100 bp起始位点间[2]. 本研究通过对比茶树叶绿素途径结构基因表达与启动子区域CCAAT-box元件数量、 位置, 发现基因的表达水平与CCAAT-box元件数量无明显关联, 而可能与该元件所在位置有关. 启动子区域100 bp内存在CCAAT-box元件的基因, 包括CsGluTR1,CsUROS,CsMgCh2和CsSGR2, 均在强光中具有上调表达的趋势. 茶树NF-Y可能在光信号中参与了这几个基因的转录调控. 在小麦和马铃薯中已发现,GluTR基因的表达受到了NF-Y的调控[15, 18]. 在关联分析中,CsUROS,CsMgCh2和CsCBR2基因响应光强的上调表达模式与叶绿素质量分数呈显著负相关关系, 且与CsNF-YA5,CsNF-YA10的表达水平呈显著正相关.CsCBR2基因在0~100 bp起始位点间未发现CCAAT-box, 但在1 000 bp内的ATTGG侧翼存在TTG序列, 该侧翼是否增强了NF-Y对结合位点的亲和力尚待研究. 拟南芥NF-YA亚家族基因的过表达对叶绿素代谢的影响存在个体差异, 如过表达AtNF-YA5引起了叶绿素质量分数的下降, 而过表达AtNF-YA7促进了叶绿素的形成[20,44]. 本研究中, 茶树在强光中叶绿素的降解与NF-YA亚家族基因CsNF-YA5,CsNF-YA10表达上调是有关的.CsNF-YA5,CsNF-YA10可能通过CsUROS,CsMgCh2和CsCBR2参与了叶绿素代谢的调控.
