特发性炎性肌病不同亚型临床特征、肌炎抗体谱、肌电图的差异性表现
2023-05-22李筱筱李雨薇孙莉马艳
李筱筱,李雨薇,孙莉,马艳
特发性炎性肌病(idiopathic inflammatory myopathy,IIM)是一组异质性的自身免疫性疾病,肌无力、肌肉耐力差和肌痛是疾病的共同特征,同时在不同类型肌炎患者之间发现了皮疹、关节炎、间质性肺疾病(intersititial lung disease,ILD)和心脏受累等表现。目前,IIMs最常被细分为多肌炎(polymyositis,PM)、皮肌炎(dermatomyositis,DM)、包涵体肌炎和免疫介导的坏死性肌病,其中临床上又以PM、DM最为常见。这种分类方法存在一定的局限性,部分患者可能不存在肌肉受累,如临床无肌病性皮肌炎(clinically amyopathic dermatomyositis,CADM),以皮疹、间质性肺炎等肌外表现为主。不同的肌炎类型存在不同的临床表现、肌炎特异性抗体(myositis specific autoantibodies, MSA)及肌电图表现,这可以用来区分具有相同的并发症、治疗效果和预后的患者亚组。本研究对IIMs不同亚型患者间临床特征、肌炎抗体、肌电图的差异进行回顾性分析,报道如下。
1 资料与方法
1.1 一般资料 选取2017年2月—2021年2月在中国科技大学附属第一医院风湿免疫科治疗且资料完整的IIM患者179例,按疾病类型分为DM、PM、CADM 3组。DM组135例,其中男性49例,女性86例,年龄(51.23±13.38)岁;PM组26例,男性5例,女性21例,年龄(51.35±13.36)岁;CADM组18例,男性6例,女性12例,年龄(50.92±12.96)岁。3组性别、年龄比较差异无统计学意义(P>0.05)。PM、DM的诊断需符合1975年Bohan/Peter标准[1-2]:(1)对称性近端肌无力,伴或不伴吞咽困难和呼吸肌无力;(2)血清肌酶升高,特别是肌酸激酶升高;(3)肌电图异常:肌源性损害,有插入电位延长、纤颤及正相电位、短时限的多相电位和重收缩时的病理干扰相;(4)肌活检异常:可见肌纤维变性、坏死、被吞噬和再生,间质有炎性细胞浸润和纤维化;(5)特征性的皮肤损害。具备前4项者,可确诊PM;具备第5条,再加3项或4项可确诊为DM。CADM需符合Sontheimer标准[1-3]:具有典型皮肌炎皮疹,但无肌病或者轻度肌病表现。排除标准:患者合并其他肌病,如代谢相关性肌病、药物相关性肌病、包涵体肌炎、肌营养不良等。本研究经医院医学伦理委员会审核批准(2022-RE-465),患者及家属均知情同意并签署知情同意书。
1.2 观测指标与方法
1.2.1 肌炎特异性抗体检测:患者空腹状态下抽取静脉血并分离血清,放置在-80℃冰箱备用,按标准操作流程以免疫印迹方法进行检测,MSAs试剂盒由欧蒙医学诊断中国有限公司提供。12种MSAs分别为:抗组氨酰tRNA合成酶(Jo-1)、抗丙氨酰tRNA合成酶(PL-12)、抗甘氨酰tRNA合成酶(EJ)、抗核基质蛋白2(NXP2)、抗异亮氨酰tRNA合成酶(OJ)、抗黑色素瘤分化相关基因5 (MDA5)、抗核小体重塑脱乙酰酶-2α(Mi-2α)、Mi-2β、抗信号识别颗粒(SRP)、抗转录中介因子1γ (TIF1γ)、抗小泛素样修饰物激活酶1(SAE1)和抗苏氨酰tRNA合成酶(PL-7)。
1.2.2 肌电图检测:分别选取患者至少四处肌肉组织进行检测,包括左右肱二头肌、左右三角肌、左右股四头肌内侧头、左右胫前肌等,对被检肌的运动单位电位(motor unit action potential,MUP)平均时限、平均波幅、MUP数量、多相波所占百分比进行比较,如出现MUP平均时限缩短、波幅下降、MUP数量增多、多相波比例增多,且超过正常值的20%为异常,诊断为肌源性损害;对尺神经、正中神经、左右胫神经、左右腓总神经进行运动神经传导速度检测,尺神经、正中神经、腓浅神经、腓肠神经进行感觉神经传导速度检测,检测内容分别包括潜伏期、波幅、传导速度等。均采用美国Medtronic公司生产的Keypoint台式肌电诱发电位仪进行检测。

2 结 果
2.1 不同亚型IIM患者临床表现比较 DM、PM、CADM组均有肌痛表现,DM、PM同时存在肌无力表现,而CADM较少出现肌无力表现。DM、CADM组患者几乎均存在经典的皮肤表现(向阳疹、披肩征、V字征、Gottron征),而PM则极少或基本无皮疹表现;DM、CADM组患者向阳疹、披肩征、V字征的频率比较差异无统计学意义(P>0.05),Gottron征出现的频率比较,CADM组>DM组>PM组(P<0.01)。3组合并症、发热、闷喘、关节痛、肌痛、吞咽困难、雷诺现象、技工手、肿瘤、间质性肺炎、合并感染等比较差异均无统计学意义(P>0.05),见表1。
2.2 不同亚型IIMs患者MSAs表达比较 12种MSAs中,抗MDA5抗体(35.2%)最常见,其次是抗氨基酰tRNA合成酶(ARS)抗体[34.1 %,包括抗Jo-1、PL-7、PL-12、EJ抗体,其中抗Jo-1抗体阳性率最高(54.1%)],再次是抗TIF1γ抗体(10.6%)和抗Mi-2β抗体(8.3%)。在IIMs亚型中抗MDA5抗体阳性率比较,CADM组>DM组>PM组(P<0.01);CADM组患者无抗Jo-1抗体、抗SRP抗体,PM组患者抗Jo-1抗体、抗SRP抗体阳性率高于DM组(P<0.05),CADM组患者抗OJ抗体阳性率高于PM组和DM组(P<0.05)。余抗体在3组患者中的表达比较差异无统计学意义(P>0.05),见表2。
2.3 不同亚型IIMs患者肌电图结果比较 179例IIMs患者中,送检肌电图112例,其中肌电图结果提示异常105例(93.8%),肌源性损害88例(78.6%),神经源性损害54例(48.2%)。PM组送检肌电图19例,出现肌电图结果异常18例;DM组送检81例,结果异常75例;CADM组送检12例,结果异常12例。3组间肌电图异常率、肌源性损害、神经传导速度异常比较差异均无统计学意义(P>0.05),见表3。
3 讨 论
特发性炎性肌病(IIM)是包括DM、PM、重叠性肌炎(OM)、散发性包涵体肌炎(IBM)和坏死性自身免疫性肌病(NAM)的总称,也称为免疫介导的坏死性肌病。除IBM外,几乎所有炎性肌病均表现为亚急性对称近端无力[4]。临床上常见的肌炎类型为DM、PM,DM典型的临床表现为皮肤病变和进行性对称的近端肌肉无力。其中30%~50%的患者在出现肌炎前3~6个月出现皮肤表现,10%的患者在出现皮肤症状前表现为肌肉症状[5-6]。CADM是DM的一个独特亚型,约占DM的20%,其特征为仅存在DM的皮肤学表现,但不累及肌肉[4,7-8]。本项研究也证实了以上情况,DM、PM、CADM 3种类型的患者均表现出肌肉疼痛,但CADM患者则较少出现肌无力的表现。同时,DM、CADM患者几乎均存在经典的皮肤表现(向阳疹、披肩征、V字征、Gottron征),PM患者则无皮肤表现,仅出现肌痛、肌无力的症状。
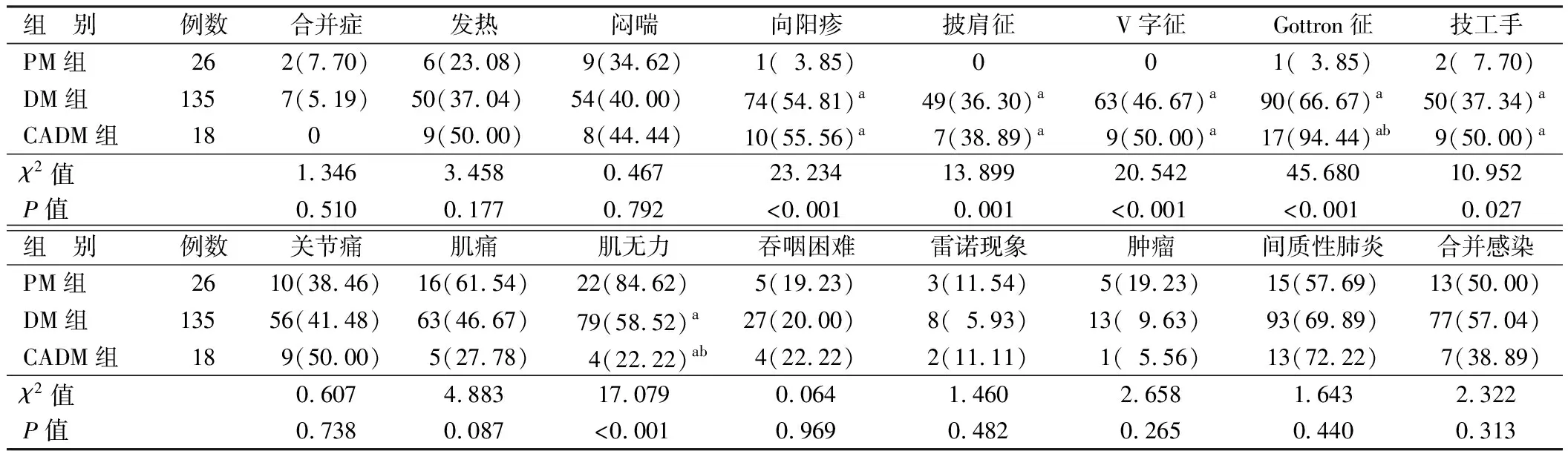
表1 IIMs患者不同亚型临床表现比较 [例(%)]
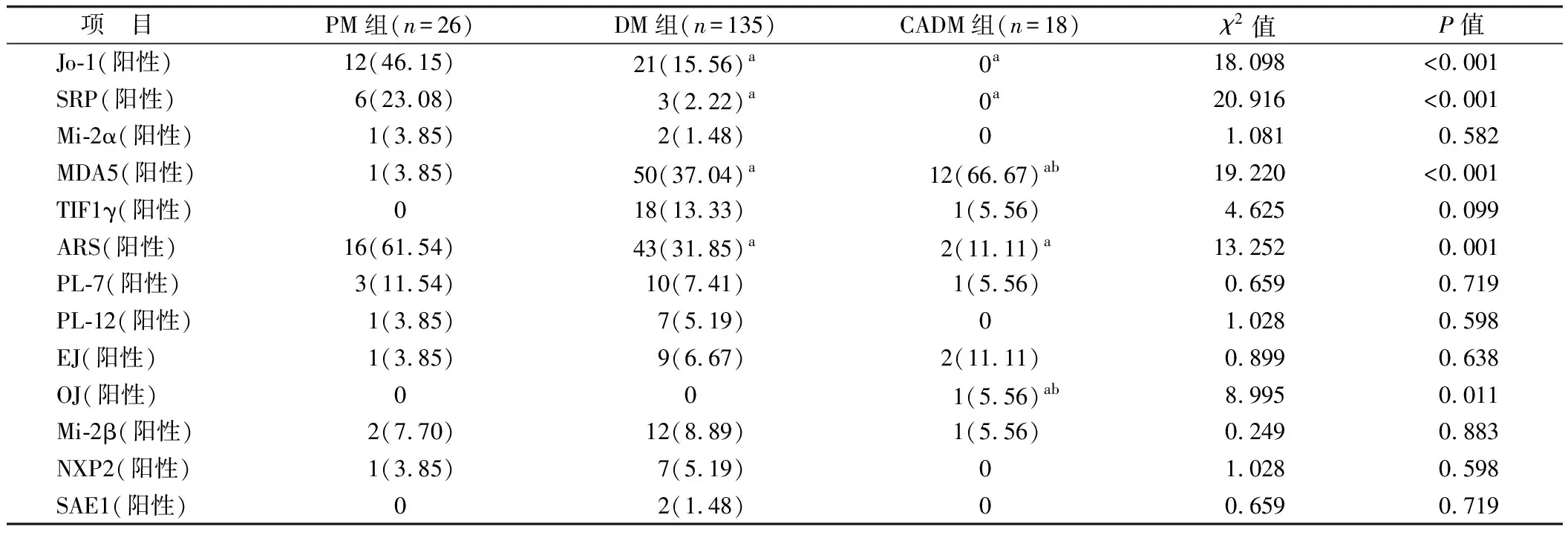
表2 不同亚型IIMs患者MSAs表达比较 [例(%)]
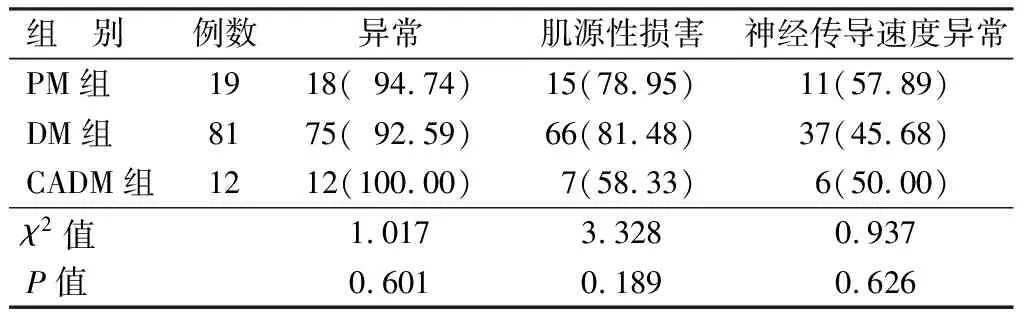
表3 不同亚型IIMs患者肌电图结果比较 [例(%)]
MSAs一直是IIM领域研究的重点,研究表明,同一患者血液中检测到多种MSAs是非常罕见的,即每例IIM患者体内仅能存在1种MSA,从而可准确定义与每个MSA相关的临床表型[9-10]。本研究显示,MSAs中抗MDA5抗体 (35.2%)和抗ARS抗体(34.1%)是较常见的抗体,而抗Jo-1抗体在抗ARS抗体中的阳性率最高(54.1%),与既往国内外文献分布存在一定区别[11-12]。目前世界上大多数研究都一致认为,抗Jo-1是IIM中最常见的抗合成酶抗体,患病率在15%~30%,而本研究中抗Jo-1抗体在IIM中所占比例为17.3%,与既往研究一致[13-14]。
MDA5(前称CADM140)是一种RNA特异性解旋酶,参与抗病毒免疫反应(包括Ⅰ型IFN的产生)[15-16]。抗MDA5抗体常出现在CADM中,其特征表现为皮肤溃疡、手掌丘疹、脱发、关节炎和快速进展的危及生命的ILD[5]。本研究中CADM患者抗MDA5抗体阳性率高于DM和PM患者,验证了这一说法,与既往文献一致[5,17-18]。有研究表明,合并抗MDA5抗体的ILD 6个月内病死率约为59%[8,17]。
抗合成酶抗体综合征通常表现为典型的三联征:ILD、肌炎和关节炎,皮肤极少受累[19],本研究中PM患者的抗Jo-1抗体阳性率高于DM患者,即较少出现皮肤改变。现有的研究认为[4,20],具有抗SRP抗体的肌炎患者主要表现为严重的肌无力、抬颈受限、呼吸困难和肌肉萎缩,通常表现为快速进展的病程,伴体质差和残疾,并与严重的心脏受累有关。本研究中PM组的抗SRP抗体阳性率明显高于DM、CADM组,符合PM患者肌肉受累的特点。
肌电图在IIMs的诊断中起着重要的作用,临床上大部分DM/PM患者都会出现肌肉损害,且以肌源性损害多见,部分可合并神经源性传导速度异常[21]。DM和PM等在肌电图上出现的肌源性损害分别表现为MUP平均时限缩短、波幅下降、自发电位增多、收缩波型异常和峰值波幅降低等[22-23]。本研究中大部分患者均出现了肌源性损害。其中,50%的CADM出现了肌源性损害,说明CADM及PM这2种肌炎亚型中,虽然患者可能并没有肌痛、肌无力等肌肉受累的临床证据,但在电生理学的评估中存在肌肉受累的亚临床证据[4]。肌炎患者一般不会直接导致神经传导速度的异常,本研究中有48.2%的患者检出了神经源性损害,可能与患者四肢肌肉受损后出现了肌纤维的变性和坏死,从而导致受损的肌肉局部发生了失神经支配及神经再生等现象,属于继发,而非直接导致的神经源性损害[24]。
本研究主要是从不同IIMs患者的临床特征、肌炎抗体谱、肌电图3个方面对PM、DM、CADM 3种亚型进一步研究分析,验证了IIMs患者除共同存在的肌痛及肌无力表现外,还存在其他的肌外表现,如皮肤病变、ILD。尤其是在DM及CADM患者中,相较于肌肉病变,皮肤病变更为多见。MSAs在3种亚型中分布不同,证实了早期MSAs的检测在一定程度上可辅助诊断、进行不同IIMs亚型的分析、治疗及推测预后。不同肌炎患者的肌电图均存在肌源性损害,即使临床表现上无明显肌肉症状的CADM患者,说明肌电图在IIMs的临床诊断应用中起着重要的作用。在后续研究中,准备纳入更多的具有完整临床资料的病例进行分析,以期为临床IIMs的研究提供更为严谨的结论。
利益冲突:所有作者声明无利益冲突
作者贡献声明
李筱筱:临床资料及文献收集、整理,统计分析,论文撰写;李雨薇、孙莉:临床资料收集,统计分析;马艳:研究方案可行性分析,原始资料核查,论文审核
