以蛋白尿为首发表现的系统性轻链型淀粉样变性1例并文献复习
2023-05-22杨翔滟田茂露袁静何平红王麟辉查艳
杨翔滟,田茂露,袁静,何平红,王麟辉,查艳
患者,男,56岁,因“发现泡沫尿7个月余,双下肢水肿15 d”于2021年5月24日入院。患者7个月前无明显诱因发现泡沫尿,无其他不适,当时未予重视及诊治。5个月前患者因泡沫尿未见消退,为进一步诊治就诊于我院,查SCr 100 μmol/L,考虑“高血压肾损害”,予海昆肾喜胶囊、百令胶囊护肾,苯磺酸氨氯地平片、厄贝沙坦片控制血压。15 d前患者无明显诱因出现双下肢水肿,无明显加重或缓解因素,未到医院诊治;5 d 前患者因双下肢水肿较前加重而收入院。既往高血压病史14年,最高血压180/110 mmHg,目前规律口服苯磺酸氨氯地平、厄贝沙坦片,血压控制可。无吸烟史、嗜酒史。入院查体:血压128/78 mmHg,神志清楚,营养中等。全身浅表淋巴结未扪及,颜面及眼睑无浮肿。双肺呼吸音清,未闻及干湿性啰音,心律齐,各瓣膜区未闻及明显杂音。腹平软,无压痛、反跳痛及肌紧张,肝脾未扪及肿大,双肾区无叩痛。双下肢中度对称凹陷性水肿。
实验室检查:SCr 132 μmol/L,eGFR 52 ml·min-1·1.73 m-2,Alb 29.9 g/L;尿蛋白(+++),24 h尿蛋白 5.26 g/d;免疫球蛋白IgG 2.91 g/L,IgA 2.80 g/L,IgM 1.41 g/L;血游离轻链κ 24.9 mg/L,血游离轻链λ 95.5 mg/L,游离轻链κ/λ 0.261;尿游离轻链κ 430 mg/L,尿游离轻链λ 172 mg/L,游离轻链κ/λ 2.5;血轻链κ定量3.04 g/L,血轻链λ定量1.96 g/L,血轻链κ/λ 1.551;尿轻链κ定量0.65 g/L,尿轻链λ定量0.40 g/L,尿轻链κ/λ 1.606;尿KAP 473.48 mg/L,尿LAM 379.83 mg/L;免疫固定电泳:疑似单克隆成分为λ游离轻链;流式细胞学:单克隆浆细胞占有核细胞2.54%;血常规、肌钙蛋白、B-型脑钠肽、抗核抗体谱、补体C3及C4均无异常。心电图:窦性心律。心脏彩色超声:室间隔增厚,左室舒张及收缩功能正常。骨髓细胞学检查:浆细胞轻度增高(幼稚浆细胞2%)。骨髓活检:(1)骨髓增生大致正常,粒红巨三系造血细胞增生;(2)少量单克隆浆细胞。肾穿刺病理检查:系膜细胞及基质轻微增生,局灶节段性无细胞结构的特殊蛋白沉积,肾小管上皮空泡及颗粒变性,灶状萎缩,间质纤维组织增生,灶状淋巴细胞浸润,小动脉管壁增厚伴特殊蛋白沉积;免疫荧光:IgA(++)、IgG(+)、IgM(++)、C3(+);特殊染色:刚果红(+);免疫组化标记结果:Kappa(-),Lambda(+),见图1。肾脏组织电镜检查:肾小球系膜基质节段性轻度增生,其内可见纤维样物质沉积,排列紊乱,上皮足突融合,未见电子致密物,见图2。
诊断:系统性轻链型淀粉样变性;淀粉样变性肾病,慢性肾脏病 CKD3期;原发性高血压3级,很高危组。入院后予控制血压、减少尿蛋白、利尿减轻组织水肿,抗氧化、促进肾小管上皮细胞修复等治疗后转入血液内科。给予患者硼替佐米联合地塞米松方案治疗2个疗程,双下肢仍浮肿,考虑疗效欠佳,故第3个疗程调整方案为达雷妥尤单抗联合硼替佐米+环磷酰胺+地塞米松,经治疗后双下肢水肿明显改善。后期患者有自体造血干细胞移植适应证,排除移植禁忌后,予自体造血干细胞移植治疗。患者目前仍在定期随访中。
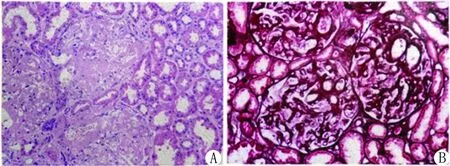
注:A.HE染色(×200);B.PASM染色(×200)
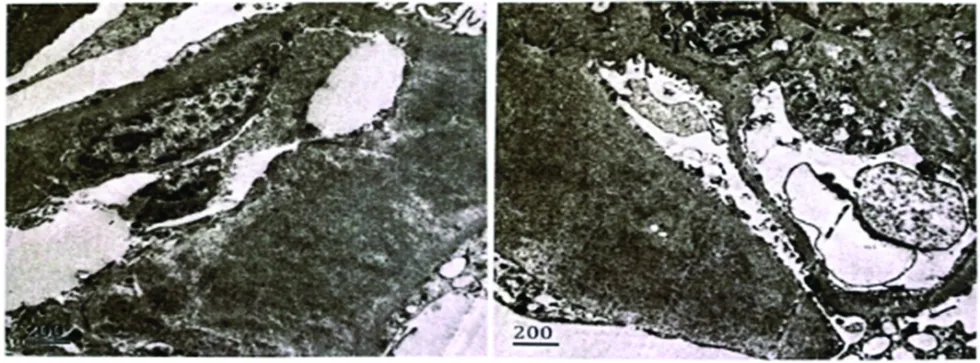
图2 患者肾脏组织电镜检查(×5 000)
讨 论系统性轻链型淀粉样变性(systemic light chain amyloidosis)简称AL型淀粉样变性,它是一种由单克隆免疫球蛋白轻链错误折叠形成淀粉样蛋白,并沉积于组织器官,造成正常组织结构破坏,从而引起器官功能障碍并进行性恶化的疾病[1]。AL型淀粉样变性是一种罕见疾病,据统计,该病的年发病率为(0.8~1.2)/100万[2]。
该病早期诊断困难,需要依据患者病史、临床表现、辅助检查等综合分析才能确诊,其临床表现多样,由于累及组织或器官,引起的临床表现也不一样,包括外周性水肿、泡沫尿、胸闷气促、周围神经病、自主神经功能紊乱等。除临床表现外,诊断该病还必须包括以下2个条件:(1)组织活检病理证实有淀粉样蛋白沉积,且淀粉样蛋白的前体蛋白为免疫球蛋白轻链/重轻链;(2)血液或尿液中存在单克隆免疫球蛋白或游离轻链的证据,或骨髓检查发现有单克隆浆细胞/B细胞[3]。本病例有肾脏器官系统受累表现,结合免疫固定电泳提示疑似单克隆成分为λ游离轻链、肾脏组织病理刚果红染色阳性、电镜提示淀粉样变性肾病及骨髓活检提示少量单克隆浆细胞等相关辅助检查,符合AL型淀粉样变性。
AL型淀粉样变性的治疗目标是尽快降低体内单克隆免疫球蛋白轻链的水平,减少淀粉样蛋白的沉积,阻止受累器官的进行性发展。目前治疗首选自体造血干细胞移植,其余治疗手段包括抗浆细胞治疗、抗淀粉样纤维丝治疗、支持治疗[4]。抗浆细胞治疗是以蛋白酶体抑制剂硼替佐米为基础的联合治疗,其治疗方案主要包括:硼替佐米+环磷酰胺+地塞米松(CyBorD)[5]、硼替佐米+地塞米松(BD)[6]、硼替佐米+美法仑+地塞米松(BMD)[7]、硼替佐米+来那度胺+地塞米松(BRD)[8]及CyBorD 联合达雷妥尤单抗[9-10]。对于复发难治的AL型淀粉样变性患者,则可考虑在CyBorD方案的基础上加用多西环素联合治疗。AL型淀粉样变性多系统受累,预后往往欠佳,其中合并心脏受累、肝脏受累、低血压及肾功能不全者预后更差,而支持治疗可明显改善患者的预后,具体包括减轻疼痛、利尿、透析、血浆置换等对症治疗,定期检测容量状态、电解质、血压等指标,及时对症处理[3]。本例患者明确诊断为AL型淀粉样变性,入院后评估并不符合造血干细胞移植条件,后予以硼替佐米的联合治疗方案多次化疗后状态改善,具备自体移植适应证后,予以自体造血干细胞移植。随访至今,患者一般情况可,生存状态良好。
综上所述,AL 型淀粉样变性患者起病隐匿,临床表现多样,常见肾脏、心脏、胃肠等器官受累,当合并全身器官系统功能损害时,应注意排除。本病例蛋白尿合并高血压而长期误诊为高血压肾损害,提示临床医生应重视病史采集及体格检查,拓展临床思维,提高对AL 型淀粉样变性的认知,快速对该疾病开展诊疗活动,减少对该病的误诊率。此外,自体造血干细胞移植作为治疗AL型淀粉样变性的首选治疗方案,其安全性及有效性高,对于初诊不符合自体造血干细胞移植的患者,可采用抗浆细胞治疗,并根据后续疗效评估是否具备移植指征。
