前庭神经鞘膜瘤外泌体对小鼠耳蜗基底膜的影响研究
2023-05-22王朝晖骆华鸿火子榕吴皓张治华
王朝晖 骆华鸿 火子榕 吴皓 张治华
上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科(上海 200029)
上海交通大学医学院耳科学研究所(上海 200029)
上海市耳鼻疾病转化医学重点实验室(上海 200029)
前庭神经鞘膜瘤(Vestibular Schwannoma,VS),是主要起源于前庭神经鞘膜雪旺细胞的良性肿瘤,占桥小脑角肿瘤的80%~90%[1]。瘤体在生长过程中对临近重要结构产生压迫、包绕、浸润,产生相应脑神经及中枢症状,如听力下降、耳鸣、眩晕、面瘫等。感音神经性听力下降(Sensorineural Hearing Loss,SNHL)为VS 最主要症状,发生率高达95%[2],严重影响患者社交生活和生存质量[2],且对侧耳聋风险也将明显增加[3](可能是VS分泌物通过脑脊液或血液渗透到达对侧耳所致)。目前普遍采用随访观察、手术和立体定向放疗作为VS 经典处理策略[4]。Friedman AH 等人研究发现[5],只有不到15.7%的VS患者可尝试听力保留术式,听力保留率为53.7%,听力提高率更是微乎其微(16.7%)。因此,研究VS 致聋机制,寻找可能的药物治疗靶点,对VS防聋治聋具有重大意义。
研究证明,VS 患侧耳蜗结构明显退化[6],这意味着除了肿瘤机械性压迫蜗神经外,耳蜗功能障碍也可能是VS 引起听力下降的重要原因之一。而VS 肿瘤分泌物可通过内听道抵达耳蜗[7],诱发蜗神经退行性变[8]和蜗性病变从而导致听力下降[9]。基于此,对VS 肿瘤分泌物的研究聚焦于其耳毒性或神经毒性成分[10]。外泌体(exosome)作为一种递送细胞遗传物质的分泌物,是细胞内多囊泡体与细胞膜融合后,释放到胞外基质的膜性囊泡,直径约40-160nm,分布和来源广泛,可由多种细胞所分泌[11]。其磷脂双分子层结构和接近于病毒直径大小的特性,是外泌体能够顺利透过血-迷路屏障从而到达耳蜗内部的保障[12]。外泌体内容物丰富,携带有蛋白、DNA、miRNA 等遗传物质,参与免疫应答、抗原递呈、胞间通讯等多种生理过程,发挥递送细胞遗传物质和信息交流的重要作用[13]。基于VS患者颞骨组织病理结果,本研究聚焦于VS 外泌体对小鼠耳蜗基底膜的损伤,重点关注毛细胞形态及数量的变化。
1 材料与方法
1.1 病例收集
为尽可能减少肿瘤大小对听力的影响,我们收集Ⅱ、Ⅲ期中小型VS 作为研究对象。VS 肿瘤组织样本均取自2020年9月至2021年6月于我院接受手术治疗的患者,记录患者的一般信息。根据AAO-HNS 听力分级系统[15]对患者分组,将听力分级为A、B 级(纯音听阈≤50dB 且言语识别率≥50%)的患者分为听力好组(Good hearing,GH),将听力分级为C、D 级(纯音听阈大于50dB 且言语识别率≥50%或言语识别率<50%)的患者作为听力差组(Poor hearing,PH)。
VS 肿瘤组织离体后立即置于干冰上转移至-80℃超低温冰箱保存;另取部分组织置于装有DMEM培养基的离心管中,用于原代细胞培养。样本采集得到医院人类受试者保护委员会的批准,所有捐赠样本的患者均签署《生物样本捐赠知情同意书》。
将收集到的两组肿瘤组织酶解得到VS原代细胞,用含有10%去外泌体胎牛血清的DMEM 培养液于37℃、5% CO2的细胞培养箱中培养。当细胞融合度达到70%~80%时,收集细胞上清用于提取外泌体。
1.2 提取和鉴定外泌体
采用超速离心法提取外泌体。将两组VS原代细胞上清液以3000g 离心10 mins,弃沉淀,保留上清液;以4:1 的比例加入Exosomoe Concentration Solution(ECS 试剂),涡旋振荡器混匀1min,于4℃静置2h;混合液于4℃以10000g 离心60 mins,弃上清,沉淀中富含外泌体颗粒;用PBS重悬沉淀,得到外泌体,-80℃保存。用透射电镜检测外泌体的形态;纳米流式检测外泌体的粒径大小及分布;Western blot检测外泌体marker蛋白的表达。
1.3 新生鼠基底膜体外培养
选择2~3天C57BL/6J小鼠,购自上海吉辉实验动物饲养有限公司。75%乙醇浸泡消毒,眼科剪断头后将耳蜗与颞骨分离,放入预冷的PBS中,去除耳蜗壳、血管纹、螺旋韧带、蜗轴等结构,得到完整的基底膜。将基底膜放入35mm 培养皿中,加入含有1%N2 和2%B27 的DMEM/F12 培养基,置于37°C和5% CO2中培养,隔日更换培养基。耳蜗基底膜离体培养12h 后,添加不同浓度PH 组外泌体(PHexo)和GH 组外泌体(GH-exo),未处理组为对照组;继续孵育48h后终止培养。
1.4 免疫荧光染色
终止培养后,PBS 洗3 次,加入4%多聚甲醛固定30 mins;blocker 液(5% BSA+0.3% Triton X-100)封闭30 mins 后,加入一抗Myosin7A(1:300),4°C 孵育过夜;PBS 清洗3 次,加入Alexa Fluor 标记的羊抗兔二抗488(1:400),避光孵育1h;PBS 洗3 次后,加入含dapi 的抗荧光淬灭剂封片。leica 共聚焦显微镜观察,统计每100μm 内毛细胞数量以评估外泌体的耳毒性作用。
1.5 统计学分析
2 实验结果
2.1 外泌体的观测与鉴定
外泌体提取流程如图1A所示。VS患者信息如表1所示。电镜图片显示外泌体呈典型的茶托状(图1B)。纳米流式结果显示(图1C),外泌体直径分布在40~220nm,PH组外泌体平均直径为58.20±9.85nm,GH 组外泌体平均直径为58.99±10.24nm。Western blot 检测结果如图1D 所示,成功检测外泌体标志蛋白CD63和TSG101。透射电镜、纳米流式、Western Blot结果证实VS外泌体提取成功。
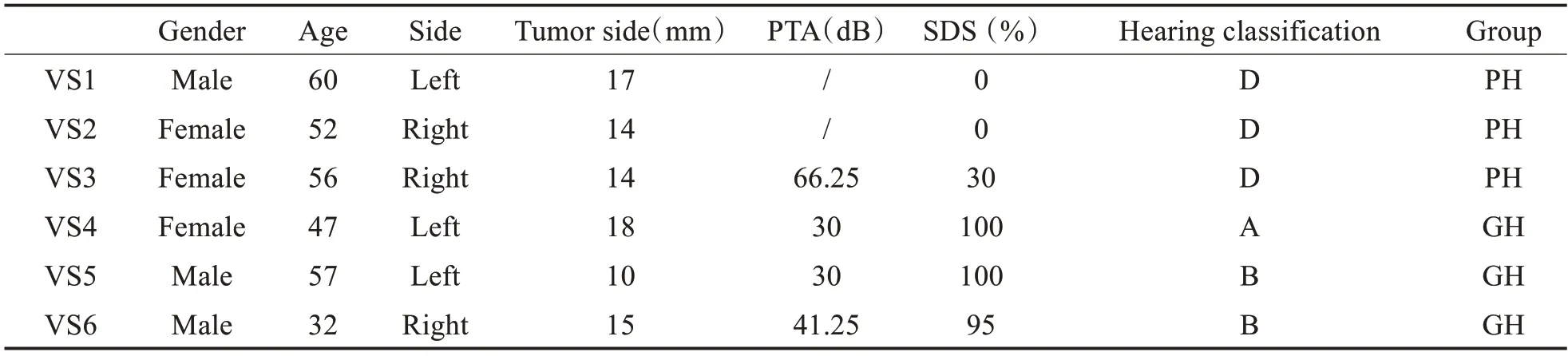
表1 患者信息表Table 1 Patient characteristics
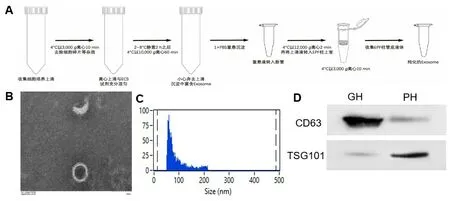
图1 VS 外泌体的提取与鉴定。A:超速离心法提取并纯化外泌体;B:电镜下VS 外泌体;C:纳米流式分析外泌体的粒径大小;D:Western blot 检测外泌体标志蛋白CD63,TSG101。Fig.1 Extraction and identification of VS exosomes.A: Extraction and purification of exosomes by ultracentrifugation.B: Image of exosome electron microscopy.C: Nanoflow analysis of the particle size of exosomes.D: Protein marker CD63,TSG101 were measured by Western blot.
2.2 VS外泌体对耳蜗基底膜的毒性作用
不同浓度外泌体培养48h 后,发现PH-exo 可诱导基底膜毛细胞损伤。如图2所示,对照组毛细胞排列正常,内毛细胞计数结果为14.0±0.32/100μm、13.2±0.37/100μm、13.6±0.40/100μm(对应顶、中、底圈);当浓度为1μg/μl 时,PH 组毛细胞严重丢失,排列紊乱,形态异常,内毛细胞计数结果为5.4±0.51/100μm、5.0±0.32/100μm、4.8±0.37/100μm,与对照组相比具有统计学差异(顶圈:t=14.33,P<0.001;中圈:t=16.74,P<0.001;底圈t=16.07,P<0.001),提示1μg/μl PH-exo 对毛细胞具有明显的耳毒性作用;而GH 组毛细胞排列正常且形态完好,内毛细胞计数结果为13.2±0.37/100μm、12.6±0.40/100μm、13.4±0.40/100μm,与对照组相比无统计学差异(顶圈:t=1.63,P=0.141;中圈:t=1.10,P=0.305;底圈t=0.354,P=0.733)。当浓度为0.5μg/μl时,PH组毛细胞出现极少数量的丢失,形态轻度异常,内毛细胞计数结果为12.8±0.49/100μm、12.2±0.37/100μm、13.0±0.45/100μm,与对照组相比内毛细胞仅在中圈统计学存在统计学差异(顶圈:t=2.06,P=0.074;中圈:t=2.65,P=0.029;底圈t=1.00,P=0.347)。
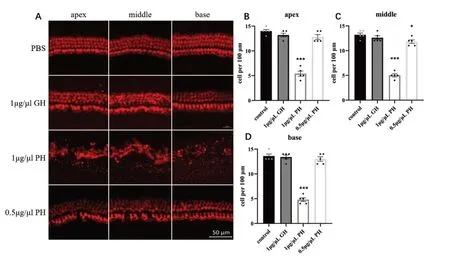
图2 外泌体对基底膜的毒性作用。A:4 组MyosinⅦA 标记的毛细胞的代表性图片;对照组毛细胞形态正常且无细胞丢失;当外泌体浓度为1μg/μl 时,PH 组基底膜严重损伤,GH 组基底膜影响甚微;当外泌体浓度为0.5μg/μl 时,PH 组基底膜轻度损伤,内毛细胞极少数丢失(Scale bar=50nm);B C D:内毛细胞计数,每100μm 的内毛细胞的个数变化以反映外泌体对基底膜的损伤(n=5,Mean ± SEM,*P <0.05,***P <0.001)。Fig.2 Ototoxic effects of exosomes on the basement membrane.A: Representative pictures of four groups of Myosin VIIA-labeled basement membrane hair cells.The morphology of hair cells in the control group was normal and there was no cell loss; When the exosome concentration was 1 μg/μl,the basement membrane in the PH group was severely damaged,and the basement membrane in the GH group was not greatly affected; when the exosome concentration was 0.5 μg/μl,the basement membrane in the PH group was mildly damaged and a few inner hair cells were lost.B C D: Number of cells was quantified for inner hair cell per 100 µm.(n=5,Mean ±SEM,***P <0.001).Scale bar:50µm(A).
3 讨论
VS 患者听力下降的病因分为医源性和肿瘤性。医源性听力下降与手术径路、手术技巧、蜗神经血供保存、放疗等因素直接相关[15]。而肿瘤性听力下降则与肿瘤的生长方式、生长速度、位置、耳蜗病理改变、异常炎症反应、内听道扩大比例等因素密切相关[16-19]。通常情况下,肿瘤对蜗神经、脑干耳蜗核的机械压迫是VS 致聋重要的因素之一,较大的肿瘤可能会导致更严重的压迫,影响血液供应,随之引起的缺血性变化导致感觉神经性听力障碍。Gerganov V 等人分析了99 例VS 患者的影像和术前听力水平,发现听力水平与肿瘤分期显着相关[16];Bathla等人研究发现在小型VS中,肿瘤体积与纯音听阈、言语识别率相关[20]。然而,更多研究表明听力下降与肿瘤大小/体积无关[21-25]。
耳蜗功能障碍是VS患者听力下降的另一个重要因素。在外周听觉系统中,耳蜗是传导、感受声波的重要结构,耳蜗结构异常直接影响听力。Mahmud 等人对11 名VS 患者尸检分析,结果显示听力下降严重患者的肿瘤侧耳蜗毛细胞减少、血管纹和螺旋韧带变性[9];Merchant 等人证实了这一病理结果[6]。受限于尸检样本,VS 患者耳蜗结构退化与听力下降之间的相关性分析难以开展研究。畸变产物耳声发射(Distortion Product Otoacoustic Emission,DPOAE)可用于评估耳蜗外毛细胞功能,Antonio P 等人发现在多个频率段VS患者肿瘤侧耳的DPOAE 反应幅度均出现降低[26],证明了VS 患者耳蜗功能受损。除了耳蜗异常,一些研究观察到VS 患者耳蜗外淋巴液中的蛋白质水平升高,在T2加权MRI扫描中表现为低信号[27,28]。
炎症途径的异常上调是VS 重要的发病机制,在大多数VS 中可观察到免疫浸润[29]。COX-2、阿司匹林等非甾体抗炎药都与VS 肿瘤增殖、凋亡息息相关[30,31]。但炎症与听力下降之间的关系却很少被研究。在耳蜗基底膜培养的体外模型中,肿瘤分泌物引起的耳蜗基底膜损伤程度与VS患者听力相关,对肿瘤分泌物进一步分析确定TNFα 是耳毒性分子[7]。Moon I 等人研究发现,VS 中炎症相关基因高表达,听力差患者的NLRP3 和IL-1ß 表达水平高于听力好患者[18]。除炎症因子外,生长因子和其他肿瘤分泌物也被证实与VS患者听力下降相关。在2型神经纤维瘤病(主要表现为双侧VS)中,升高的VEGF 会导致肿瘤生长和听力下降,抗VEGF 治疗可以通过使肿瘤血管正常化、改善血管灌注以改善听力[32,33]。近期,Stankovic KM 等人发现,血浆和肿瘤分泌物中MMP-14 的表达水平与患者听力下降程度相关,MMP-14 可诱导螺旋神经节神经元纤维和突触的损伤[34]。
本课题组推测在中小型VS 患者中,肿瘤对蜗神经及血管、脑干压迫较小,此时耳蜗损伤是VS导致听力下降的主要因素。肿瘤分泌物可经内听道抵达耳蜗[7],作为肿瘤与耳蜗之间的媒介影响耳蜗结构与功能。外泌体作为旁分泌的一种重要形式,将蛋白质、DNA、RNA、脂质等包裹在富含胆固醇的磷脂囊泡中以保证所包裹的物质不会被酶解,有利于进行细胞间的物质交换与信息传递。且外泌体已被证实能够穿透血脑屏障[35],这对治疗中枢神经系统疾病具有重要意义。因此,外泌体具有穿过内耳血-迷路屏障的可能;同时,在解剖上外泌体由VS 分泌后进入毗邻的迷路动脉,最终通过耳蜗后动脉进入耳蜗;以上两点为研究VS 外泌体经血液途径抵达耳蜗提供了理论基础。因此相较于其他肿瘤分泌物,外泌体进入耳蜗的可行性更加充分。在本研究中,我们研究了不同听力分级的中小型VS外泌体对耳蜗基底膜的影响。结果显示,听力差(PH)组外泌体对耳蜗基底膜毛细胞产生毒性作用,而听力好(GH)组对耳蜗基底膜无明显毒性作用。两种外泌体的差异内容物是造成耳毒性差异现象的关键因素,进一步研究须针对外泌体进行microRNA 测序或蛋白组学分析,深入了解VS 外泌体导致听力下降的分子途径。此外,新生鼠耳蜗基底膜体外模型具有局限性,仅能进行短期评估,且在体外实验与体内实验中可能产生不同的结果,需进一步构建动物模型研究VS外泌体对听力的影响。
4 结论
VS 外泌体具有不同程度的耳毒性,导致小鼠耳蜗基底膜毛细胞丢失且对毛细胞的损伤具有浓度依赖性。
