外源激素浸种与渗透处理对水曲柳种子热休眠的作用
2023-05-21矫春晶李明月
矫春晶 李明月 张 鹏
(东北林业大学林学院,森林生态系统可持续经营教育部重点实验室,哈尔滨 150040)
种子休眠受遗传背景、内源激素或环境条件等多方面的调控[1]。与在成熟过程中形成的初生休眠相比,原来不休眠或解除休眠后的种子由于不适宜的环境条件诱发的次生休眠易被忽视[2]。在全球气候变化的背景下,次生休眠现象在自然界中越发普遍,其中以高温条件导致的次生休眠(热休眠)最为典型[3],如大麦(Hordeum vulgare)、莴苣(Lactuca sativa)和芹菜(Apium graveolens)等经济作物种子在过高温度(30 ℃)条件下会发生热休眠[4-5],由此产生对农林生产的不利影响也越发突出,逐渐引起人们的重视。关于种子热休眠的研究,目前多集中在具有浅休眠的植物种子,如拟南芥(Arabidopsis thaliana)、油菜(Brassica campestris)、萹蓄(Polygonum aviculare)等[6-8],对深休眠的种子研究有限,已知在水曲柳(Fraxinus mandshurica)、红松(Pinus koraiensis)等林木种子上有初步探索[9-10]。有研究表明初生休眠程度高的种子更易诱导发生次生休眠[2],因此如何预防或减弱深休眠属性的种子次生休眠现象对实际生产有重要意义。
目前针对种子热休眠的预防或解除条件的研究已有关注,主要是针对单一处理方式,如激素浸种、引发技术或渗透调节等[10-12]。赤霉素(GA3)、乙烯利(ETH)或激动素(KT)等浸种处理对热休眠都有明显减弱作用,但不同激素对同一物种发挥的促进效果也存在差异,且各激素间的作用不是完全独立的,如KT 和GA3浸种对解除莴苣种子的热休眠都有作用,但KT 处理的效果更显著[13]。研究发现应用-1.25 MPa 聚乙二醇(PEG)8000 与杀菌剂混合渗透引发对减弱种子热休眠的效果明显好于单独PEG 引发[14]。若将渗透处理与外源激素浸种联用能否提高激素对种子热休眠的作用效果尚鲜见研究报道。
水曲柳种子在高温(≥25 ℃)下持续培养3 d以上会诱导热休眠[10]。研究发现赤霉素(GA4+7)和ETH 浸种能够减弱水曲柳种子热休眠[12];质量分数50% PEG 6000 溶液渗透处理7 d 能够抑制热休眠,伴随着赤霉素和乙烯利等内源激素水平升高,脱落酸含量降低等生理变化[11]。但将上述两种处理同时用于水曲柳种子是否对抑制热休眠发挥作用尚不清楚。由此,提出假设:外源激素浸种与PEG 渗透处理联用对水曲柳种子热休眠起到抑制作用,且抑制效果比单独激素处理更显著。为验证这一假设,将解除初生休眠的水曲柳种子用赤霉素(GA4+7)、细胞分裂素(6-BA)和ETH 溶液浸泡24 h 后,在诱导热休眠的温度(25 ℃)下用不同浓度PEG 溶液处理7 d,比较处理后种子在适温(10 ℃)下的萌发能力、内源激素含量和酶活力的变化情况,探究二者联用对水曲柳种子热休眠的影响,从而丰富种子次生休眠调控理论,并指导播种育苗生产实践。
1 材料与方法
1.1 试验材料
试验用种子采自吉林省露水河林业局水曲柳成年树。在2017 年3 月开始对种子进行变温裸(无基质)层积处理,时间:18 ℃/12 周+5 ℃/10周[3]。层积结束后将种子干燥至含水率8%~9%,-20 ℃保存,以解除初生休眠的种子为材料。
1.2 研究方法
1.2.1 试验设计
采用双因素试验设计,因素一为外源激素浸种,设置4个水平,分别为GA4+7、6-BA、ETH 和蒸馏水浸种,溶液浓度均为1 mmol·L-1;因素二为PEG 6000 渗透处理,设置4 个水平,渗透液质量分数分别为0、5%、25%、50%,渗透处理温度为25 ℃,时间为7 d。共16种处理。于2017年9月开始试验。
1.2.2 溶液的配制
用蒸馏水配制1 mmol·L-1GA4+7、6-BA、ETH 溶液;PEG 6000 与蒸馏水配制成质量分数0(蒸馏水)、5%、25%和50%溶液备用。
1.2.3 种子处理
取适量种子在黑暗条件蒸馏水浸泡24 h,然后分别用1 mmol·L-1GA4+7、6-BA、ETH 溶液浸种24 h,以蒸馏水浸种24 h 为对照,浸种后用流水冲洗干净。分别置于底部铺有一层干净滤纸的塑料培养皿中,向皿中加入上述不同质量分数PEG 溶液10 mL(对照加蒸馏水10 mL),于25 ℃黑暗条件培养7 d,期间每3 d 更换同浓度溶液,渗透处理结束后种子用蒸馏水冲洗干净,用于发芽试验和相关生理指标的测定。
1.2.4 发芽试验
将上述处理好的种子分别转移至底部铺有一层湿润滤纸(蒸馏水)的塑料培养皿中,每皿25 粒种子,4次重复,放于适宜条件(10 ℃黑暗)下培养,定期向皿中补充蒸馏水以保证发芽环境湿润。以胚根突破种皮超过2 mm 作为发芽标准,定期观察记录发芽情况,萌发周期30 d。试验结束后计算种子发芽率、发芽指数及平均发芽时间,公式如下:
式中:tg表示发芽时间;ng表示与tg对应的发芽种子数量。
1.2.5 生理指标测定
根据单独激素处理与激素+PEG 处理间种子发芽能力的显著差异,确定对水+50% PEG、6-BA、6-BA+50% PEG、ETH、ETH+50% PEG 共5 种处理于2017 年11 月进行生理指标的测定。以种子置于培养皿当日记为0 d,分别于第0、3、7、10、14 d分离种胚、胚乳,各取样2 g 测定胚乳纤维素酶和果胶酶的活力,具体方法参照3,5-二硝基水杨酸(DNS)法[12];另取样1 g,液氮速冻后于-80 ℃保存,通过高效液相色谱法[12]测定各组织中赤霉素(GA3)和脱落酸(ABA)的含量。每个处理取样重复3次。
1.3 数据统计分析
利用Excel 2016 整理数据。使用SPSS 18.0 统计分析数据。采用双因素方差分析不同外源激素浸种与PEG 渗透处理联用对水曲柳种子萌发能力(发芽率、发芽指数和平均发芽时间)、细胞壁降解酶和内源激素含量的影响,当方差分析结果显著时,采用Duncan 法进行多重比较。其中百分数需进行平方根反正弦转换后再用于方差分析。采用Sigmaplot 12.5作图。
2 结果与分析
2.1 外源激素浸种与PEG 渗透处理对水曲柳种子发芽能力的影响
外源激素浸种、PEG 渗透处理及两者的交互作用对水曲柳种子的发芽率、发芽指数和平均发芽时间影响均极显著(P<0.01)(见表1)。
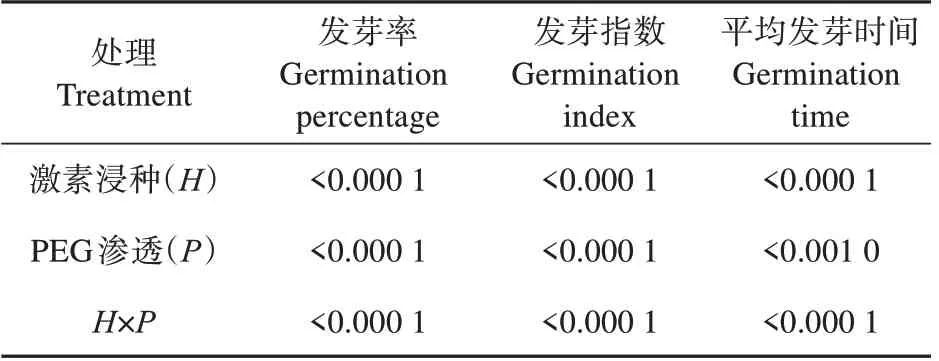
表1 不同外源激素浸种与渗透处理对水曲柳种子发芽能力影响的方差分析结果Table 1 Analysis of variance of different exogenous hormones soaking and osmotic treatment on seeds germination ability of F.mandshurica
在不同质量分数PEG渗透处理下,3种激素处理(ETH+50% PEG 除外)的种子发芽率均高于对照。GA4+7处理的种子发芽率随PEG质量分数的升高变化不明显;6-BA 和ETH 处理的种子发芽率随PEG 质量分数的升高呈上升趋势。与单独激素处理相比,激素和渗透处理联用对种子发芽率的显著促进作用仅在6-BA 和ETH 处理中体现,其中6-BA+25% PEG 处理提高69.31%,ETH+50% PEG处理提高43.42%(见表2)。
在不同质量分数PEG渗透处理下,3种激素处理(ETH+50% PEG 除外)的种子发芽指数均高于对照。GA4+7处理的种子发芽指数随PEG质量分数升高变化不明显;6-BA 和ETH 处理的种子发芽指数随PEG 质量分数的升高逐渐升高。与单独激素处理相比,激素和渗透处理联用对种子发芽指数的促进作用表现在6-BA 和ETH 处理,其中6-BA+25% PEG 处理提高1.04,ETH+50% PEG 处理提高0.76(见表2)。
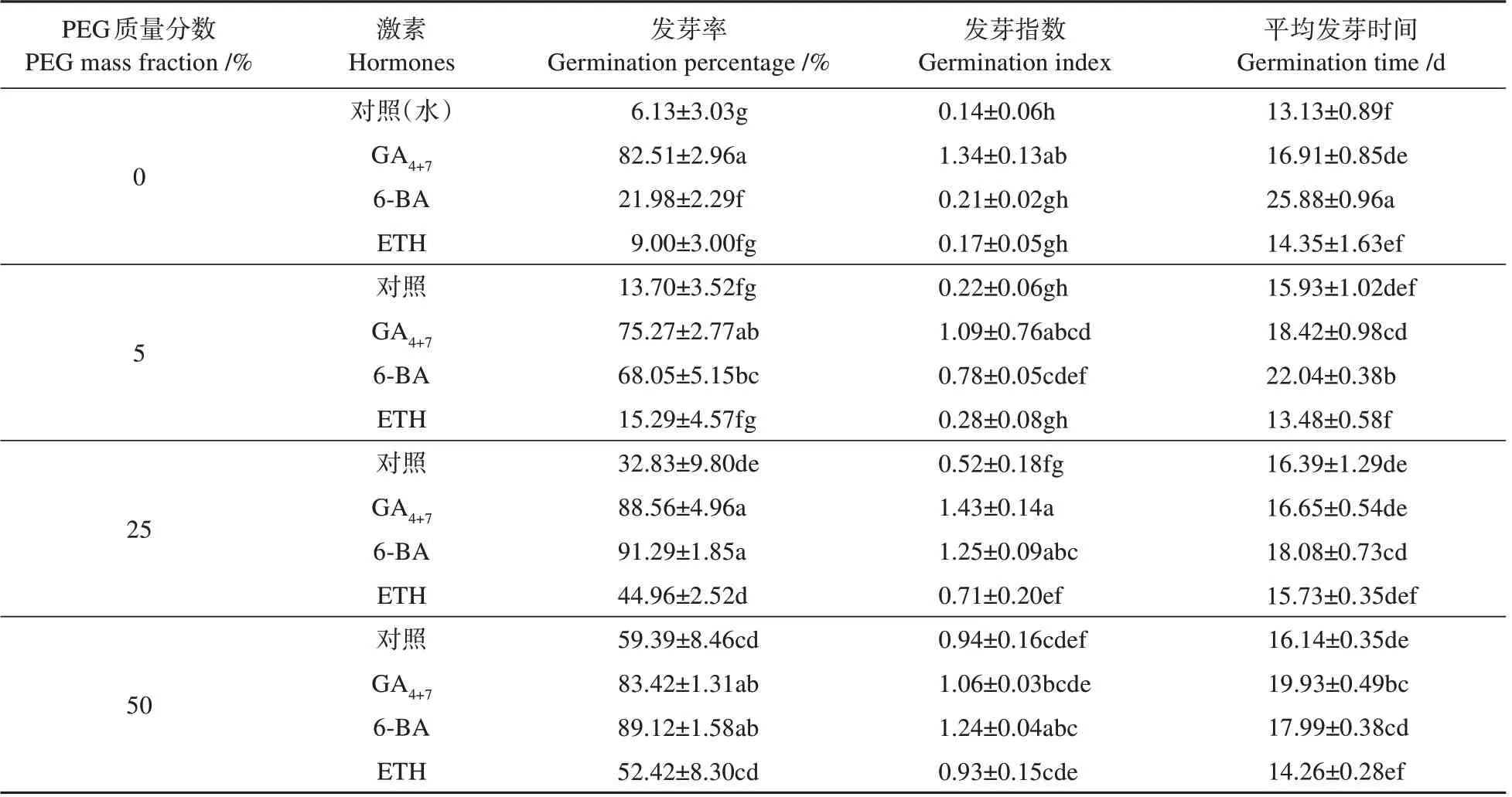
表2 不同外源激素浸种与PEG渗透处理后的水曲柳种子萌发情况Table 2 Germination ability of F.mandshurica seeds treated with different exogenous hormones soaking and PEG osmosis
在不同质量分数PEG 渗透处理下,GA4+7和6-BA 处理的种子发芽时间高于对照,ETH 处理的种子发芽时间略低于对照。GA4+7处理的种子发芽时间随PEG 质量分数的升高略有延长;6-BA 处理的种子发芽时间随PEG 质量分数的升高逐渐缩短,当与50% PEG 处理联用时的种子发芽时间比单独6-BA 处理缩短了7.89 d;ETH 处理的种子发芽时间随PEG质量分数的升高变化不明显(表2)。
2.2 外源激素浸种与PEG 渗透处理对种子细胞壁降解酶活力的影响
ETH、6-BA 分别与50% PEG 联用处理的水曲柳种子在萌发过程中胚乳纤维素酶活力变化相似(图1:A,C)。ETH+50% PEG 和6-BA+50% PEG 处理的种子胚乳纤维素酶活力呈W 型变化,先下降再上升后降低,随后升高。ETH+50% PEG 处理的种子胚乳纤维素酶活力在3、7、14 d 时显著高于ETH处理;6-BA+50% PEG处理的种子胚乳纤维素酶活力仅在7 d时显著高于6-BA处理。
ETH、6-BA 分别与50% PEG 联用处理的水曲柳种子在萌发过程中胚乳果胶酶活力变化相似(图1:B,D)。各处理的种子胚乳果胶酶活力均先上升再下降后逐渐升高。ETH+50% PEG 处理的种子胚乳果胶酶活力仅在3 d时(22.65 U·g-1)显著高于ETH处理;6-BA+50% PEG处理的种子胚乳果胶酶活力仅在10 d时比6-BA处理略高0.23 U·g-1。
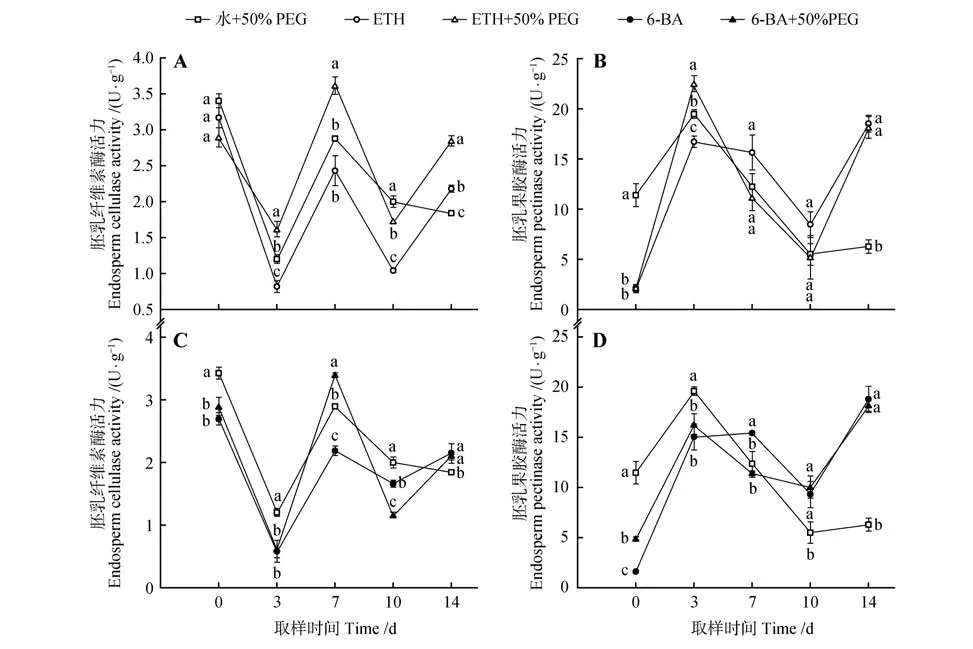
图1 不同外源激素浸种与渗透处理的水曲柳种子萌发过程中细胞壁降解酶活力变化情况A~B.ETH 浸种与渗透处理的水曲柳种子萌发过程中细胞壁降解酶活力变化情况;C~D.6-BA 浸种与渗透处理的水曲柳种子萌发过程中细胞壁降解酶活力变化情况;不同小写字母表示同一时间下不同处理间差异显著(P<0.05);下同Fig.1 Changes in the activities of cell wall degrading enzymes during germination of F.mandshurica seeds treated with different exogenous hormones soaking and osmotic treatmentsDifferent lowercase letters in the figure indicate significant difference between different treatments at the same time(P<0.05);The same as below
2.3 外源激素浸种与PEG 渗透处理对种子内源激素变化的影响
ETH 浸种和50% PEG 处理的水曲柳种子在萌发过程中胚乳和种胚GA 含量变化不同(图2:A,B)。ETH+50% PEG 处理的种子胚乳GA含量先上升再下降后升高,而种胚GA 含量变化正相反;ETH 处理的种子胚乳和种胚GA 含量均先上升后逐渐下降。ETH+50% PEG 处理的种子胚乳GA 含量仅在14 d时显著高于ETH处理,其种胚GA含量仅在10 d时显著高于ETH处理。
ETH 浸种和50% PEG 处理的水曲柳种子在萌发过程中胚乳和种胚ABA 含量变化不同(图2:C,D)。ETH+50% PEG 处理的种子胚乳ABA 含量呈S 型变化,先下降再上升后降低,而种胚ABA 含量呈M 型变化,先上升再下降后升高,随后降低;ETH处理的种子胚乳ABA含量先上升再下降后升高,而种胚ABA 含量先升高后逐渐降低。ETH+50% PEG处理仅种子胚乳ABA含量在3、7、14 d时低于ETH处理。
ETH 浸种和50% PEG 处理的水曲柳种子在萌发过程中胚乳和种胚ω(GA)/ω(ABA)变化不同(图2 E, F)。ETH+50% PEG 处理的种子胚乳ω(GA)/ω(ABA)先上升再下降后升高,而种胚ω(GA)/ω(ABA)变化趋势正相反;ETH 处理的种子胚乳ω(GA)/ω(ABA)呈M 型变化,而种胚ω(GA)/ω(ABA)呈W 型变化。ETH+50% PEG处理的种子胚乳ω(GA)/ω(ABA)仅在14 d时显著高于ETH 处理,其种胚ω(GA)/ω(ABA)在10 d 时显著高于ETH处理。
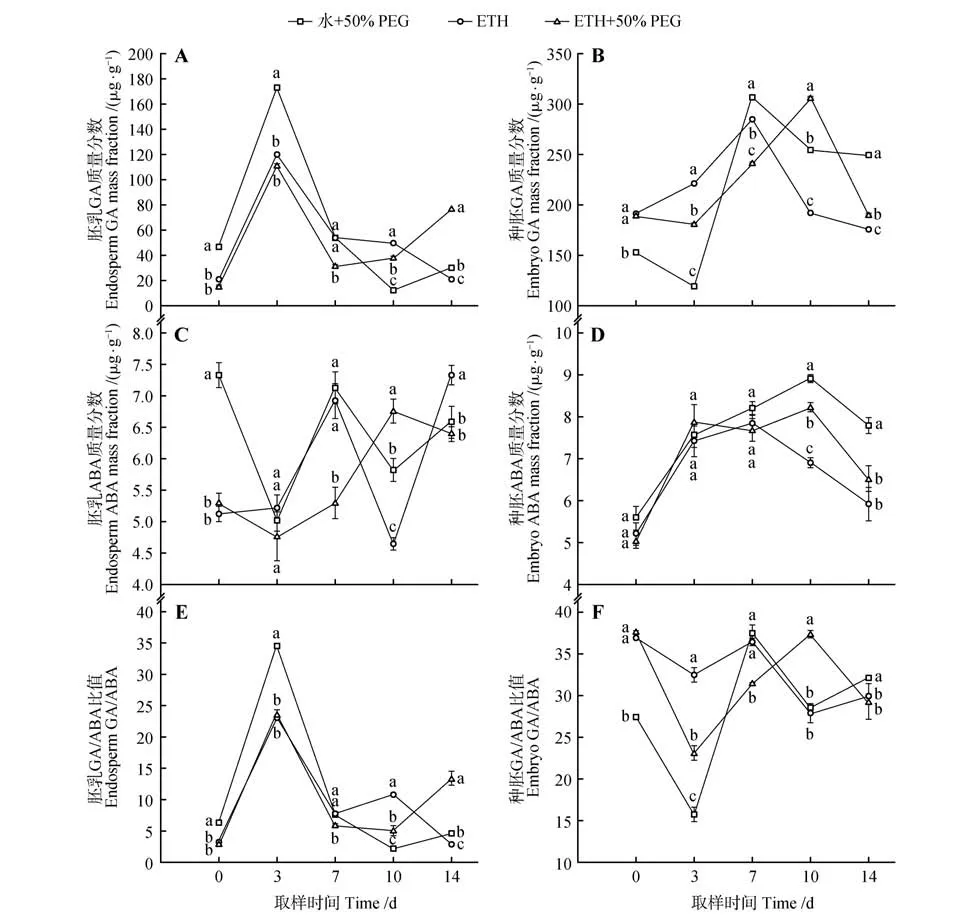
图2 ETH浸种与PEG渗透处理的水曲柳种子在萌发过程中不同部位内源激素变化情况Fig.2 Changes of endogenous hormone in different parts of Fraxinus mandshurica seeds treated with ETH and PEG during germination
6-BA 浸种和50% PEG 处理的水曲柳种子在萌发过程中胚乳和种胚GA 含量变化不同(图3:A,B)。6-BA+50% PEG 处理的种子胚乳GA 含量呈M 型变化,而6-BA 处理的种子胚乳GA 含量先上升后逐渐降低,同时2 种处理的种子种胚GA 含量均呈S 型变化。6-BA+50% PEG 处理的种子种胚GA含量仅在10 d时显著高于6-BA处理。
6-BA 浸种和50% PEG 处理的水曲柳种子在萌发过程中胚乳和种胚ABA 含量变化不同(图3:C,D)。6-BA+50% PEG 处理的种子胚乳和种胚ABA 含量均先升高后下降;6-BA 处理的种子胚乳ABA 含量先上升再下降后升高,而种胚ABA 含量先升高后降低。6-BA+50% PEG 处理的种子胚乳ABA 含量仅在3 d 时显著低于6-BA 处理,其种胚ABA含量在3 d和14 d时显著低于6-BA处理。
6-BA 浸种和50% PEG 处理的水曲柳种子在萌发过程中胚乳和种胚ω(GA)/ω(ABA)变化不同(图3:E,F)。6-BA+50% PEG 处理的种子胚乳ω(GA)/ω(ABA)呈M 型变化;6-BA 处理的种子胚乳ω(GA)/ω(ABA)先上升后逐渐降低,同时2种处理的种子种胚ω(GA)/ω(ABA)均呈S 型变化。6-BA+50% PEG 处理的种子种胚ω(GA)/ω(ABA)仅在3 d时显著高于6-BA处理。

图3 6-BA浸种与PEG渗透处理的水曲柳种子在萌发过程中不同部位内源激素变化情况Fig.3 Changes of endogenous hormone in different parts of Fraxinus mandshurica seeds treated with 6-BA and PEG during germination
3 讨论
目前,外源激素处理成为调控种子休眠的常用方法,GA、IAA或ETH等都能够减弱种子次生休眠[15-16]。PEG 性质稳定无毒无害,对种子具有良好的渗透性[17]。在种子萌发过程中,应用PEG 对一些经济作物种子进行渗透处理,能够有效缩短种子发芽时间[18]。若在PEG 溶液中加入某些生长调节剂,有助于进一步提高种子的萌发性能[19],如不同浓度过氧化氢溶液与PEG 协同处理能显著提高种子活力[20]。本研究发现,不同外源激素与PEG联用对水曲柳种子热休眠的作用表现不同,与单独激素处理相比,除了GA4+7与PEG 联用对种子发芽率无显著影响,且发芽时间略有延长外,6-BA、ETH 浸种均随着PEG 处理浓度的升高而逐渐增强种子的发芽能力。有研究表明赤霉素浸种是目前调控种子休眠最有效的方法之一[21],这与本研究发现GA4+7处理的水曲柳种子发芽能力高于其他激素处理和激素+PEG 联用处理的表现相吻合。赤霉素作为调控种子萌发的关键激素之一,能够直接促进内源赤霉素合成、调节物质代谢及贮藏物质的分解,协同作用调控种子萌发[22-23]。6-BA和ETH 主要通过对ABA 的拮抗作用、间接诱导GA 合成及增强呼吸作用来调节种子萌发[24]。对于许多物种来说,单独应用其中某种激素可能不会完全打破种子休眠[25],特别是像水曲柳种子这种由高温胁迫造成的次生休眠,单独应用6-BA 或ETH 处理的水曲柳种子发芽效果并不理想(21.98%;9.00%),但与不同浓度PEG 处理联用后种子萌发能力大幅提高,特别是6-BA 与25% PEG联用后的种子发芽率提高了69.31%,发芽时间明显缩短。由此能够支持本研究的部分假设:外源激素与渗透处理联用能够减弱水曲柳种子热休眠,但其效果因激素种类而异,GA4+7与渗透处理联用减弱种子热休眠的效果没有比单独使用激素的效果更显著,但6-BA 或ETH 与渗透处理联用不但有减弱种子热休眠的效果,而且比单独使用激素的效果更明显。
外源激素通过调控内源激素变化实现植物不同生长发育阶段的需求[26]。在种子次生休眠过程中,ABA 与GA含量变化呈显著负相关[27]。适宜的渗透处理能够提高酶活力,修复细胞膜损伤对环境胁迫做出响应,提高植物抗逆性[28],近年来对其与种子萌发关系的研究逐渐增多。本研究发现,与单独激素处理相比,6-BA、ETH 与50% PEG 联合处理的水曲柳种子种胚和胚乳ω(GA)、ω(ABA)及ω(GA)/ω(ABA)在萌发过程中均有不同程度的改变,但无明显调控规律。有报道指出除了激素的含量变化,组织对激素的敏感性也是影响休眠的关键因素之一,特别是对ABA 的敏感性[29]。种子萌发不仅受GA 和ABA 两种激素的调控,还由乙烯、细胞分裂素及外界环境诸多因子共同决定的,并且激素间的信号途径不是单独作用的,而是存在交叉调控[24]。与单独激素浸种相比,6-BA、ETH 处理的种子经渗透处理后在萌发过程中胚乳纤维素酶活力均显著提高,而果胶酶活力无显著变化。不同种水解酶与种子萌发过程中胚乳弱化的关系在不同物种上的表现虽然存在差异[18],但主要目的都是为了促进胚乳部位淀粉和蛋白质的水解,弱化种子周围组织对胚根伸长的阻碍作用[30],从而促进种子萌发。由此能够确定:6-BA、ETH 与渗透处理联用能够通过提高种子胚乳纤维素酶活力来减弱水曲柳种子热休眠,促进种子萌发。
综上所述,外源激素与渗透处理联用减弱水曲柳种子热休眠的效果因激素种类而异。GA4+7与渗透处理联用减弱种子热休眠的效果与单独激素处理差异不显著, 6-BA、ETH 浸种与渗透处理联用的效果显著强于单独激素处理,其中6-BA 与25% PEG、ETH 与50% PEG 联用的效果最好,显著提高种子胚乳纤维素酶活力,对种胚和胚乳的GA、ABA含量变化影响无显著规律。
