烟酰胺预防全反式维甲酸诱导小鼠腭裂的初步实验研究
2023-05-20李国威唐世杰
李国威,唐世杰
1.深圳大学总医院整形美容科,广东 深圳(518000);2.汕头大学第二附属医院整形外科暨唇腭裂治疗中心,广东 汕头(515000)
先天性腭裂是最常见的生长发育畸形之一,发病率可高达1.7‰[1]。腭裂的发生既影响患儿的语言、听觉、外观、心理健康,也对患儿成长中的社会融入过程造成不利影响,同时给其家庭增加严重的经济负担[2-4]。目前学界公认先天性腭裂是多环境因素、多基因因素共同作用的结果[5-7]。寻找能够预防先天性唇腭裂疾病发生的方法十分重要。关于烟酰胺(nicotinamide,NAM)能否预防腭裂的实验研究,目前尚无报道。本文在全反式维甲酸(all-trans retinoic acid,RA)诱导小鼠腭裂模型的基础上[8],探索NAM 是否具有预防腭裂的作用,并探索了其与细胞凋亡相关机制的可能性,现报告如下。
1 材料和方法
1.1 主要材料和试剂
全反式维甲酸(RA)(R2625,Sigma,美国),烟酰胺(NAM,N105042,阿拉丁,中国),胎牛血清(10100147,Gibco,美国),磷酸盐缓冲液(phosphate buffer solution,PBS)(P1020,索莱宝,中国),二甲基亚砜(D12345,Sigma,美国),改良Eagle 培养基(12430054,Gibco,美国),0.05%胰蛋白酶(Invitrogen,美国),Annexin V - FITC/PI 试剂盒(KGA108,凯基,中国),体式光学显微镜(SZX10,Olympus,日本),光学显微镜(Ixplore,Olympus,日本),BD Accuri 流式细胞仪(C6,BD,美国)。
1.2 动物实验
7~8 周龄的昆明小鼠(15 只雌、10 只雄)购于汕头大学医学院动物实验中心(动物合格证号:2021A023)。小鼠饲养于汕头大学附属二院转化医学研究中心动物房。房间内相对湿度维持在60%~70%,室温维持在18℃~22℃。每日提供新鲜的饲料和饮用水,垫料每3~5 d 更换1 次。本次实验获得汕头大学第二附属医院伦理委员会(批号:SU-2021-0121 号)批准。
筛选体重≥30 g 的昆明小鼠按照雌雄比2∶1~3∶1 的比例在第1 d 20∶00 合笼,于第2 d 08∶00,检查雌鼠阴道内是否含有阴道栓或精液,如含有阴道栓或精液则记为胚胎发育(embryonic,E)0.5 d(E0.5),称重,重复此过程,于E8.5 再次称重,若体重增长大于等于2 g,则判定小鼠有孕并入组进行实验。
小鼠被随机分为3 组:实验组(1)、实验组(2)与对照组,每组5 只孕鼠;于E10.5 按70 mg/kg 溶于玉米油中的RA 进行灌胃诱导的小鼠为对照组;实验组设置两个烟酰胺(NAM)浓度(20、40 mg/kg),于E8.5~E13.5 按20 mg/kg 溶于PBS 的NAM 尾静脉注射处理的腭裂小鼠模型为实验组(1),于E8.5~E13.5 按40 mg/kg 溶于PBS 的NAM 尾静脉注射处理的腭裂小鼠模型为实验组(2),于E16.5 剖腹取出胚胎鼠,观察胎鼠情况并对腭裂发生率进行统计。
1.3 细胞实验
鼠胚腭突间质(mouse embryonic palatal mesenchyme,MEPM)细胞的原代培养:另外饲养昆明小鼠(6 只雌、3 只雄),并依照同样方法合笼,判定有孕后取E13.5 孕鼠断颈处死,75%乙醇浸泡5 min,沥干至不滴液体后移入超净台,放置于纱布上,在超净台中用无菌眼科剪刀及镊子切开腹部并取出胚胎放置于全新无菌纱布上。超净台中,将显微剪刀、显微镊子用酒精灯外焰灼烧过火。用显微剪刀剪开胎膜,待羊水流出后,取出胚胎,剪下胎鼠头部,放入PBS 中清洗2 次,显微剪刀从两侧口角进入,将胎鼠的下颌及舌部剪除,在显微镜下找到上颌,自唇中线至腭突后缘剪开,充分暴露腭突组织,双侧上颌外翻,分别剪下双侧腭突组织,将取出的腭突组织放入培养皿中并剪成1 mm3左右的组织块。采用组织块法对腭突细胞培养至第三代(passage 3,P3),第三代至第五代(passage 5,P5)MEPM 细胞将用于后续实验中。
MEPM 细胞分为四组:对照组(CONTROL)、RA 1 μmol/L 组(RA 1)、NAM 200 μmol/L 组(NAM 200)、NAM 200 μmol/L+RA 1 μmol/L 组(NAM 200+RA 1),将P3~P5 的MEPM 细胞接种于六孔板中,细胞浓度调整为105个/mL,每孔2 mL,加入完全培养液过夜培养,待其贴壁后,去除废液,PBS 冲洗2~3 次;加入无胎牛血清的培养液对MEPM 细胞饥饿培养,24 h 后,加入含有不同药物浓度的培养基,置入培养箱培养24 h。采用Annexin V-FITC/PI双染色法进行细胞凋亡的检测。细胞凋亡采用BD Accuri C6 流式细胞仪检测,构建FITC、PI 单阳对照组调节补偿,并用十字门分区后,将待测组上机检测早期凋亡率、晚期凋亡率和总凋亡率。总凋亡率=早期凋亡率+晚期凋亡率。
1.4 统计学分析
采用SPSS 22.0 统计软件对独立重复三次的实验数据进行统计学分析。卡方检验分析各组腭裂表型的构成比差异,方差分析比较各组MEPM 细胞凋亡率,P<0.05 为差异有统计学意义。
2 结 果
2.1 动物实验
每组5 只孕鼠,每只孕鼠怀有胚胎2~16 个,无死胎或吸收胎。胎鼠腭裂表型与非腭裂表型见图1,统计结果见表1。对照组中,活胎62 只,其中61 只具有腭裂表型,1 只不具有腭裂表型,其腭裂发生率为98%;实验组(1)中,活胎47 只,其中41 只具有腭裂表型,6 只不具有腭裂表型,腭裂发生率为87%,与对照组差异无统计学意义(χ2=3.83,P>0.05);实验组(2)中,活胎43 只,其中27 只具有腭裂表型,16 只不具有腭裂表型,腭裂发生率为63%,与对照组差异具有统计学意义(χ2=21.16,P<0.01)。

表1 烟酰胺预防全反式维甲酸诱导小鼠腭裂的胎鼠情况及腭裂率Table 1 Conditions of fetal rats and incidence of cleft palate in mice induced by all-trans retinoic acid with the prevention of nicotinamide

图1 正常腭与腭裂表型图Figure 1 Phenotype of normal palate and cleft palate
2.2 细胞实验
细胞凋亡率结果如图2、表2 所示。CONTROL组平均凋亡率16.53%±2.89%;与CONTROL 组相比,RA 1 组平均凋亡率为22.9%±1.85%,凋亡率上升(P<0.01),NAM 200组平均凋亡率9.23%±1.39%,凋亡率下降(P<0.01);与RA 1组相比较,NAM200+RA1 组平均凋亡率为14.9%±7.67%,凋亡率下降(P<0.01)。

图2 流式细胞仪检测MEPM 细胞凋亡Figure 2 Apoptosis of MEPM cells detected by flow cytometry
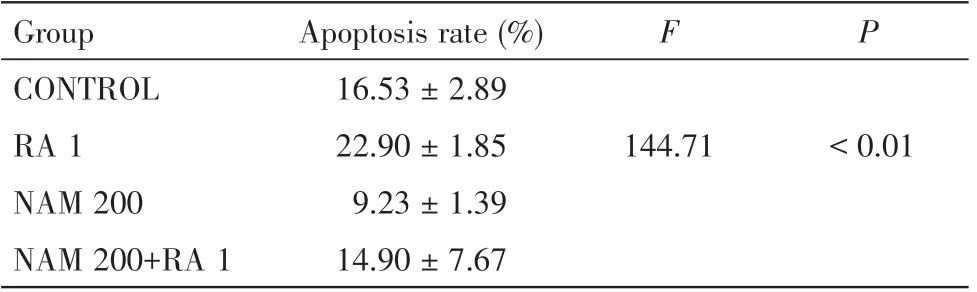
表2 流式细胞仪检测MEPM 细胞凋亡统计表Table 2 Statistical table of MEPM cell apoptosis detected by flow cytometry
3 讨 论
先天性腭裂是我国常见的出生缺陷疾病[9],RA 灌胃诱导小鼠腭裂模型是研究该疾病常用的实验动物研究模型[10],寻找能够预防先天性腭裂的方法具有重大意义。目前关于NAM 是否能够预防腭裂的研究尚无报道。
3.1 RA 诱导小鼠腭裂
RA 是维生素A 在体内氧化代谢的产物[11]。正常剂量的维生素A 对于维持胚胎细胞增殖、分化、迁移、凋亡具有重要作用,过量的RA 是研究腭裂病因学常用的致畸剂[12-13]。
RA 诱导胎鼠腭裂的模型受到多种因素影响,包括动物品种、给药时机、给药剂量等。给药时机的不同,诱导腭裂的可能机制也不尽相同。有研究表明于E8 对孕鼠通过灌胃给予RA 可以成功诱导腭裂,其机制可能与RA 影响了神经嵴细胞的生长发育过程有关;于E10 对孕鼠进行RA 的灌胃干预,会通过影响MEPM 细胞的增殖使腭突体积变小而诱导腭裂发生;于E12 对孕鼠进行RA 的灌胃干预,会通过影响腭的上抬、腭突的接触融合而诱导腭裂。于E10 对孕鼠进行RA 的灌胃干预,腭裂率最高,为100%。
本课题组前期于E10.5 使用RA 通过灌胃途径诱导胎鼠腭裂的动物模型较为成熟,腭裂率为100%[14]。本次动物实验使用70 mg/kg 的RA 于E10.5 对昆明孕鼠进行灌胃所诱导的腭裂发生率统计为98%,成功诱导了昆明小鼠腭裂表型的产生。
“维甲酸受体学说”是RA 诱导腭裂的一个可能机制。维甲酸受体是核受体家族中的子家族。RA 在体内可与维甲酸受体(retinoic acid receptors,RARs)、视黄素X 受体(retinoid X receptors,RXRs)结合发生构象变化,释放转录共抑制因子(co-repressor),募集转录共激活因子(co-activator),调节核内基因的表达[15]。RA 作用于机体的功能很可能是通过调控基因的表达进而发挥作用的,维甲酸信号通路的异常很可能是RA 诱导腭裂的重要机制之一。
“细胞凋亡”很可能是RA 诱导小鼠腭裂的另一个重要机制[16]。在对MEPM 细胞的研究中,Yu等[17]在细胞水平上使用梯度浓度的RA 诱导MEPM 细胞凋亡,并检测了Caspase-3、Caspase-8 以及Caspase-9 的酶活性,Caspase-3、Caspase-9 活性升高的结果表明,RA 可以通过内源性凋亡通路诱导MEPM 细胞的凋亡,而Caspase-8 活性无差异的结果也表明,RA 并没有通过外源性凋亡通路诱导MEPM 细胞的凋亡。在本次实验中,通过Annexin V-FITC/ PI 双染色法进行细胞凋亡的流式检测,验证了RA 对MEPM 细胞具有诱导凋亡的作用。1 μmol/L 的浓度是其出现凋亡表型的阈值,随着RA 浓度的上升毒性也越加明显。故本实验选取了RA 1 μmol/L 的阈值浓度[18],此浓度即可以使RA 表现出对MEPM 细胞的凋亡诱导作用,不会使MEPM 细胞过度死亡,同时也更容易发现烟酰胺的预防凋亡作用。
3.2 预防腭裂的相关药物
目前可能预防腭裂发生的药物主要有维生素B6、叶酸(Vit B9)、白藜芦醇(resveratrol)、锌(zinc)等。
人们对叶酸与胚胎发育的研究开展得较为丰富,叶酸的缺乏会导致腭裂的发生[19]。在北美,在谷物中添加叶酸已经被法律强制要求,流行病学调查研究已得出叶酸可以使唇腭裂发病率下调的结论[20]。叶酸在一碳单位代谢中起重要作用,叶酸代谢的正常运转对于维持DNA 甲基化、DNA 合成、DNA 修复具有重要作用,叶酸的缺乏会导致人体总基因组DNA 甲基化水平的降低,或一些DNA甲基化调节的异常[5,21],比如:蛋氨酸合酶(methionine synthase,MS)、亚甲基四氢叶酸脱氢酶1(methylene tetrahydrofolate dehydrogenase1,MTHFD1)、亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)[22-23]等。上述酶的异常会引起高同型半胱氨酸血症,影响DNA 的正常甲基化。叶酸可能是通过影响血液中同型半胱氨酸浓度的改变,影响腭的生长发育。叶酸也可能通过促进MTHFR 的活性上调了同型半胱氨酸向蛋氨酸的转化,进而改变了DNA 的合成,预防腭裂的发生。
维生素B6 的缺乏也会增加唇腭裂的风险。维生素B6 可能通过阻断糖皮质激素受体,改变了地塞米松诱导小鼠腭裂的核基因表达[24],同时维生素B6 也是同型半胱氨酸的辅助因子,也可能参与调节半胱氨酸向蛋氨酸的转化,改变了DNA 合成,进而预防腭裂的发生。
血锌含量与唇腭裂的发生也可能具有一定相关性[25]。既往研究锌对体外小鼠胚胎腭融合的影响时发现,较高浓度的锌能有效促进腭的融合,缺锌条件下MEPM 细胞中凋亡细胞较对照组明显增多、腭组织融合被阻碍;然而,在动物试验中,补充锌未能有效阻断RA 诱导的胎鼠腭裂。上述实验的不同结果使得锌预防腭裂的作用处于争议状态。
白藜芦醇也很可能具有预防腭裂的作用。Ni 等[25]通过研究发现,白藜芦醇具有调控腭突间质细胞中MTHFR 表达的作用,其调控机制可能与转化生长因子-β1(transforming growth factor β1,TGF-β1)/Smad 蛋白家族(Smad familly,Smad)通路有关。
3.3 NAM 预防腭裂的可能机制
烟酰胺(NAM),亦称尼克酰胺,是烟酸(维生素B3)的胺化合物。NAM 目前是临床上使用的成熟药物,主要应用于防治糙皮病、维生素的补充、洋地黄中毒后缓慢性心律失常的辅助治疗、改善维拉帕米引起的心率减慢和房室传导阻滞等。
本次实验组相较对照组,胎鼠数降低,孕期NAM 的补充是否具有毒性反应需要讨论,通过检索FDA Drugs Database 记录中(https://www.drugfuture.com/toxic/q81-q953.html)的毒理实验,发现该药物在小鼠口服途径的半数致死量(lethal dose 50%,LD50)为2.5~3.5 g/kg,致畸、致癌、致突变实验均为阴性,现己被美国FDA 认作安全药物。本次动物实验筛选出NAM 经尾静脉注射途径预防RA 诱导腭裂的有效浓度为40 mg/kg,远未达到LD50剂量,但其安全性和毒性仍待评估,其最佳浓度仍待进一步实验。
本次细胞实验初步显示了一定浓度的NAM 具有降低MEPM 细胞凋亡的作用。同时NAM 可以减少MEPM 的细胞凋亡产生,可以拮抗RA 诱导MEPM 的细胞凋亡。
文献报道NAM 可以调节细胞能量代谢,影响和调节与细胞存活和死亡[26]。NAM 具有保护细胞免受氧化应激损伤的作用[27]。三羧酸循环是需氧生物体内(线粒体内)普遍存在的代谢途径,辅酶Ⅰ(烟酰胺腺嘌呤二核苷酸,NAD+)、辅酶Ⅱ(烟酰胺腺嘌呤二核苷酸磷酸,NADP+)作为递氢体参与氧化呼吸链的代谢过程[28],还参与脂质代谢、糖原分解等过程[29-30]。NAM 是辅酶Ⅰ的前体药物[31],可增加辅酶Ⅰ、增加NAD+与烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotid,NADH)的比值以缓解氧化应激,从而避免细胞发生凋亡[32-33]。同时,NAM 可抑制ADP-核糖聚合酶(poly ADP ribose polymerase,PARP),保护基因组的完整性,改变细胞的能量代谢,改变细胞中甲基化水平代谢及DNA、蛋白质的甲基化,导致细胞转录组和翻译组发生变化,减少细胞凋亡的发生[34]。
推测NAM 可能是通过抑制MEPM 细胞的凋亡、保护基因组的完整性、改变甲基化水平等可能机制发挥预防腭裂的作用,具体机制及相关通路仍有待进一步研究。
3.4 创新性及展望
本次实验发现了NAM 在特定浓度下具有预防腭裂的作用,并初步探索了与细胞凋亡相关的机制,发现了NAM 预防腭裂的作用机制可能是通过阻断RA 诱导的MEPM 细胞凋亡产生的。未来将进一步探索相关机制及通路研究,使孕期补充适量的NAM 成为腭裂预防的新方法。
【Author contributions】Li GW designed the main experiments, analyzed the data and wrote article.Tang SJ performed the experiments,contributed to the acquisition and analysis of data.All authors read and approved the final manuscript as submitted.
