低氧环境下EphrinB2/EphB4调控MC3T3-E1细胞成骨分化的实验研究
2023-05-20刘紫杉王一鑫李永明
刘紫杉,王一鑫,李永明
上海牙组织修复与再生工程技术研究中心,同济大学口腔医学院,同济大学附属口腔医院正畸科,上海(200072)
牙槽骨是牙齿的重要支持部分,在正畸牙移动及牙周炎发展及治疗的过程中,涉及到骨稳态的平衡及骨改建。牙槽骨血供丰富,在受到机械应力、炎症刺激时,由于骨组织内血流中断,部分区域组织无法正常供氧及营养物质,常常处于低氧环境[1]。低氧参与并影响机体正常生理过程,氯化钴是已经被广泛应用的低氧模拟物,通过增加缺氧诱导因子-1α(hypoxia inducible factor,HIF-1α)的表达水平影响下游的低氧反应元件,从而使细胞达到化学低氧状态,可用于体外研究模拟细胞低氧状态[2-3]。研究表明,HIF-1α 参与调控低氧环境下机体的反应,是骨组织在低氧环境下调节骨代谢的核心分子[4]。HIF-1α 的激活刺激多个缺氧反应基因的转录,可通过多种通路参与调节骨的形成与恢复[5-6]。研究发现,破骨细胞表达的促红细胞生成素肝细胞激酶受体配体B2(erythropoietin producing hepatocyte kinase receptor ligand B2,EphrinB2)和成骨细胞表达的促红细胞生成素肝细胞激酶受体B4(erythropoietin producing hepatocyte kinase receptor B4,EphB4)通过相互作用产生双向信号,影响成骨细胞和破骨细胞功能,参与骨稳态的调控[7-8]。在成骨细胞谱系中,EphrinB2 与EphB4均有表达,通过相互作用,可以抑制成骨细胞的凋亡来支持成骨细胞谱系的持续分化,从而维持促进新的类骨质基质矿化[9]。但在低氧条件下,缺氧对成骨细胞EphrinB2/EphB4 的表达及成骨分化的影响目前尚不清楚。
本研究通过使用氯化钴(CoCl2)模拟低氧环境,观察低氧环境下MC3T3-E1 细胞HIF-1α、EphrinB2 及EphB4 的表达变化及成骨分化情况,了解低氧是否通过EphrinB2/EphB4 信号通路调控MC3T3-E1 细胞的成骨分化,为低氧环境下骨代谢机制的研究提供参考。
1 材料和方法
1.1 主要试剂和仪器
小鼠胚胎成骨细胞前体细胞系MC3T3-E1(上海研生生化试剂有限公司,中国),PBS(Hyclone,美国),胎牛血清(BI,以色列),DMEM培养基(Gibco,美国),50 μmol/L抗坏血酸(Sigma,美国),10 mmol/L β-磷酸甘油(Sigma,美国),100 nmol/L 地塞米松(Sigma,美国),1%青-链霉素(Hyclone,美国),胰蛋白酶(Gibco,美国),RNA 逆转录试剂盒(Takara,日本),TRIZOL 试剂(Thermo Fish,美国),茜素红工作染液(Solarbio,中国),BCIP/NBT 免疫组织化学显色试剂盒(上海生工生物公司,中国),氯化钴(Sigma,美国),EphB4 激酶自身磷酸化抑制剂NVPBHG712(MCE,美国)。
RIPA 裂解液(Thermo Fisher,美国),兔抗鼠多克隆HIF-1α 抗体(1∶1 000,Affinity,美国),兔抗鼠多克隆β-actin 抗体(1∶3 000,Affinity,美国),兔抗鼠多克隆EphB4 抗体(1:1 000,Proteintech,美国),兔抗鼠多克隆runt相关转录因子2(runt related transcription factor 2,RUNX2)抗体(1∶1 000,Affinity,美国),兔抗鼠多克隆I 型胶原(collogen-1,COL I)抗体(1:1 000,Affinity,美国),兔抗鼠多克隆碱性磷酸酶(alkaline phosphatase,ALP)抗体(1∶1 000,博士德,中国),鼠单克隆骨钙素(osteocalcin,OCN)抗体(1∶1 000,博士德,中国),羊抗兔荧光二抗(IR Dye 800CW,Abcam,英国)、羊抗鼠荧光二抗(IR Dye 680RD,Abcam,英国),实时荧光定量PCR 仪(Lightcyler96,Roche,瑞士),Western 激光成像系统(Odyssey clx,LICOR,美国)。
1.2 细胞培养与低氧诱导
在DMEM 培养基中加入10%胎牛血清,1%青-链霉素配制完全培养基用于培养MC3T3-E1 细胞,在5%体积分数CO2、37 ℃的环境中培养。氯化钴组培养基中加入125 μmol/L 的氯化钴,对照组使用正常培养基,氯化钴+抑制剂组在培养基中加入125 μmol/L 的氯化钴和50 nmol/L 的NVP-BHG712,NVP-BHG712 是EphB4 激酶自身磷酸化的抑制剂,阻止EphB4 与EphrinB2 的接触反应。在48 h 后对细胞进行RNA 和蛋白质的提取。在完全培养基中加入50 μmol/L 抗坏血酸、10 mmol/L β-磷酸甘油、100 nmol/L 地塞米松,对细胞进行成骨诱导,每48 h更换培养基。
1.3 细胞增殖测定
以2×104个/mL 接种MC3T3-E1 细胞于96 孔板,按照分组处理培养48 h 后,PBS 洗涤,每孔加入CC-K8 溶液10 μL 与90 μL 完全培养基,于37 ℃CO2培养箱孵育2 h 后,酶标仪波长450 nm 检测吸光度,根据公式:细胞活力=(实验组的吸光度-空白组的吸光度)/(对照组的吸光度-空白组的吸光度),计算细胞活力。
1.4 qRT-PCR
按分组处理细胞48 h,使用TRIZOL 对各组细胞进行裂解,提取总RNA,使用逆转录试剂盒进行逆转录,qRT-PCR 检测成骨标志物ALP、RUNX2、COL 1、OCN 的变化情况,以及信号分子HIF-1α、EphrinB2、EphB4 的变化。以β-actin 作为内参,引物序列见表1。

表1 PCR 引物序列Table 1 PCR primers sequences
1.5 Western blot
按分组处理MC3T3-E1 细胞48 h 后,弃培养基,PBS 洗涤3 次,使用含蛋白酶抑制剂的RIPA 裂解细胞,进行蛋白的抽提及定量。取等量总蛋白100 ℃加热5 min,10%及12.5%SDS-PAGE 电泳分离后,转至NC 膜,使用5%BSA 封闭1 h,封闭后分别与兔抗鼠多克隆HIF-1α 抗体(1∶1 000),兔抗鼠多克隆β-actin 抗体(1∶3 000),兔抗鼠多克隆EphB4抗体(1∶1 000),兔抗鼠多克隆Ephrinb2 抗体(1∶1 000),兔抗鼠多克隆ALP 抗体(1∶1 000),兔抗鼠多克隆RUNX2抗体(1∶1 000),兔抗鼠多克隆COL I抗体(1∶1 000),鼠单克隆OCN 抗体(1∶1 000)4 ℃孵育过夜,使用羊抗兔荧光二抗或羊抗鼠荧光二抗孵育,使用Odyssey clx 激光成像系统显色。
1.6 ALP 染色及定量分析
对3 组细胞成骨诱导7 d,弃培养基,使用PBS清洗细胞3 次,使用4%的多聚甲醛固定液固定,按照BCIP/NBT 免疫组织化学显色试剂盒说明书配置ALP 染色液,染色5 min 后洗涤,拍照。使用Image J对染色结果进行分析。
1.7 茜素红染色
不同条件处理下的细胞成骨诱导21 d 后,首先使用4%多聚甲醛室温固定30 min,PBS 轻缓冲洗3 次,加入茜素红工作染液室温染色5~10 min,吸取染色液,使用PBS 轻柔洗涤,显微镜下拍摄,使用Image J 对染色结果进行分析。
1.8 统计学分析
所有实验设置3 个重复进行并独立进行3 次。使用SPSS20.0、GraphPad Prism8.0、Image J 软件进行分析与绘图,两组间比较采用独立样本t检验,P<0.05 为差异具有统计学意义。
2 结 果
2.1 氯化钴及EphB4 磷酸化抑制剂NVP-BHG712对MC3T3-E1 细胞增殖的影响
分别使用125 μmol/L 的氯化钴,50 nmol/L 的NVP-BHG712 处理MC3T3-E1 细胞48 h 后,与对照组比较,细胞增殖率无明显差异(图1)(P>0.05),说明在细胞培养基中加入氯化钴和抑制剂NVPBHG712 不影响细胞的增殖与凋亡。

图1 氯化钴及NVP-BHG712 处理MC3T3-E1 48 h 对细胞增殖的影响Figure 1 The effect of CoCl2and NVP-BHG712 treatment on MC3T3-E1 cell proliferation for 48 h
2.2 氯化钴低氧诱导对MC3T3-E1 成骨分化的影响
两组MC3T3-E1 细胞培养48 h 后成骨标记物mRNA 的检测结果显示:相比对照组,MC3T3-E1 经过125 μmol/L 氯化钴刺激48 h 后,ALP(t= 3.215,P= 0.032 4)、RUNX2(t= 5.332,P= 0.006)、COL I(t=12.41,P=0.000 2)、OCN(t=6.175,P=0.003 5)等成骨标志物mRNA 表达明显上升,差异具有统计学意义(图2a)。两组细胞成骨诱导7 d 后ALP染色结果如图2b,Image J 定量分析结果显示,氯化钴组细胞成骨分化明显高于对照组(t= 8.023,P=0.015 2),差异具有统计学意义(图2c)。

图2 氯化钴低氧诱导对MC3T3-E1 细胞成骨分化影响Figure 2 Effects of hypoxia caused by CoCl2on osteogenic differentiation in MC3T3-E1 cells
2.3 低氧诱导使MC3T3-E1 中HIF-1α 表达上调,并上调EphrinB2 及EphB4 的表达
在MC3T3-E1 的培养基中加入氯化钴可以上调HIF-1α 的表达,实现模拟低氧环境,其中mRNA上调120 倍(t= 9.406,P= 0.000 7),HIF-1α/β-actin蛋白比值增加1.5 倍(t= 17.49,P<0.000 1)。通过对氯化钴诱导48 h 后的细胞进行qRT-PCR 检测,发现EphrinB2(t= 15.82,P<0.000 1)和EphB4(t=23.40,P<0.000 1)表达上调(图3a)。经Western blot 检测,EphrinB2/β-actin 蛋白比值(t=16.44,P<0.000 1)增加,EphB4/β-actin 蛋白比值(t= 14.87,P=0.000 1)也增加,差异具有统计学意义(图3b、3c)。
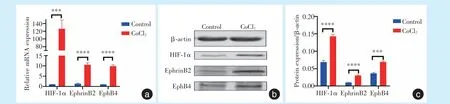
图3 MC3T3-E1 细胞在氯化钴低氧诱导下HIF-1α,EphrinB2,EphB4 基因及蛋白表达变化Figure 3 Expression of HIF-1α,EphrinB2,and EphB4 in MC3T3-E1 cells under hypoxia caused by CoCl2
2.4 抑制低氧诱导下EphrinB2 与EphB4 的结合可抑制细胞成骨分化及矿化
相比氯化钴组,添加抑制剂组ALP(t= 5.324,P= 0.006)、RUNX2(t= 13.38,P= 0.000 2)、COLI(t=7.435,P=0.001 7)、OCN(t=2.385,P=0.075 5)成骨标记物mRNA 表达下调,差异具有统计学意义(图4a)。
三组成骨诱导7 d ALP 染色结果见图4b,Image J 定量分析结果显示,使用EphB4 激酶自身磷酸化抑制剂后,细胞的成骨分化明显减少(t=57.69,P=0.000 3),差异具有统计学意义(图4c)。成骨诱导21 d 茜素红染色结果见图4d,Image J 定量分析结果显示,使用EphB4 激酶自身磷酸化抑制剂后,细胞的矿化明显减少(t=14.24,P=0.004 9),差异具有统计学意义(图4e)。另外,Western blot检测结果显示,添加抑制剂组中成骨标志物ALP、OCN、Runx2、COLI 蛋白水平也低于氯化钴组,差异具有统计学意义(图4f、4g)。

图4 抑制EphB4 与EphrinB2 结合对氯化钴低氧诱导下MC3T3-E1 细胞成骨分化影响Figure 4 Effects of restraining the combination of EphB4 and EphrinB2 under hypoxia caused by CoCl2on osteogenic differentiation in MC3T3-E1 cells
3 讨 论
研究低氧环境下骨代谢的调节机制,对了解牙槽骨在机械应力、炎症刺激下维持骨稳态平衡、进行骨改建具有重要意义。目前研究表明低氧对骨代谢起到调节作用,参与骨稳态的维持[10-12]。作为细胞处于低氧环境的标志物,HIF-1α 在低氧环境下被激活,调节氧诱导基因的表达。以往研究发现,低氧会诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)转录增加,刺激局部血管的形成,输送营养物质,从而增强骨生成[13-17];同时低氧环境可通过HIF-1α-GRP78-Akt 信号通路促进间充质干细胞的存活、增殖,从而抑制骨髓间充质干细胞的凋亡[18];通过STAT3 信号促进骨髓间充质干细胞的成骨分化,促进成骨[19]。本研究发现,在氯化钴诱导细胞低氧环境下HIF-1α 表达升高,成骨标志物(ALP、RUNX2、COL I、OCN)在mRNA 水平的表达升高,细胞成骨分化能力增强,与以往研究结果一致。但也有研究报道持续的缺氧会抑制成骨分化[20-21]。本研究结果显示,48 h 的低氧诱导增强了MC3T3-E1 的成骨分化,提示低氧暴露时间可影响成骨细胞的分化,适宜的低氧暴露可以有效诱导前体细胞成骨分化。
破骨细胞表面的EphrinB2 与成骨细胞表面表达的EphB4 结合产生双向信号传递,其中正向信号通过刺激EphB4 增强Rho 蛋白的活性可诱导成骨分化。在成骨细胞中,特异性抑制EphrinB2 和EphB4 磷酸化可明显降低成骨细胞分化,表明成骨细胞谱系中EphrinB2/EphB4 相互作用在成骨细胞分化中起到关键作用[22]。研究报道,缺氧可上调小鼠皮肤中的Eph 受体和Ephrin 配体的表达[23],也有研究显示缺氧可上调血管内皮细胞中EphrinB2表达[24]。然而有关成骨细胞分化过程中缺氧和EphrinB2/EphB4 之间的关系目前尚未见报道。本研究发现,氯化钴处理MC3T3-E1 细胞后,HIF-1α mRNA 和蛋白表达升高,缺氧诱导成功;MC3T3-E1细胞EphrinB2、EphB4 mRNA 和蛋白的表达上调,表明低氧可以促进MC3T3-E1 细胞表达EphrinB2和EphB4。通过对低氧诱导的MC3T3-E1 细胞使用EphB4 磷酸化抑制剂NVP-BHG712,阻止EphrinB2与EphB4 结合产生信号后,MC3T3-E1 的成骨标志物表达明显下降,对细胞进行成骨诱导,ALP 染色及茜素红染色结果进一步表明细胞的成骨分化及矿化能力下降。实验初步证明低氧可以通过上调EphrinB2、EphB4 在MC3T3-E1 细胞表面的表达,调节其成骨分化能力。
低氧环境中,HIF-1α 被激活,成为90~100 个基因转录的缺氧反应元件,促红细胞生成素(erythropoietin,EPO)是其中重要基因之一[7],EPO 可通过与间充质干细胞和造血干细胞的直接相互作用来刺激成骨细胞分化,促进成骨[25-26]。EPO 可通过促进骨髓间充质干细胞表面EphB4 过表达,与EphrinB2 结合,驱动成骨细胞分化[27-28]。因此,推测低氧可能通过HIF-1α-EPO- EphrinB2/EphB4 对MC3T3-E1 细胞的成骨分化做出调控。具体机制需进一步深入研究。
综上所述,本研究发现在氯化钴诱导的体外细胞低氧环境,MC3T3-E1 的成骨分化增加,同时,细胞低氧环境上调了HIF-1α、EphrinB2、EphB4 的表达,而阻止EphrinB2 和EphB4 的结合后,细胞的成骨分化下降,表明缺氧和EphrinB2/EphB4 之间的信号转导在促进前体细胞成骨分化过程中具有重要作用。EphrinB2/EphB4 可在低氧环境下促进MC3T3-E1 细胞的成骨分化,增加成骨标志物的表达及基质矿化,为低氧调控骨代谢机制的研究提供了新的参考依据。
【Author contributions】Liu ZS peformed the experiments, analyzed the data, and wrote the article.Wang YX revised the article.Li YM designed the study and guided the writing of the article.All authors read and approved the final manuscript as submitted.
