JAK2-STAT3通路介导牙龈卟啉单胞菌促结肠癌Caco-2细胞增殖的研究
2023-05-20张若彤刘晓晨叶玮
张若彤,刘晓晨,叶玮
1.上海交通大学医学院附属第九人民医院口腔预防科,上海交通大学口腔医学院,国家口腔医学中心,国家口腔疾病临床医学研究中心,上海市口腔医学重点实验室,上海市口腔医学研究所,上海(200011);2.辽宁中医药大学附属第三医院消化内科,辽宁 沈阳(110003)
牙龈卟啉单胞菌(Porphyromonas gingivalis,P.g)是革兰氏阴性厌氧菌,是牙周病中研究最多、最重要的致病菌之一[1]。有研究表明,P.g可以从口腔转移到肠道,结肠黏膜的厌氧和高pH 环境亦有利于P.g的黏附[2]。同时,P.g可分泌多种蛋白酶毒力因子破坏结肠表面的黏液层,从而直接接触肠上皮并可能引发多种肠道疾病如炎症性肠病(inflammatory bowel disease,IBD)[3]、结肠癌(colorectal cancer,CRC)[4]等。目前,已有越来越多研究证明P.g可以定植于结肠癌组织内,通过招募髓系免疫细胞,为结直肠癌细胞营造一个富集髓系细胞的促炎肿瘤微环境[4],但P.g对肿瘤细胞本身的作用鲜有研究和报道。慢性炎症在促肿瘤生长的过程中发挥重要作用,虽然目前已经明确单独的细胞增殖不会引起恶性肿瘤的发生,但是在炎性因子、生长基质都非常丰富的环境下,DNA 损伤促进剂存在的环境下持续的细胞增殖可能会提升肿瘤发生的风险[5]。白细胞介素-6(interleukin-6,IL-6)和白细胞介素-10(interleukin-10,IL-10)与肿瘤的发生发展密切相关[5]。IL-10 是一种广泛表达的抗炎因子,对肿瘤的生长有一定的抑制效果[6]。IL-6是一种常见且多变的炎症细胞因子,常在组织损伤或感染时分泌增加,它不仅在机体免疫和炎症反应中具有核心作用,而且还被认为是恶性肿瘤的关键生长因子[7]。信号转导与转录激活因子3(signal transducers and activators of transcription 3,STAT3)是负责诱导细胞周期蛋白的关键信号分子之一[8],过度激活STAT3 可以直接通过肿瘤自主机制或间接通过调节肿瘤相关基质和免疫系统的抗肿瘤反应来促进肿瘤生长。STAT3 可以通过多种通路被调节,蛋白酪氨酸激酶2(janus kinase 2,JAK2)-STAT3 信号通路是目前发现的参与STAT3表达的最重要通路之一,JAK2-STAT3 信号通路在许多类型的癌症中都表现出异常高活化[9]。本实验采用梯度细菌感染复数(multiplicity of infection,MOI)的P.g对人结肠癌细胞(Caco-2)进行不同时间的刺激,观察Caco-2 中促炎因子IL-6 和抑炎因子IL-10 的表达水平变化,并深入探讨增殖通路JAK2-STAT3 在结肠癌细胞增殖中的作用及机制,为进一步探讨P.g与结肠癌之间的关系提供实验依据。
1 材料和方法
1.1 材料
Caco-2 细胞系SCSP-5027(中科院细胞库,中国);P.gingivalis ATCC33277(中科院细菌库,中国);CCK8 试剂盒(Biosharp 公司,中国);BCA 蛋白浓度测定试剂盒(Thermo Scientific 公司,美国);Trizol(Ambion 公司,美国);Fast-KingcDNA 第一链合成试剂盒(北京天根生物有限公司,中国);SuperRealPreMix Plus(SYBR Green)(北京天根生物有限公司,中国);兔抗人IL-6(Abmart 公司,中国);IL-10(Abmart 公司,中国);p-JAK2(Abmart 公司,中国);p-STAT3(Abmart 公司,中国);鼠抗β-actin(millipore 公司,美国);10%胎牛血清(Gibco 公司,美国);DMEM 高糖培养基(cytiva 公司,美国);青霉素、链霉素(Gibco 公司,美国);胰酶(Gibco 公司,美国);BHI 培养基(Sigma 公司,美国);氯化血红素(国药集团化学试剂有限公司,中国);无菌脱纤维羊血(Solarbio 公司,中国);维生素K1(天津药业集团,中国);琼脂(Sigma 公司,美国)。
1.2 细胞培养
从液氮容器中取出细胞冻存管,立即放入37 ℃水浴锅中,并不时摇动使其迅速融化。待冻存液完全融化,将细胞悬液转移至灭菌离心管中,常温离心,1 000 rpm 离心5 min,弃去上清液,加入适量含20%胎牛血清的高糖DMEM 培养液重悬细胞,并转移至细胞培养皿中,置于37 ℃、5%CO2培养箱静置培养。次日更换1 次培养液,继续培养。待复苏后的细胞状态稳定并生长至70%~80%融合后传代培养。待细胞长至对数生长期时收集细胞,计数并调整细胞悬液浓度备用。
1.3P.gATCC33277 培养
将冻存细菌从-80°冰箱取出,手心温度融化,接种于脑心浸液琼脂培养基上,培养基含5%脱纤维羊血、1%氯化血红素和0.1%维生素K1。晾干后放至厌氧盒,37 ℃厌氧培养3~5 d。3~5 d 后传代至新的固体培养基。液体增菌时,离心管中加5~6 mL 液体培养基。从固体培养基刮取适量菌体入液体培养基,吹匀,拧紧离心管后再柠松半圈。放回厌氧盒,培养16~24 h 备用。
1.4 细菌与细胞共培养模型构建
Caco-2 细胞长至70%~80%融合后,消化收集细胞,重悬于新鲜培养基后根据实验目的接种于不同规格细胞培养皿(1 皿用于细胞计数,剩余用于实验)中。接种完成后,待细胞贴壁24 h 后,消化计数,计算每皿总细胞数。P.g液体增菌16~24 h后,吸取适量细菌悬液,5 000 rpm,离心10 min 后,PBS 洗涤1 次,重悬于细胞完全培养基。设置刺激时间分别为12、24、48 h,MOI=0 为对照组,MOI=1、10、25 为实验组。使用紫外分光光度计在OD600测量细菌浓度,根据实验设置MOI 数值稀释细菌至合适浓度并加入至准备好的细胞培养皿中。
1.5 CCK8 法检测Caco-2 增殖情况
Caco-2 细胞培养至70%~80%后,消化收集细胞,细胞计数并调整细胞浓度为5×104个/mL,96 孔板每孔加入100 μL 调整后的细胞悬液。贴壁24 h后,消化3 个孔进行计数并计算平均值,代表每孔实际细胞数。设置刺激时间分别为12、24、48 h,MOI=0 为对照组,MOI=1、10、25 为实验组。按照组别设定依次向各孔加入相应的细菌悬液,12、24、48 h 后,更换含有1%抗生素的培养基孵育1 h 后,再更换含有10 μL 的CCK8 试剂的完全培养基110 μL,37 ℃避光孵育1 h,酶标仪450 nm 检测各孔吸光值,每个条件重复5 个孔。对照组细胞数设置为100%,以实验组与对照组OD450平均值的比值百分数表示实验组相对对照组的细胞数量增殖百分比。
1.6 qRT-PCR检测P.g梯度感染Caco-2细胞后IL-6、IL-10、JAK2、STAT3 mRNA 表达
从MOI 梯度和刺激时间梯度两个维度进行检测,首先设置MOI=0 为对照组,MOI=1、10、25,刺激时间为24 h 为实验组,检测MOI 梯度下相关蛋白表达变化情况;接着设置MOI=0 为对照组,MOI=10、刺激时间为12、24、48 h 为实验组,检测时间梯度下相关蛋白表达变化情况。检测P.g梯度感染Caco-2 细胞后,不同时间炎症因子IL-6、IL-10、JAK2、STAT3 mRNA 表达情况。采用TRIzol 试剂提取细胞中总RNA,置于-80 ℃冰箱保存备用。根据反转录试剂盒说明书进行反转录,反应体系为10 μL,并将得到的cDNA 保存于-20 ℃冰箱保存备用。引物序列见表1。按照试剂盒说明书进行操作,反应体系为20 μL。样品以β-actin 为内参基因,设置主副孔,每个条件重复至少5 次。反应条件为95 ℃3 min 预变性,95 ℃10 s 变性,57 ℃20 s退火,72 ℃20 s 延伸,共45 个循环。采用2-ΔΔCt定量分析法计算基因相对表达变化。

表1 PCR 引物序列Table 1 PCR primer sequences
1.7 Western blot 检测P.g梯度感染Caco-2 细胞后IL-6、IL-10、p-JAK2、p-STAT3 蛋白表达
设置MOI=0 为对照组,MOI=10、刺激时间为12、24、48 h 为实验组,检测时间梯度下相关蛋白表达变化情况。将需要抽提蛋白的细胞取出,吸去培养液,PBS 洗涤3 遍,尽量吸干PBS。按照每1×106个细胞加入Ripa 裂解液(裂解液中预先按照1∶1 000 的比例混匀蛋白酶抑制剂和磷酸化蛋白酶抑制剂)100 μL,冰上放置15~20 min 充分裂解细胞。用细胞刮收集细胞于离心管中,14 000 rpm 离心40~45 min,取上清,用BCA 试剂盒测定样品的蛋白浓度。稀释样品,按照每孔上样量为30 μL 蛋白分装样品并加入缓冲液95 ℃10 min 处理样品使蛋白变性。将样品进行SDS-PAGE 电泳后转印至PVDF 膜,5%脱脂奶粉室温封闭2 h,TBST 洗膜3 次,每次15 min。分别加入稀释好的抗体:IL-6、IL-10、p-JAK2、p-STAT3 和β-actin,4 ℃摇床孵育过夜(至少18 h)。TBST 洗膜3 次,每次15 min。按照1∶3 000 稀释HRP 标记的抗兔IgG 二抗,室温孵育2 h后,TBST同前洗膜4次,每次7 min。蛋白电泳条带显影,使用Image J 软件对条带进行灰度值定量分析。以β-actin 条带做为内参,用目的条带与β-actin条带的灰度值比例反映目的蛋白的表达水平。
1.8 检测JAK2 抑制剂AZ960 对P.g感染Caco-2 细胞的影响
加入JAK2 抑制剂AZ960,检测感染P.gCaco-2细胞增殖情况,以及JAK2、STAT3 mRNA,p-JAK2、p-STAT3 蛋白表达。CCK8 实验中,设置加入细菌(MOI=10,t= 12、24、48 h)、不加AZ960 为对照组,同时加入细菌(MOI=10,t= 12、24、48 h)和AZ960为实验组,实验方法同1.5。qRT-PCR 和Western blot 中,设置不加细菌和AZ960 为阴性对照组,加细菌(MOI=10,t= 24 h)、不加AZ960 为阳性对照组,同时加入细菌(MOI=10,t=24 h)和AZ960 为实验组。实验方法同1.6、1.7。
1.9 统计学处理
应用统计学软件SPSS(version 23.0,IBM,USA)进行统计学分析,采用Graphpad Prism5 作图。对于计量资料数据采用独立样本t检验,方差不齐的数据采用近似t 检验;多组比较采用方差分析;P<0.05 为差异有统计学意义。
2 结 果
2.1P.g对Caco-2 细胞形态学影响
将常规培养的结肠癌Caco-2 细胞置于倒置显微镜下观察细胞状态。MOI=0,培养时间为12、24、48 h 时,细胞生长状态良好,多数细胞呈梭形分枝状。MOI=1、10 时,细胞状态良好,同时间段相较对照组贴壁细胞增多;MOI 增大至25 时,随着刺激时间延长至24 h 和48 h,少量细胞有飘起现象,但整体细胞状态尚可(图1)。综上,P.g感染结肠癌Caco-2 细胞的模型构建成功,细胞的良好生长状态为后续实验的稳定性建立基础。
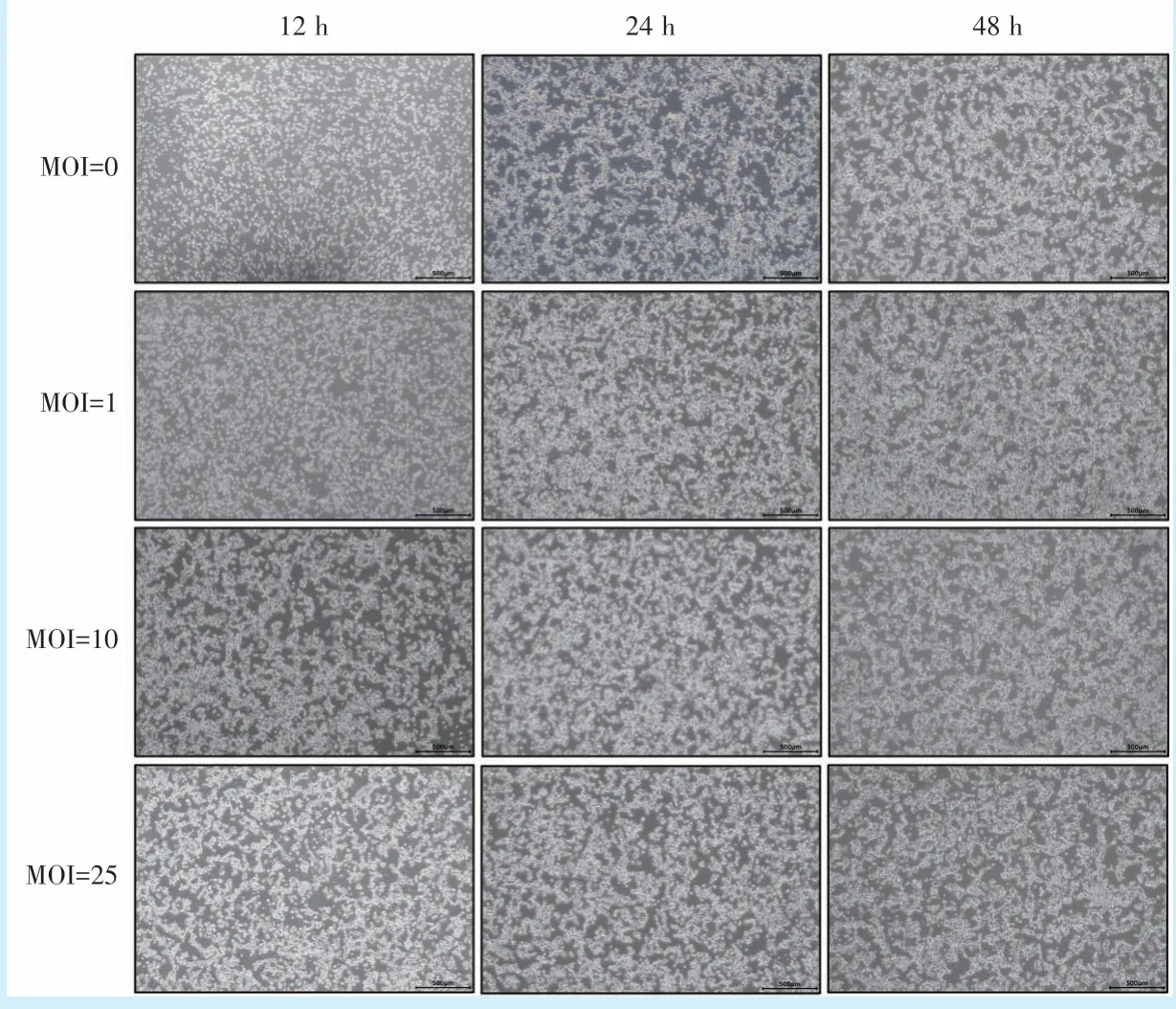
图1 不同MOI 牙龈卟啉单胞菌刺激下结肠癌Caco-2 细胞形态观察(×40)Figure 1 Morphological observation of Caco - 2 colorectal cancer cells stimulated byP.gat different MOIs(×40)
2.2 CCK8 检测P.g对Caco-2 增殖的影响
P.g梯度感染Caco-2 细胞的结果显示,当MOI为1 和10 时,作用时间12 h、24 h 后,P.g对Caco-2细胞表现出持续促进增殖的作用(P<0.05),其中MOI 为10 时,P.g对Caco-2 细胞刺激作用最为明显;感染48 h,P.g对Caco-2 细胞依然表现出持续促进增殖的作用,但增殖差异不显著(P=0.176)。当MOI 增大至为25 时,P.g对Caco-2 细胞在12 h 时表现为促进生长作用,随着刺激时间延长至48 h,Caco-2 细胞增殖被抑制(图2)。
2.3P.g感染Caco-2 细胞后IL-6 和IL-10 表达
qRT-PCR 实验结果显示,当刺激时间为24 h,与对照组(MOI=0)相比,随着MOI 从1 增加到10 再到25 时,IL-6 的mRNA 水平先升高再降低,并在MOI 为10 时上升至最高(P<0.001);而IL-10 的mRNA 水平与IL-6 相比则呈现相反趋势;当MOI 为25 时,IL-6 和IL-10 的mRNA 水平相较于对照组均降低(图3a、3b)。
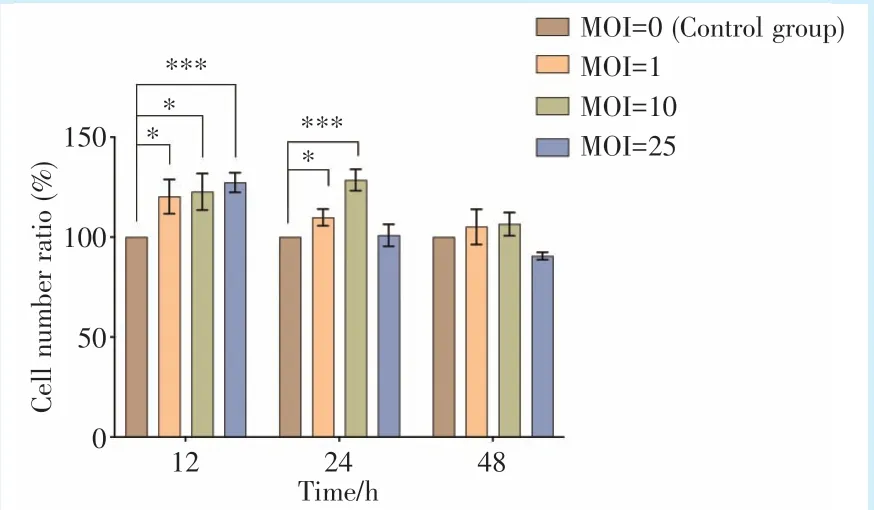
Figure 2 Effect ofP.gon the proliferation of Caco-2 cells by CCK8 assay图2P.g对Caco-2 细胞增殖的影响
随后检测不同感染时间IL-6 和IL-10 表达变化,当MOI 为10 时,与对照组(MOI=0)相比,IL-6 的mRNA 水平在刺激时间为24 h 时达到最高(P<0.01);而IL-10 的mRNA 水平与IL-6 呈现相反趋势,在刺激时间为24 h 时显著低于对照组(图3c、3d)(P<0.05)。
Western blot 实验结果显示,当MOI 为10 时,与对照组(MOI=0)相比,IL-6 的蛋白表达水平在刺激时间为24 h 时达到最高(P<0.05);而IL-10 蛋白表达水平与IL-6 呈现相反趋势,在刺激时间为24 h时开始显著低于对照组(P<0.01)(图3e、3f)。
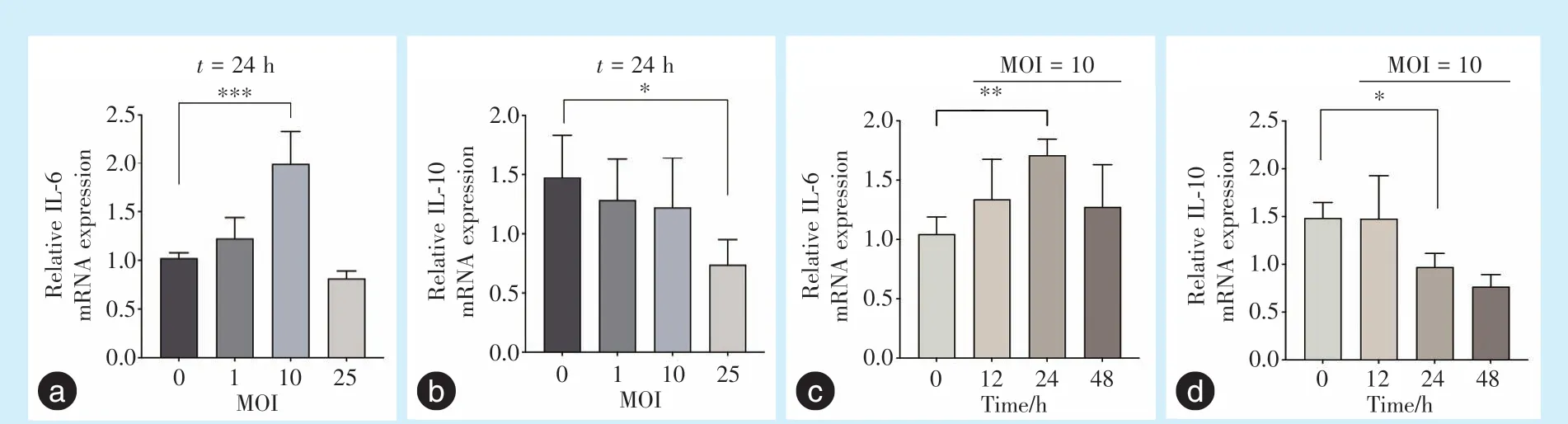
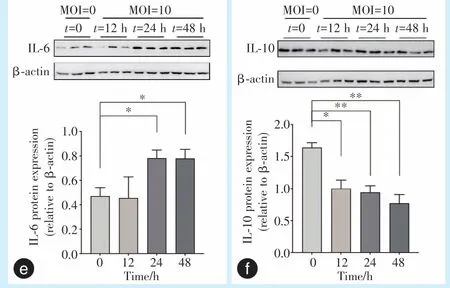
图3 感染P.g后Caco-2 细胞IL-6、IL-10 mRNA 及蛋白表达Figure 3 IL-6 and IL-10 mRNA and protein expression in Caco-2 cells infected withP.g
2.4P.g感染Caco-2 细胞后JAK2、STAT3 表达
qRT-PCR 实验结果显示,刺激时间为24 h 时,与对照组(MOI=0)相比,随着MOI 从1 增加到10 再到25,P.g刺激后的Caco-2 细胞相比对照组JAK2和STAT3 的mRNA 表达水平先增高后降低,并在MOI 为10 时达到最高(P<0.05);此后随着MOI 的增大,P.g对细胞增殖呈现抑制状态,JAK2 和STAT3 mRNA 水平下降(图4a、4b)。
MOI 为10 的情况下,随着刺激时间的增加,JAK2 和STAT3 mRNA 水平在24 h 达到最高后下降,但水平仍然高于对照组(图4c、4d)。
Western blot 实验结果显示,与对照组(MOI=0)相比,当MOI 为10 时,随着刺激时间的增加,Caco-2 细胞p-JAK2、p-STAT3 蛋白表达量逐渐增高,并在刺激时间为24 h 时达到最高;48 h 后p-JAK2、p-STAT3 蛋白表达量开始降低,但仍高于对照组(图4e、4f)。

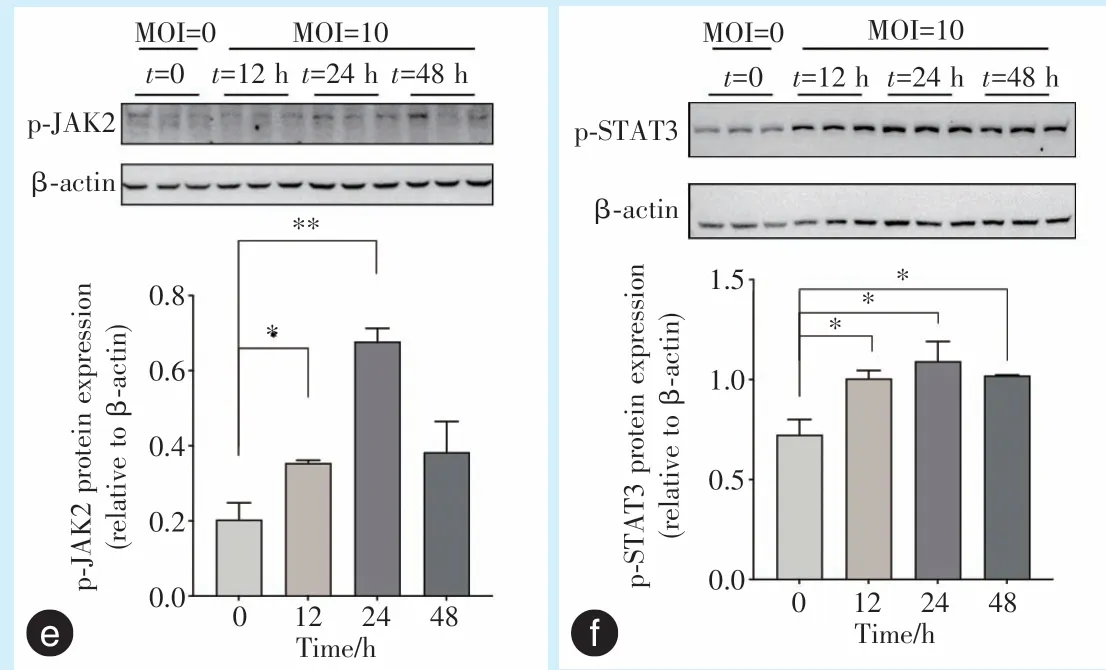
图4 感染P.g的Caco-2 细胞JAK2、STAT3 mRNA 及p-JAK2、p-STAT3 蛋白表达Figure 4 JAK2 and STAT3 mRNA and p-JAK2 and p-STAT3 protein expression in Caco-2 cells infected withP.g
2.5 JAK2 抑制剂AZ960 对P.g感染Caco-2 细胞的影响
添加JAK2 抑制剂AZ960 后,MOI 为10 时,与未添加抑制剂时相比,P.g对Caco-2 细胞增殖促进作用减弱,差异具有统计学意义(图5)(24 h,P<0.01;48 h,P<0.05)。
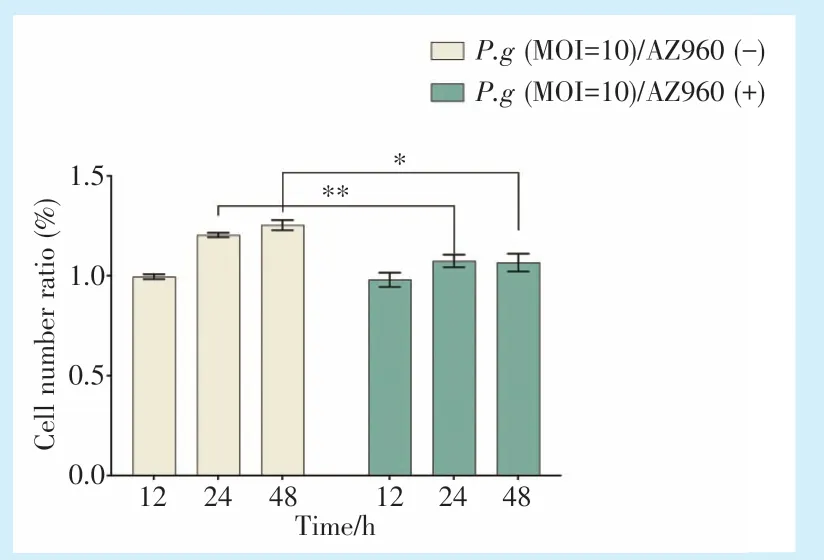
图5 添加JAK2 抑制剂AZ960 后P.g感染Caco-2 细胞增殖情况Figure 5 Cell proliferation of Caco-2 cells infected withP.gafter the addition of the JAK2 inhibitor AZ960
使用JAK2 抑制剂AZ960 后,MOI 为10 时,P.g处理Caco-2的细胞24 h后,STAT3 mRNA和p-STAT3蛋白表达水平表达均显著低于未添加抑制剂的P.g处理组(阳性对照组);JAK2 mRNA 和p-JAK2蛋白表达水平均显著低于未添加抑制剂的P.g处理组(图6)。
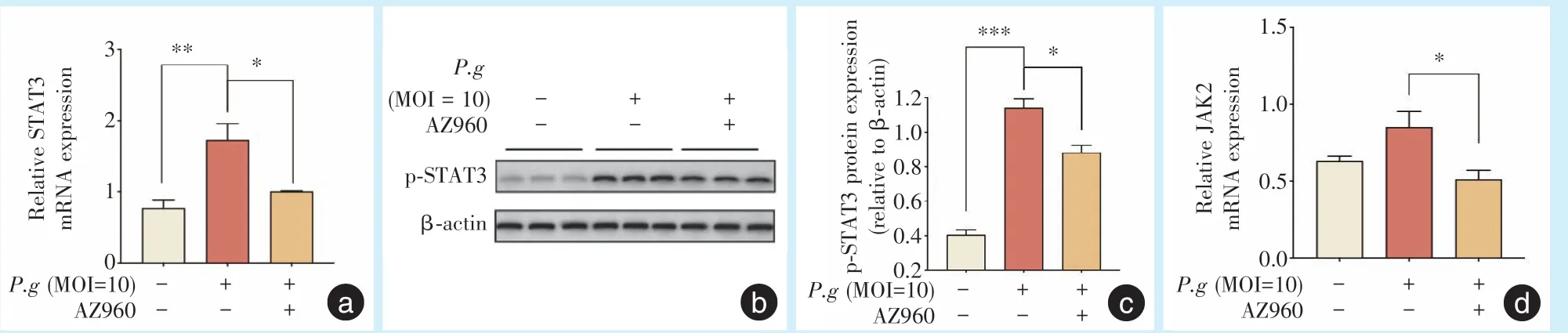
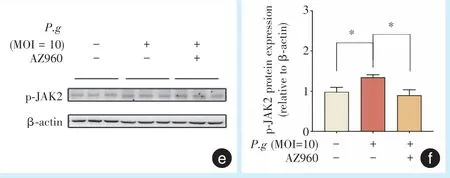
图6 添加JAK2 抑制剂AZ960,感染P.g的Caco-2 细胞STAT3、JAK2 mRNA 及p-STAT3 和p-JAK2 蛋白表达Figure 6 STAT3,JAK2 mRNA and p-STAT3,p-JAK2 protein expression in Caco-2 cells infected withP.gafter the addition of the JAK2 inhibitor AZ960
3 讨 论
牙周病是多种系统性疾病的危险因素,然而,牙周病和消化道肿瘤的关系尚不明确,两者可能存在潜在的相关性。口腔微生物群是最复杂的人类微生物群之一,仅次于胃肠道的微生物群,含有与人体相关的26%的细菌种类[10]。此外,有临床试验结果表明,绝大多数口腔微生物物种可以从口腔传播到大肠[11]。口腔细菌与许多口腔疾病和口腔以外的系统性疾病密切相关。作为牙周病的主要病原体,P.g被证实与全身多种疾病关系密切,如口腔鳞状细胞癌、食道鳞状细胞癌、类风湿性关节炎和心血管疾病[12-16]。同时有研究证明,P.g与结肠癌的发生发展也密切相关[17]。P.g被报道在结直肠癌患者的粪便样品及组织样本中的阳性率均高于正常组织,且P.g丰度高的患者相对于P.g丰度低的患者的总生存期和5 年无复发生存期较短[4]。
目前已有研究表明,P.g对不同的细胞表现出不同的刺激特性,对牙龈上皮细胞、血管平滑肌细胞、牙周膜成纤维细胞等表现出促进增殖,但对于软骨细胞则促进其凋亡[18]。在本研究中,P.g可以持续促进结肠癌Caco-2 细胞的增殖,这可能与P.g改变了Caco-2 细胞内部增殖相关蛋白的表达有关。P.g具有多种毒力因子,包括荚膜多糖、脂多糖、菌毛、胶原酶、牙龈蛋白酶等[19],当细菌数量过多、毒力过强或机体免疫力低下时,部分细菌可以通过粘附、入侵组织和细胞逃避免疫系统的清除,并通过影响周围细胞为自己营造适宜生存和繁殖的环境,其中就包括了通过调节细胞凋亡和增殖以及各种炎性因子的分泌[20]。
不良刺激造成的慢性炎症与细胞的恶性增殖行为密切相关,其中几种常见的炎症因子如IL-6、IL-10 等,已经被证明在癌症的发生发展中发挥重要作用[7]。IL-6 是促进肿瘤发生的重要自分泌生长因子[21],组织损伤或感染都会增加肿瘤细胞IL-6的分泌。据报道,在结肠癌肿瘤组织和患者的血清中,IL-6 的表达都有所增加,IL-6 的表达与肿瘤的分期、大小、转移和结肠癌患者的生存率密切相关[9]。IL-10 是一种广泛表达的抗炎细胞因子,对肿瘤的发展有复杂的影响,有研究认为IL-10 可以通过调节细胞凋亡以及抑制血管生成从而抑制肿瘤的进展[22]。IL-10 的缺乏与炎症诱导的结直肠癌的发展有关。
STAT3 与恶性肿瘤增殖密切相关,它控制了有关细胞增殖、细胞凋亡和细胞分化的多种基因[23],STAT3 活性在包括结肠癌在内的各种肿瘤中显著升高[24],结肠癌的恶性程度和增殖活性与STAT3的活性密切相关[25]。P.g可以通过STAT3 基因调控多种肿瘤细胞和非肿瘤细胞的增殖和凋亡。Moffatt 等[26]的研究表明,P.g能通过激活STAT3 抑制牙龈上皮细胞的内在凋亡途径,从而有助于P.g在附着和侵入牙龈上皮细胞后的自身存活。Binder 等[27]发现,持续放大的STAT3 磷酸化信号是P.g促进口腔鳞状细胞癌的作用基础。JAK2 激酶是激活STAT3 重要的上游基因,JAK2 的磷酸化被激活后,可以进一步磷酸化下游STAT3,进而调控多种核内基因的转录。研究表明JAK2-STAT3 途径在结肠癌细胞的过度增殖和侵袭过程中发挥重要作用[9]。炎性因子IL-6 也是JAK2-STAT3 信号传导的主要激活剂之一,同时STAT3 促进IL-6 基因表达的能力导致自分泌前馈循环,接着放大细胞因子的表达,从而促进肿瘤的生长、转移和耐药,与癌症的发展密切相关[6]。
本研究证明,与对照组相比,P.g可以显著上调Caco-2 细胞中促炎因子IL-6 的表达,同时抑制抑炎因子IL-10 的表达,这表明P.g可以使Caco-2 形成促炎的肿瘤微环境,从而促进Caco-2 细胞增殖与发展。同时,相较于对照组,P.g可显著上调Caco-2 细胞内JAK2、STAT3 的mRNA 和p-JAK2、p-STAT3 蛋白表达。反向验证实验表明,在使用JAK2 抑制剂AZ960 处理Caco-2 细胞后,其下游产物STAT3 的mRNA 和p-STAT3 蛋白表达水平较对照组均受到明显抑制。且对Caco-2 细胞添加JAK2抑制剂AZ960 后,P.g对Caco-2 细胞的增殖促进效果减弱。
综上,本研究推测P.g可以通过改变Caco-2细胞炎症因子的表达,为肿瘤细胞营造适宜增殖的炎性环境,并且可能通过激活JAK2-STAT3 通路促进Caco-2 细胞的增殖。本研究结果进一步为牙周病、牙周细菌与结肠癌之间的联系提供依据,并为预防和治疗结肠癌的发展提供了新的思路。
【Author contributions】Zhang RT peformed the experiments, analyzed the data, and wrote the article.Liu XC assisted in experiments performing.Ye W revised the article.All authors read and approved the final manuscript as submitted.
