不同发酵时期藏茶对体内抗氧化能力和肠道免疫功能的影响
2023-05-20兰朝华廖大龙李林蔓向元琳
王 凝,兰朝华,廖大龙,李林蔓,向元琳,祝 辉
(四川轻化工大学生物工程学院,四川宜宾 644000)
0 引言
藏茶属于黑茶的一种,距今已有上千年的历史[1]。藏茶的历史可以追溯到唐宋茶马交易的中早期,因产自雅安,唐宋以来畅销藏区而得名[2]。我国的黑茶发源于四川雅安,是我国藏族同胞的主要饮品之一,还被称为藏族同胞的生命之茶[3]。研究表明,藏茶中含有许多对人体有益的物质,具有降血压、降血脂、降胆固醇和血糖、提高机体免疫能力、抗辐射、抗氧化、调节消化酶活性、润肠通便、减肥降脂等保健功能[4-6]。
藏茶是经杀青、揉捻、渥堆、干燥、精制、拼配、蒸压等特定工艺制成的黑茶类产品[7]。渥堆工艺是藏茶加工过程中的重要工序[8],藏茶发酵是经过独特的多次渥堆、反复揉捻等制作工艺,促进茶叶多酚类物质充分氧化、聚合,使藏茶风味独特,成为西藏和周边藏民聚集区的主要茶叶饮品。渥堆是藏茶品质形成中的关键工序,渥堆过程中微生物大量繁殖并分泌胞外酶,通过代谢途径改变茶叶中成分的组成,从而形成藏茶的特有品质[9]。藏茶作为一种后发酵茶在经过漫长的渥堆发酵后,产生了丰富的微生物类群,不同微生物在藏茶发酵过程中的动态变化对藏茶的品质起到重要的作用[10],但目前关于藏茶渥堆发酵过程中生物活性变化还有待进一步探究。
选用发酵前、中、后期的藏茶进行小鼠灌胃试验,探究其对抗氧化能力和对肠道功能的影响。通过小鼠肝脏组织测定T-AOC、SOD 活性,以及MDA含量及相关抗氧化基因等,检测不同时期藏茶抗氧化能力的影响。通过测定小鼠肠道免疫相关基因和肠道益生菌的菌群数量来比较不同发酵时期藏茶对于小鼠免疫功能的影响,进而探究藏茶制作过程中生物学活性变化规律,为藏茶的开发与利用提供理论依据。
1 材料与方法
1.1 藏茶水提物的制备
试验所选用藏茶为3 个不同发酵时期的水提物,即发酵前期为藏茶生产原料、发酵中期为渥堆发酵20 d、发酵后期为成品藏茶,以上藏茶均由吉祥藏茶公司提供。
取3 g 不同发酵时期的藏茶,采用三煎合一的方法熬煮30 min,将茶水与茶叶混合物离心,取上层清液并定容至150 mL,置于4 ℃冰箱中保存。
1.2 试验动物分组及处理
将24 只C57BL/6J(雌性,18~22 g) 小鼠随机分为4 组,分别为空白组(C)、藏茶发酵前(Q)组、藏茶发酵中(Z) 组、藏茶发酵后(H) 组。Q、Z、H 组中每只小鼠每天灌胃1 次0.14 mL 的不同时期的藏茶水提物,C 组用同样体积的ddH2O 替代,持续灌胃28 d。每7 d 称量每个组每只小鼠的体重,并记录。28 d 后对小鼠进行处死,采集小鼠肝脏组织、结肠组织、结肠内容物和对小鼠眼球采血,眼球取出来的血用离心机分离血清并使用EP 管进行收集,置于-80 ℃的冻藏室中保存备用。
1.3 小鼠肝脏抗氧化酶活性的测定
测定小鼠肝脏组织中的T-AOC、SOD 酶活性、MAD 含量,分析不同发酵程度的藏茶对小鼠体内抗氧化能力的影响。
1.3.1 T-AOC 活性检测
参考北京索莱宝科技有限公司《总抗氧化能力(T-AOC) 检测试剂盒说明书》,以FeSO4标准溶液制作标准曲线为Y=10.829X+0.014 6(R2=0.999 5),各组水提物与反应液反应后,于波长593 nm 处测定吸光值,将ΔA'=A测定-A空白代入标准曲线,求得X。测得总抗氧化能力(U/g) =X×V反总÷(V样÷V样总×W) (其中V样总:加入提取液体积,1 mL;V反总:反应总体积,1.02 mL;V样:反应中样品体积,0.03 mL;W:样品质量,g),每个样品设置3 个平行对照。
1.3.2 SOD 活性检测
参照北京索莱宝科技有限公司《超氧化物歧化酶检测试剂盒说明书》于560 nm 处测其吸光度,并以蒸馏水调零,按照ΔA测定=A测定-A空白、ΔA空白=A空1-A空2计算出△A测定和△A空白,计算抑制百分率=(ΔA空白-ΔA测定) ÷ΔA空白×100%,通过将抑制百分率带入公式并计算SOD 活性:SOD 活性(U/mL) =[抑制百分率÷(1- 抑制百分率)×V反总]÷V样×样本稀释度,(其中V样总:加入提取液体积,1 mL;V反总:反应体系总体积,1.026 mL;V样:加入反应体系中样品的体积,0.09 mL;W:样品质量,g),每个样品设置3 个平行对照。
1.3.3 MDA 含量检测
参照北京索莱宝科技有限公司《丙二醛含量检测试剂盒说明书》,用酶标仪于波长450,532,600 nm 处进行测定样本吸光度,分别计算出:ΔA450=ΔA450测定-ΔA450空白、ΔA532=ΔA532测定-ΔA532空白、ΔA600=ΔA600测定-ΔA600空白、MAD=[(12.9×(ΔA532-ΔA600)-2.58×ΔA450)×V总]÷W×V样本÷V提取(其中V提取:加入提取液体积,1 mL;V总:反应体系总体积,0.5 mL;V样本:加入反应体系中样品的体积,0.1 mL;W:样品质量,g),每个样品设置3 个平行对照。
1.4 小鼠肝脏和结肠组织的qPCR 检测
参照南京唯赞生物科技有限公司《Total RNA 提取试剂盒说明书》取10~20 mg 的肝脏、结肠组织,提取RNA,再参照M-MLV 4 试剂盒进行反转录,将RNA 逆转录为cDNA。以肝脏、结肠组织cDNA为模板,进行qPCR 扩增,以5'-AGGTCGGTGTCAACGGATTTG-3'、5 ' -GGGGTCGTTGATGGCAACA -3'为内参基因进行PCR 的扩增。
利用PCR 引物组合进行半定量法qPCR 扩增,分别测定肝脏(Cu/Zn-SOD、GSH-Px、Mn-SOD) 基因和结肠(COX-2、iNOS、NF-κB) 基因相对表达量,使用2-ΔΔCt方法计算mRNA 的相对表达水平。
肝脏、结肠组织qPCR 扩增引物见表1。
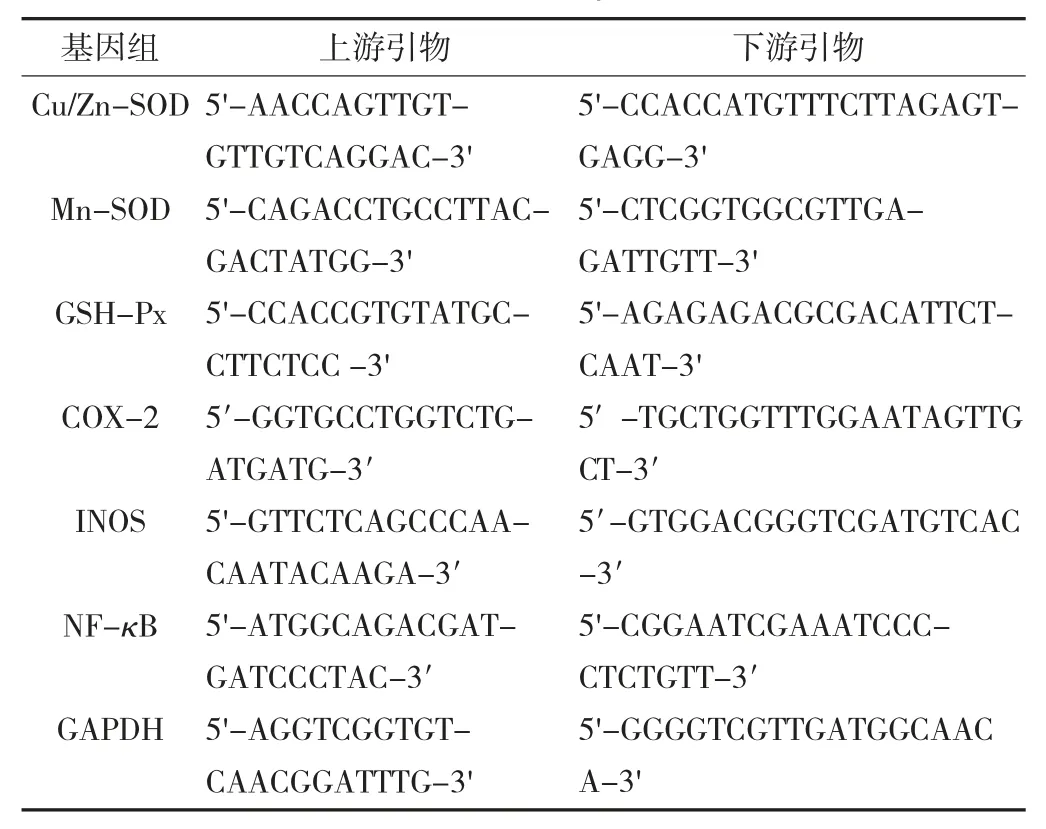
表1 肝脏、结肠组织qPCR 扩增引物
1.5 血清检测
对小鼠血清样本进行1L-1β 的检测,参照《Mouse IL-1β ELISA KIT 试剂盒》,标准曲线Y=0.001 7X-0.038 3(R2=0.998 7),采用酶标仪,以OD450nm-OD630nm的差值作为测量值。然后再用每个标准品和标本的OD 测量值减去0 孔的OD 测量值作为标准品和样品的平均OD 值,样品和标准曲线对比换算就能得出相应的浓度。
1.6 肠道益生菌含量测定
取结肠内容物样品0.1~0.5 g,参照《OMEGA 粪便基因组DNA 提取试剂盒说明书》(由广州飞扬生物工程有限公司提取)提取DNA,将得到的DNA 溶液取1 μL 作为模板进行qPCR 扩增,使用乳酸菌、双歧杆菌特定引物,检测各组小鼠肠道内容物中乳酸、双歧杆菌的相对含量。
乳酸菌和双歧杆菌特定引物见表2。

表2 乳酸菌和双歧杆菌特定引物
1.7 数据处理
结果数据以X±SD表示(n=3),采用SPSS22.0统软数据分析,Graphpad Prism 进行作图,显著检验(p<0.05=采用Duncan 极差法)。
2 结果与分析
2.1 不同时期发酵藏茶对小鼠体重的影响
小鼠体重变化见图1。
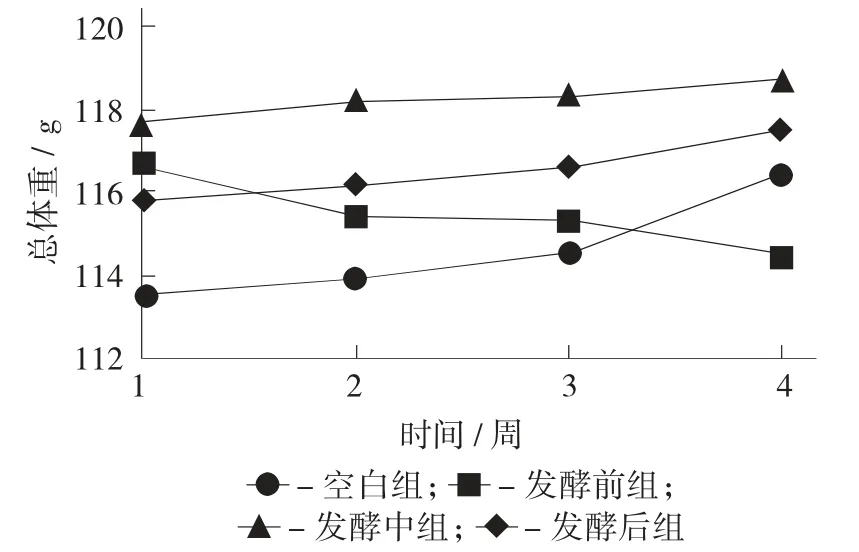
图1 小鼠体重变化
由图1 可知,持续灌胃28 d 后,发现空白组小鼠体重缓慢升高,灌胃发酵前期藏茶水提物的小鼠体重呈现下降趋势,体重下降率为1.77%;而发酵中期与发酵后期趋势相似,最终体重均呈上升趋势,体重上升率分别为0.87%和1.44%。
2.2 小鼠的抗氧化能力检测
2.2.1 小鼠肝脏组织T-AOC
T-AOC 是反映检测对象中各种抗氧化物质和抗氧化酶能力的一个理化指标。总抗氧化能力值的大小可以用来衡量抗氧化能力的强弱。
小鼠肝脏组织T-AOC(a)、SOD 活性(b)、MAD 含量(c) 的测定见图2。

图2 小鼠肝脏组织T-AOC(a)、SOD 活性(b)、MAD 含量(c) 的测定
由图2(a) 可知,不同发酵时期的藏茶对于总抗氧化能力都有作用,Q、Z、H 组总抗氧化能力均强于C 组,发酵前期的藏茶总抗氧化能力为空白组的1.27 倍;Z 组与H 组的总抗氧化能力分别为1.22 倍与1.34 倍,其中H 组抗氧化能力最强。
2.2.2 小鼠肝脏组织SOD
自由基清除剂是一类能够清除人体中过多自由基的活性物质,SOD 是其中较为重要的一种。SOD活性越强,清除自由基的能力就越强。
由图2(b) 可知,灌胃藏茶的小鼠体内的SOD活性均高于空白组。Z 组、H 组的酶活性均高于Q组,其中Z 组的SOD 活性值为10.08 U/mL,H 组的SOD 活性值为9.80 U/mL。
2.2.3 小鼠体内MDA 含量
由图2(c) 可知,灌胃藏茶的试验组的MDA 含量均低于C 组,且Q、Z、H 组的MDA 含量为Q>Z>H。MDA 含量越低,说明抗氧化能力越强。其中发酵后期的MDA 含量最低,为13.07 mol/g。
2.3 小鼠肝脏组织的抗氧化基因qPCR 检测
小鼠肝脏组织抗氧化基因Cu/Zn-SOD(a)、GSH-Px(b)、Mn-SOD(c) 的表达见图3。

图3 小鼠肝脏组织抗氧化基因Cu/Zn-SOD(a)、GSH-Px(b)、Mn-SOD(c) 的表达
由图3 可知,Cu/Zn-SOD、GSH-Px、Mn-SOD的表达水平试验组均明显高于空白组,Cu/Zn-SOD发酵前期是空白组的4.18 倍、发酵中期是空白组的2.88 倍、发酵后期是空白组的3.04 倍。GSH-Px 的表达水平发酵前期相较于空白组上调了2.33 倍,发酵中期相较于空白组上调了4.12 倍,发酵后期相较于空白组上调了3.19 倍。Mn-SOD 的表达水平发酵前期是空白组的2.05 倍,发酵中期是空白组的2.52 倍、发酵后期是空白组的1.82 倍。
2.4 小鼠结肠炎症相关基因qPCR
小鼠结肠免疫基因COX-2(a)、iNOS(b)、NF-κB(c) 的表达见图4。
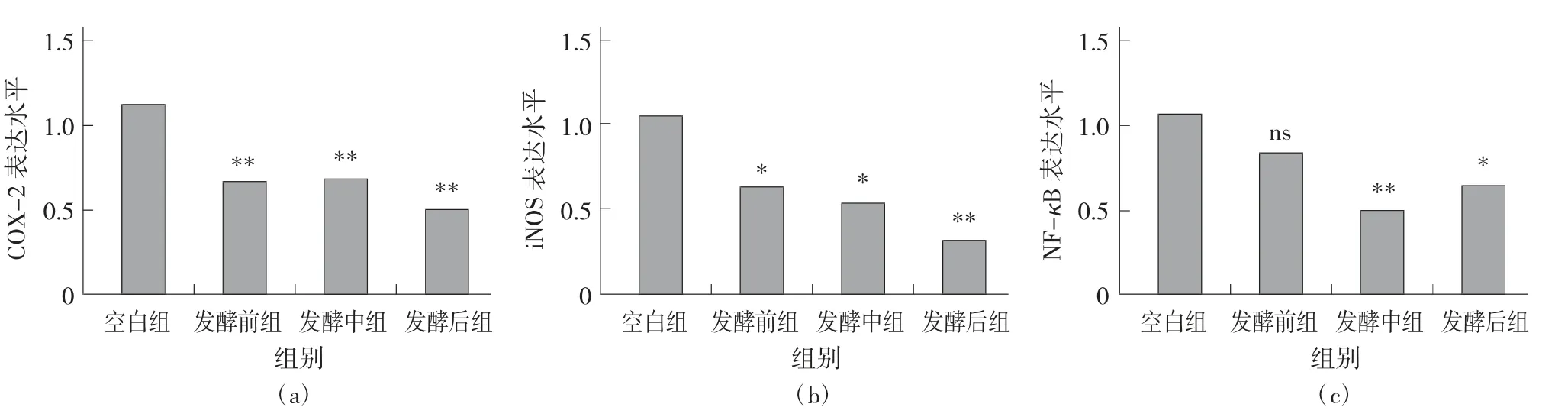
图4 小鼠结肠免疫基因COX-2(a)、iNOS(b)、NF-κB(c) 的表达
由图4 可知,测定的COX-2、iNOS、NF-κB 3类基因中,正常情况下不表达,维持浓度相对较低。COX-2 在人体中和炎症反应相关,当人体细胞受到炎症刺激时,COX-2 的表达水平快速上升,导致炎症反应和组织损伤;iNOS 则是当细胞受外界炎症等刺激后表达水平提高,取协助巨噬细胞加强免疫功能;NF-κB 则是在细胞炎症反应、免疫应答中起关键作用。研究发现,藏茶Q、Z、H 3 组相对空白组COX-2、iNOS、NF-κB 这3 类炎症基因的表达水平显著下降,故试验的3 组小鼠的免疫能力强于空白组,而在Q、Z、H 这3 组中,3 类基因的表达水平呈现随发酵时间越长,其表达水平越低的趋势,即随着发酵时间增长,藏茶对免疫功能的提升就越好,这说明COX-2、iNOS、NF-κB 3 类基因可能有潜在的降低炎症的作用。
2.5 小鼠血清1L-1β 测定
小鼠血清1L-1β 浓度的测定见图5。
图5 小鼠血清1L-1β 含量的测定
由图5 可知,相对空白组,Z 组、H 组的1L-1β的质量浓度都下降,数值分别为54.294 pg/mL 和51.353 pg/mL,且H 组相较于Z 组下降得更多。而Q组相对于C 组1L-1β 的质量浓度有上升趋势。即藏茶随着发酵时间的增加小鼠体内的1L-1β 质量浓度总体呈现减小的趋势。
2.6 小鼠结肠内容物有益菌基因qPCR
小鼠肠道乳酸菌、双歧杆菌增长水平分析见图6。

图6 小鼠肠道乳酸菌、双歧杆菌增长水平分析
研究发现,不同发酵程度藏茶对肠道益生菌有着显著的上调作用,相较于C 组,肠道益生菌至少有2 倍以上的增长,且发酵程度越深对于益生菌增长的促进作用就越大,其中发酵后期的促进作用最为显著,发酵后期的藏茶至少都是6 倍的增长促进。由图6 可知,与C 组相比较,发酵后期的乳酸菌增长了8 倍多,双歧杆菌增长接近7 倍左右,说明发酵后期乳酸菌的促进作用大于双歧杆菌;发酵中期对于2 种益生菌的促进作用都是3 倍左右;而发酵前期则对双歧杆菌的促进作用大于乳酸菌,双歧杆菌较C 组增加4 倍左右,乳酸菌则是2 倍左右。结果表明,H 组的藏茶乳酸菌和双歧杆菌数量相对Q组、Z 组增长得最为明显,特别是乳酸菌增长的倍数最为显著。
3 讨论
探究不同发酵时期藏茶对小鼠机体抗氧化能力和肠道益生菌及免疫功能影响,有利于进一步开发藏茶的保健功能和市场价值。藏茶中茶多糖、茶多酚、茶褐素等物质都具有较好的抗氧化能。Zheng Q等人[11]研究也发现从雅安藏茶中提取的藏茶多糖和茶多酚均具有较强的自由基清除能力,因而藏茶及其提取物有较强的抗氧化活性。王凝等人[12]对不同陈化时间藏茶的抗氧化活性进行评估,发现陈化时间越长,藏茶的抗氧化性越弱。试验是选用一种藏茶的3个不同发酵时期对小鼠机体内抗氧化能力的影响进行探究。发现发酵中、后期的藏茶对小鼠的机体内抗氧化能力影响较大,抗氧化能力在总体的趋势上还是随着发酵时间的延长,这可能是受到藏茶在渥堆发酵过程中其具有不同作用的活性物质含量随着时间发生相应变化的影响[13],藏茶中的物质会发生不断的转化,随着发酵时间的延长,藏茶内的物质转化为小分子并且有利于机体吸收,从而表现出对体内抗氧化能力的不同影响。也可能是藏茶发酵过程中会产生许多氧化态多酚,这些物质可能也对机体有抗氧化能力。研究发现,随着发酵时间的延长T-AOC、SOD 酶活性相较于C 组都有显著的延长;MDA 含量具有显著下降,说明随着发酵时间的增加藏茶的抗氧化能力增强,尤其是发酵后期的抗氧化能力增强得最为显著。
双歧杆菌和乳酸菌是常见的肠道益生菌,在维持肠道菌群的平衡和稳定方面具有重要的影响,肠道菌群在人体的代谢、营养、保护、免疫调节等方面有着重要且不可替代的功能。双歧杆菌具有明显的抗氧化作用,能增加血液中SOD 的含量及其生物活性。人体新陈代谢过程中产生的有害物质可以通过益生菌合成对人体有益的微量元素、氨基酸、超氧化歧化酶等多种抗氧化物质[14]。Wang N 等人[15]证实藏茶提取物(TTE) 可以调节溃疡性结肠炎(UC)的免疫系统,减少炎症。肠道益生菌不仅能够激活内源性细菌的代谢,使得肠道的非免疫性防护屏障得到提升;它还可以调节肠道IgA 反应和消除肠道炎症反应,提升肠道的免疫防御屏障功能,益生菌可以通过调节机体非特异性和特异性免疫反应,增强机体免疫力[16]。Liu Z 等人[17]使用结肠炎模型小鼠发现六大茶类对肠道益生菌都有一定的促进作用。李丹[18]的研究表明,经过渥堆的普洱熟茶对乳酸菌的增长的促进作用效果不如茯砖茶,对于双歧杆菌的促进作用不如普洱生茶。这些种类的茶叶的作用和藏茶相比,藏茶对于这乳酸菌和双歧杆菌的作用更好,且渥堆发酵时间越长,对于有益菌的提升就越好。通过测量小鼠肠道中益生菌的基因表达水平发现,藏茶对有益菌具有很好的促进作用。通过对小鼠结肠内容物进行半定量qPCR 分析,发现不同发酵时期藏茶对小鼠肠道乳酸菌和双歧杆菌均有显著上调作用,特别是发酵后期对乳酸菌和双歧杆菌促进增长作用更为显著,说明藏茶可以通过上调肠道益生菌,起到保健功能。
免疫功能是人体抵御外界致病菌、微小有害物等对人体有危害作用的物质的重要防线,同时也是清除人体内环境产生的损伤细胞、癌细胞等对人体不利的物质的手段。李海珊等人[19]研究发现,茶多糖可增强小鼠非特异性免疫调节功能;程利增等人[20]发现,调节机体免疫是天然多糖最显著的生物学功能之一,是多糖抗肿瘤效应的关键基础。通过对小鼠的28 d 内的结肠组织免疫基因表达水平变化、血清中1L-1β 含量等指标的测量,发现不同发酵时期的藏茶对于小鼠的免疫功能都有影响,其中发酵前、中、后3 个时期总体上都提升了小鼠的免疫功能,藏茶发酵前的1L-1β 的含量最高。藏茶前、中、后3 组相对空白组COX-2、iNOS、NF-κB 这3 类基因的表达水平明显下降,故Q、Z、H 组小鼠的免疫能力强于C 组,而在Q、Z、H 这3 组中,3 类基因的表达水平呈现随发酵时间越长,其表达水平越低的趋势,即随着发酵时间增长,藏茶对免疫功能的提升越好。在免疫基因表达时,对于NF-κB 基因而言发酵中期的藏茶对小鼠的作用效果最显著,这可能与藏茶渥堆发酵过程中相关活性物质的变化有关。在发酵过程中茶多酚、儿茶素下降,茶褐素增加[21]这一动态过程使得发酵中期的藏茶对小鼠的NF-κB 的表达水平作用最显著。
4 结论
对小鼠体内抗氧化能力、免疫能力以及对肠道益生菌的影响进行了测定。研究发现,不同时期藏茶对抗氧化能力都均有显著的提高效果,但其中发酵后期对总抗氧化能力有着明显的增强效果;此外,SOD 酶活性发酵中期和后期都显著提高;可以说MDA 含量在藏茶发酵后期下降的趋势最显著,表明发酵后期的藏茶中对抗氧化能力有效的物质含量最多。随着发酵时间的延长,对小鼠的免疫功能增强作用也更好,这可能是受到藏茶在渥堆发酵过程中其具有不同作用的活性物质含量随着时间发生相应变化的影响。值得关注的是,藏茶对于肠道中双歧杆菌和乳酸菌的含量有着显著的上调作用,且渥堆发酵的时间越长,对于有益菌的提升就越好。探究了不同发酵时期藏茶的保健功能,为藏茶的进一步开发与利用提供了理论依据。
