高效液相色谱法测定赶黄草中没食子酸在不同冲泡条件下的溶出量
2023-05-19肖玉梅吴源益
◎ 肖玉梅,刘 恬,吴源益,杨 艳,杨 懿
(西南医科大学 公共卫生学院,四川 泸州 646000)
赶黄草学名为扯根菜,是虎耳草科扯根菜属植物,扯根菜的嫩芽部分也可作为蔬菜食用[1]。其主要分布于东北、华北、华南、西南等地,是苗族民间用于预防治疗肝病的常用中草药,被誉为“神仙草”[2]。民间以全草入药,性甘、平,归肝经、肾经,除湿利水,清热解毒,祛瘀止痛,主治黄疸、水肿、经闭、跌打损伤等。以其为原料的单方制剂在临床中多用于治疗慢性乙肝、急性病毒性肝炎等疾病[3-5],在治疗、保护肝损伤等方面也有较多研究报道[6-9]。2020 年6 月2 日,国家卫生健康委员会发布关于新食品原料的国家公告及解读[10],正式批准赶黄草的茎和叶为新食品原料,这为进一步开发利用赶黄草提供了契机。赶黄草中的主要活性成分为有机酸类和黄酮类等,其中稳定存在的有机酸类成分为没食子酸[2,11]。没食子酸又名五倍子酸、棓酸,化学名称为3,4,5-三羟基苯甲酸(C7H605),为白色或淡黄色针状结晶或粉末,通常以一水合物的形式存在[12]。没食子酸具有多种生物活性,如抗菌[13]、抗病毒[14]、抗炎、清除自由基和预防心血管疾病[15-16]、抗氧化[17-18]、抗癌[19-20]、预防糖尿病[21-22]等,有着广阔的应用前景。因此,检测赶黄草中的没食子酸含量对于评估赶黄草品质具有重要意义。
已有研究者建立不同的分析方法检测赶黄草等样品中没食子酸含量。在样品提取方面,有研究[23]建立了回流法、超声法、冷浸法3 种方法提取赶黄草中的没食子酸,以没食子酸含量为指标,采用反相高效液相色谱法测定提取液中没食子酸的含量,分别比较回流法、超声法和冷浸法3 种提取方法对赶黄草中没食子酸的提取效果,结果表明,3 种提取方法的提取效率分别为1.98、1.67 和0.86 mg·g-1。在检测方面,THOMAS 等[24]建立了同时测定辣木乙醇和水叶提取物中没食子酸、槲皮素和芦丁的高效薄层色谱法。刘文等[25]建立了测定余甘子中没食子酸的反射锯齿薄层扫描法。薄层扫描法前处理要求低,可同时分析多个样品,但由于制板、点样、展开等操作的差异,稳定性较差。胡杨等[26]建立高效液相色谱法(High Performance Liquid Chromatography,HPLC)测定赶黄草及醇提物中没食子酸的含量。LI 等[27]采用高效液相色谱法测定茶酒中儿茶素和没食子酸的含量,结果表明茶酒中儿茶素和没食子酸含量较高。此外,发酵后茶汁的儿茶素和没食子酸含量会下降,其中,没食子酸含量下降13.56%。
高效液相色谱法具有选择性好、重现性好、灵敏度高等优点,是应用于没食子酸检测的最普遍方法,但需要对样品进行前处理,因检测没食子酸样品的时间较长,还需要优化前处理条件。SUN 等[28]建立了液相色谱-质谱法应用于大鼠口服山楂水提取物后的药代动力学研究。液相色谱-质谱联法灵敏度高,选择性强,不依赖峰与峰之间的分离度,信号采集时间短,为分析没食子酸提供了可靠方法,但对样品前处理的要求较高,检测成本高。申铜飞等[29]建立气相色谱-质谱联用法测定藏青果中没食子酸的含量。气相色谱-质谱法分离性能和检测性能高,分析时间相对较快,但检测结果会由于样品提取方法不同而导致没食子酸的分析结果受到影响。ZHAN 等[30]采用近红外光谱结合多元分析对芍药中没食子酸、儿茶素、白花素和芍药甙进行定量分析,考察对不同地区样品进行分类的可行性,开发并验证了一种新的高效液相色谱方法,以分析芍药中的没食子酸、儿茶素、白芍素和芍药甙作为参考。采用偏最小二乘法、主成分回归法和逐步多元线性回归法对回归模型进行标定。近红外光谱法对于样品中没食子酸的前处理简单、检测快速方便,可以作为半定量分析法用于大规模筛查。张泽宇等[31]建立测定地榆中没食子酸含量的高效毛细管电泳法。翟海云等[32]建立了测定没食子酸的毛细管电泳高频电导法。毛细管电泳法能够在短时间内测定没食子酸的含量,具有快速、高效的特点,但由于电渗会因样品组成而变化,因而该法重现性较差。综上,没食子酸的测定方法多种多样,各有优缺点,其中,高效液相色谱是最常用于检测没食子酸的方法[33-34],具有高效、灵敏、经济等优点。
赶黄草的主要食用方式为泡饮。研究表明,冲泡条件对茶叶中溶出物质的含量存在影响[35],例如茶多酚的含量。茶叶泡制的持续时间、泡茶所用水的温度和冲泡茶叶的频率次数会对茶汤中活性物质茶多酚的含量有直接影响,当延长洗茶的时间,茶多酚的溶出量会快速增加;当升高洗茶的温度,茶多酚的溶出量也会有不同程度的增加,用沸水泡茶会更利于茶多酚的溶出。因此,正确选择和把握科学的泡茶方法可以充分溶出茶多酚等茶叶中的有益成分,最大限度发挥茶叶本身的健康价值。已有研究测得赶黄草中没食子酸含量为0.213~13.990 mg·g-1[26,36-38],然而,目前尚无研究比较不同冲泡条件对赶黄草中没食子酸溶出量的影响。
综上,本研究拟建立测定赶黄草中没食子酸含量的高效液相色谱法,评估赶黄草中没食子酸在不同冲泡条件下的溶出量,为更好地开发赶黄草产品提供技术支持和数据支撑。
1 材料与方法
1.1 材料与设备
赶黄草购自泸州盛邦中药材研究有限公司。没食子酸标准品(HPLC ≥98%),购自四川省维克奇生物科技有限公司。乙腈、甲醇和磷酸(85%~90%)均为色谱纯,购自上海麦克林生化有限公司。实验室用超纯水由Milli-Q 净化系统制备(18 MΩ·cm,德国默克公司)。
安捷伦1260 高效液相色谱仪(安捷伦科技公司,德国沃尔德布隆),配有1260 Quat Pump VL、G7129A 1260 自动取样器和G7114A 1260 紫外检测器。试验中使用的其他仪器包括SPECTROstar Nano 高通量紫外分光光度计(广州伯齐生物科技有限公司)、(Toruńska 5, 26-600,波兰拉多姆)、5430R 离心机(Eppendorf AG, 22331,德国汉堡)、SB-800 DTD超声波清洗机(宁波森兹生物科技有限公司,中国宁波)、FCD-2000 Serials 恒温鼓风干燥箱(上海琅玕试验设备有限公司)。
1.2 试验方法
1.2.1 溶液配制
没食子酸标准溶液(1.00 mg·mL-1):称取一定量没食子酸标准品,溶解在甲醇中配制浓度为1.00 mg·mL-1的标准储备液,密封并储存于4 ℃冰箱。
1.2.2 样品处理
在方法建立阶段,参考王星月等[39]提取赶黄草中没食子酸的方法,分别称取10 mg 干燥的赶黄草花、茎和叶粉末至15 mL 离心管内,添加10 mL 50%甲醇水超声30 min,用0.45 μm 微孔滤膜过滤后进样测定。
为测定赶黄草中没食子酸在不同冲泡条件下的溶出量,参考茶叶的泡制条件[40],取赶黄草叶、茎和花各100 mg,分别用5 mL 不同温度的超纯水浸泡5~60 min,浸泡液经0.45 μm 滤膜过滤后进样测定。
1.2.3 高效液相色谱条件
色谱柱:ZORBAX SB-C18柱(4.6 mm×150 mm,5 µm)(安捷伦科技公司,美国);柱温:35 ℃;流动相:甲醇:乙腈:0.2%磷酸溶液(8:5:87,V:V);流速:0.9 mL·min-1;紫外检测波长:264 nm。
2 结果与分析
2.1 高效液相色谱条件优化
测定没食子酸所用HPLC 条件采用文献报道的方法[41],并对其进行优化。首先通过紫外分光光度计扫描10 μg·mL-1没食子酸标准溶液在220~1 000 nm 的紫外光谱,确定没食子酸的最大吸收波长为264 nm。为了分离干扰物,保证灵敏度并减少运行时间,对流动相、柱温和流速进行优化。对流动相的比例进行优化,流动相主要为甲醇、乙腈和0.2%磷酸,确定最佳流动相比例。当甲醇体积比为3%~10%时,没食子酸的保留时间缩短,峰形变差,和基质中干扰物间的分离度变差;在甲醇体积为8%时没食子酸的峰形最好,且与其他杂质的分离效果最好。在乙腈体积比为3%~7%时,没食子酸的保留时间缩短,峰形变差,与杂质的分离度变差;在乙腈体积为5%时,没食子酸的峰形最好,且与杂质的分离效果最好。最终采用流动相为甲醇:乙腈:0.2%磷酸溶液=8:5:87(V:V)。对25 ~40 ℃柱温进行优化,根据峰面积、保留时间和分离度确定最佳柱温温度,结果表明:在35 ℃下没食子酸的峰形最好,与杂质的分离度最高,故选择柱温35 ℃。对0.8 ~1.2 mL·min-1流速进行优化,结果表明:随着流速增快,保留时间缩短,但峰面积降低,在0.9 mL·min-1时,没食子酸的峰形和保留时间均较好。优化后的高效液相色谱条件如下:流动相:甲醇:乙腈:0.2%磷酸水溶液(8:5:87,V:V);柱温:35 ℃;流速:0.9 mL·min-1。
2.2 方法验证
2.2.1 线性范围、检出限与定量限
用超纯水稀释对照品溶液,配制浓度分别为0.005 μg·mL-1、0.010 μg·mL-1、0.020 μg·mL-1、0.050μg·mL-1、0.100 μg·mL-1、0.200 μg·mL-1、0.500μg·mL-1、1.00 μg·mL-1、2.00 μg·mL-1、5.00μg·mL-1和10.0 μg·mL-1的没食子酸标准溶液系列,进样10 μL 测定。以标准溶液浓度对峰面积进行线性回归,绘制标准曲线,得没食子酸在0.005~10μg·mL-1线性范围的回归方程:y = 31.439x - 0.754 3(r=0.999 8,n=11)。根据信噪比(S/N)=3 得出检出限(Limit of Detection,LOD)为3.77 ng·g-1,根据信噪比(S/N)=10 得出定量限(Limit of Quantif ication,LOQ)为12.441 ng·g-1。结果如表1 所示。
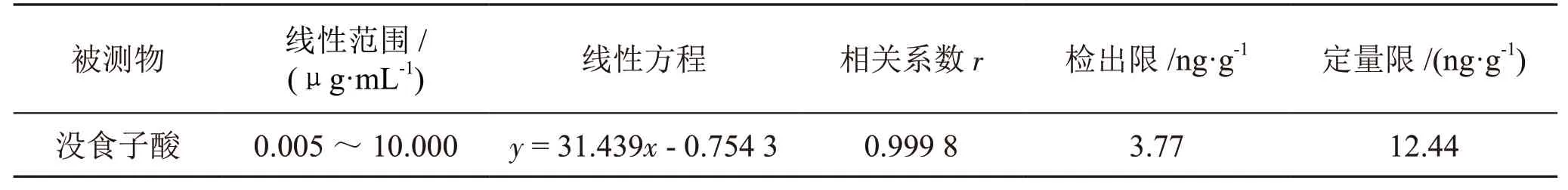
表1 没食子酸标准曲线方程、线性范围、相关系数及方法检出限表
2.2.2 方法准确度与精密度试验
分别向10 mg 赶黄草粉末中添加200 μg·g-1、440μg·g-1和850 μg·g-1没食子酸来进行加标回收试验,以评估方法的准确度与精密度。表2 为本方法的回收率和精密度(n=3)表,由表2 可知,没食子酸的加标回收率为93.2%~98.2%。通过在同一天分析3 个浓度的赶黄草加标样品来评估方法的日内精密度,并通过连续3 d 分析这3 个浓度的赶黄草加标样品来评估方法的日间精密度。结果表明:日内和日间相对标准偏差分别为3.07%~7.05%和2.27%~3.74%。图1为没食子酸标准溶液色谱图、赶黄草样品色谱图和赶黄草加标样品色谱图。
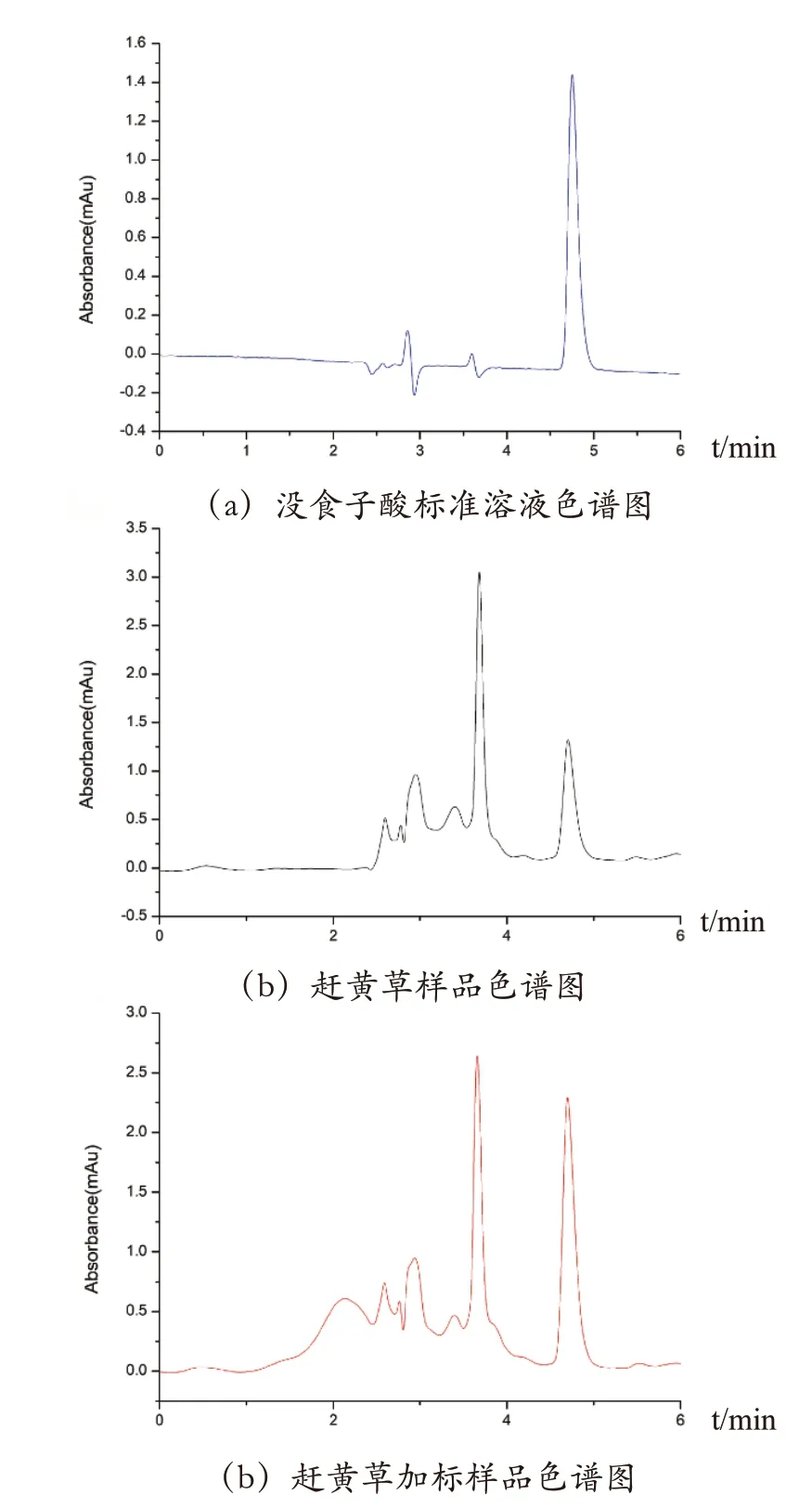
图1 没食子酸标准溶液色谱图、赶黄草样品色谱图和赶黄草加标样品色谱图
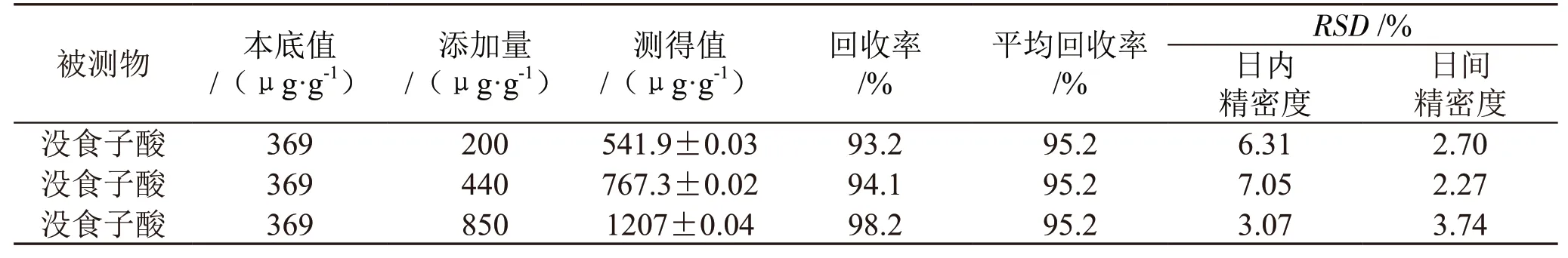
表2 本方法的回收率和精密度 (n=3)表
2.3 实际样品测定
为评估不同冲泡条件对赶黄草中没食子酸溶出量的影响,参考茶叶的泡制条件[40],取赶黄草叶、茎和花各100 mg,分别用5 mL 的25 ℃、80 ℃和90 ℃超纯水浸泡5 min、10 min、20 min、30 min 和60 min,浸泡液经0.45 μm 滤膜过滤后用所建高效液相色谱法检测。结果如图2 所示,经超纯水冲泡后,赶黄草的叶、茎和花中没食子酸溶出量分别为91 ~2 478μg·g-1,118 ~616 μg·g-1和116 ~787 μg·g-1。赶黄草的叶在80 ℃冲泡60 min 溶出的没食子酸含量最高;不同温度下没食子酸的溶出量均随着冲泡时间增加而增加;80 ℃冲泡后溶出的没食子酸量最高,可能是因为随着温度增加,没食子酸在水中的溶出效率升高,但部分溶出的没食子酸在90 ℃高温下发生分解。赶黄草的茎在90 ℃泡制20 min 所得没食子酸含量最高;在25 ℃和80 ℃超纯水中溶出的没食子酸含量随着时间的增加有增加趋势;在90 ℃超纯水中冲泡20 min时没食子酸溶出量达到最高,随后含量降低。赶黄草的花在90 ℃超纯水中冲泡60 min 后溶出的没食子酸含量最高,不同温度下没食子酸溶出量均随着时间增加而增加。赶黄草的叶、茎和花的冲泡结果均提示80℃冲泡后溶出的没食子酸量较高,25 ℃冲泡后溶出的没食子酸含量较低,而90 ℃冲泡后溶出的没食子酸含量不稳定。
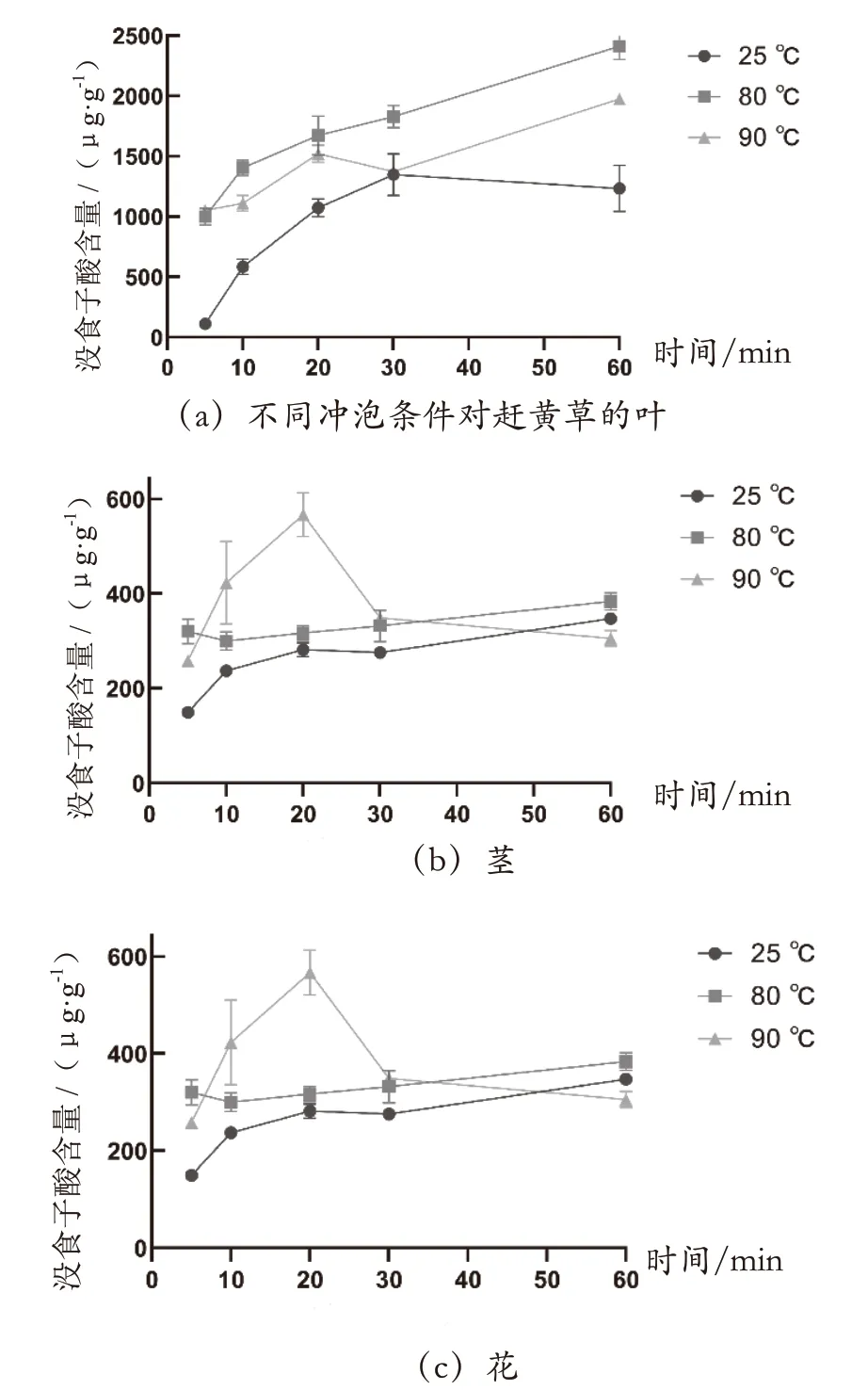
图2 不同冲泡条件对赶黄草的叶、茎和花中没食子酸溶出量的影响图
3 结论
本研究建立了测定赶黄草中没食子酸的高效液相色谱法,该法准确、可靠、稳定,可用于赶黄草的质量评估。此外,本文比较了赶黄草的叶、茎和花经25 ℃、80 ℃和90 ℃超纯水冲泡5~60 min 溶出的没食子酸含量,发现赶黄草的叶经超纯水在80 ℃冲泡60 min 后溶出没食子酸含量最高,该结果能够为企业更好地开发利用赶黄草提供技术依据,为消费者选择赶黄草产品和泡饮方式提供数据支撑。
