不同时期糖尿病视网膜病变患者血管内皮祖细胞及玻璃体内MMP-9、VEGF的变化及意义△
2023-05-18付馨余李君艾
付馨余 梅 希 李君艾 刘 畅
糖尿病视网膜病变(DR)是眼科常见的慢性眼病之一,是世界范围内工作年龄人群最主要的致盲疾病[1]。DR以视网膜早期缺血缺氧,后期引起病理性新生血管形成为主要特点,病程长,分期多,发生发展的机制复杂,至今尚未完全阐明,目前认为DR不仅是一种微血管病变,也牵涉到慢性炎症及神经免疫等诸多方面[2]。DR分为增生型DR(PDR)和非增生型DR(NPDR),PDR可形成大量病理性新生血管及纤维增生膜,进而引起玻璃体积血、视网膜脱离、新生血管性青光眼等一系列并发症。有效控制DR的发展,阻止病理性新生血管形成是目前研究DR机制迫在眉睫的关键节点。Takahashi等[3]研究表明,组织缺血状态下可激发血管内皮祖细胞(EPCs),参与角膜新生血管的生成;Toshinori等[4]研究表明,诱导脉络膜新生血管大鼠外周血中的EPCs明显增高,这提示我们EPCs可能在眼部新生血管相关疾病的发病机制中发挥一定作用。血管内皮生长因子(VEGF)在血管内皮细胞及EPCs、胶质细胞等均可低表达。既往研究表明,DR小鼠VEGF含量为对照组的4~10倍[5],这提示我们VEGF在PDR中发挥了作用。既往有研究报道基质金属蛋白酶(MMP-9)能控制血管内皮细胞异常迁移和增生,是血管内皮生成机制中的重要因子[6],为了探讨EPCs在DR发生发展中的作用,尤其是在以病理性新生血管为特征的PDR中是否发挥作用,我们进行了不同时期DR患者EPCs测定,同时研究了与EPCs密切相关的MMP-9及VEGF蛋白在PDR中的表达水平,以期探讨PDR的可能发展机制,为阻止PDR发生发展以及治疗手段提供新的思路及视角。
1 资料与方法
1.1 临床资料前瞻性研究。选择2020年1月至2021年12月在我院诊断为视网膜疾病不伴有糖尿病的患者35例(35眼)为空白对照组(A组);另选择同期在我院内分泌科诊断为II型糖尿病不伴有视网膜病变患者37例(37眼)为单纯对照组(B组);选择同期在我院诊断为DR的患者共78例(78眼),根据DR诊断标准分为NPDR 36例(C组)和PDR 42例(D组)。
1.2 纳入与排除标准(1)纳入标准:于我院诊断为单纯性视网膜脱离、玻璃体积血、特发性黄斑裂孔需行玻璃体切割手术,均不伴有II型糖尿病者纳入A组;根据2001年世界卫生组织修改的糖尿病最新诊断标准及2010年中华医学会眼科分会制定的最新DR诊断及分期标准,经临床症状体征、口服葡萄糖耐量试验(OGTT)、荧光素眼底血管造影(FFA)、OCT扫描等确诊为II型糖尿病不伴有视网膜疾病者纳入B组;II型糖尿病伴NPDR者纳入C组;II型糖尿病伴PDR者纳入D组。(2)排除标准:感染性疾病患者;既往有眼部手术史;有其他眼部疾病;合并全身重要器官疾病;精神或认知障碍;妊娠及哺乳期女性;3个月内服用过影响EPCs的药物,如非甾体类、皮质醇类等;半年内曾行视网膜光凝术或玻璃体内注药抗VEGF治疗。
本研究经医院伦理委员会审核通过,患者及家属均知情并签署知情同意书,玻璃体切割术前所有患者均签署手术同意书,并同意将玻璃体用于本次研究。
1.3 方法
1.3.1 收集血液标本晨起空腹状态下抽取四组患者肘静脉血3 mL,加入乙二胺四乙酸抗凝剂充分摇匀,采用密度梯度离心法提取外周血单个核细胞[7]。具体操作如下:室温下离心机(15 000 r·min-1)离心20 min分离细胞,吸取中间白膜层,PBS反复洗涤、吹打、混匀、再次室温下重复离心,取100 μL分离洗涤好的核细胞,加入CD34-FITC和CD133-PE抗体,室温下避光孵育20 min,再次PBS洗涤2次,加入5 g·L-1牛血清白蛋白(BSA)缓冲液混匀,室温下离心(15 000 r·min-1)10 min,过滤后置于EP管中保存。
1.3.2 收集玻璃体标本A组及D组患者于玻璃体切割手术中获得玻璃体。手术方式相同,均为玻璃体切割术,均使用同一台玻璃体切割机器(美国爱尔康公司 Constellation Vision System 25G TSV),均由同一位眼科医生操作。手术开始前放置灌注头,关闭灌注开关,使用1 mL注射器人工抽取玻璃体0.5 mL,12 000 r·min-1离心5 min,取上清液置于EP管中,-80 ℃冰箱保存。
1.4 观察指标及方法
1.4.1 EPCs数量检测采用流式细胞仪(FCM,美国BD公司)检测EPCs数量。根据前向角散射(FSC)/侧向角散射(SSC)设置第1个细胞门,在散点图中圈选单个核细胞区域,排除细胞碎片等;依据CD34-FITC/SSC设置第2个细胞门,圈定CD34阳性细胞群区域;依据CD34-FITC/CD133-FITC设置第3个细胞门,圈定两者双阳性区域为EPCs,分析2×105个细胞,观察并比较四组患者EPCs数量。
1.4.2 玻璃体内MMP-9、VEGF的蛋白表达采用酶联免疫吸附实验(ELISA)检测,按照MMP-9和VEGF试剂盒(RapidBio Lab 公司)说明书仔细操作。用酶标仪在450 nm波长下测定吸光度(OD)值,使用专业软件(Curve Expert1.3)绘制出标准曲线,根据OD值由标准曲线查出相应MMP-9和VEGF的蛋白相对浓度(mg·L-1)。MMP-9和VEGF的蛋白浓度分别与各标本的总蛋白浓度的比值即为MMP-9和VEGF的蛋白表达水平,为减少误差,每份样本均重复测量2次。
1.5 统计学处理应用SPSS 22.0软件进行统计学分析,计量资料采用均数±标准差表示,四组患者间年龄、EPCs数量比较采用单因素方差分析,MMP-9和VEGF蛋白表达组间比较采用独立样本t检验。计数资料采用率(%)描述,组间比较采用卡方检验。 检验水准:α=0.05。
2 结果
2.1 四组患者EPCs数量比较四组患者EPCs数量差异有统计学意义(P=0.017)。A组及D组患者EPCs数量均显著高于B组、C组,差异均有统计学意义(均为P<0.05);与A组相比,D组患者EPCs数量略有增加,但两组间差异无统计学意义(P>0.05);B组与C组患者EPCs数量比较差异无统计学意义(P>0.05)(表1)。
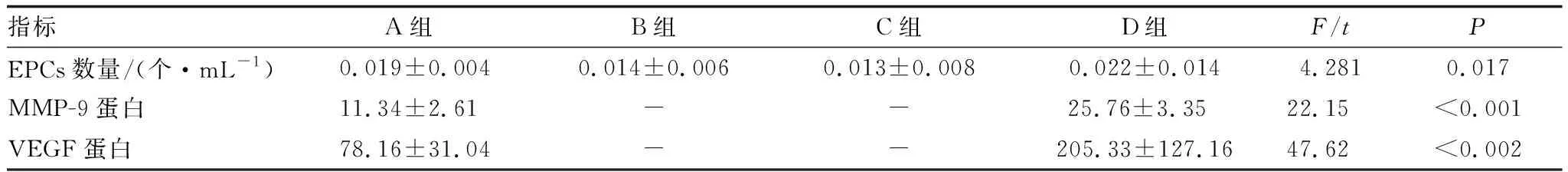
表1 四组患者EPCs数量及玻璃体内MMP-9、VEGF蛋白表达水平
2.2 A组、D组患者玻璃体内MMP-9、VEGF蛋白表达水平D组患者玻璃体内MMP-9的蛋白表达明显高于A组,差异有统计学意义(P<0.05),D组患者玻璃体内VEGF的蛋白表达明显高于A组,差异有统计学意义(P<0.05)(表1)。
3 讨论
Asahara等[8]于1997年从外周血中分离出表达CD34+表面标记的单核细胞,在体外,这些细胞可以促进缺血组织的血管再生,被称之为EPCs,EPCs主要定位于骨髓及外周血,在某些条件影响下可将骨髓中的EPCs动员迁移至外周血发挥相应作用[9]。CD34+、CD133+和血管内皮生长因子受体(VEGFR)视为EPCs的特征性表面标志[10-11],本研究以CD34和CD133为抗体标记EPCs,获得了良好的单核细胞群,这验证了密度梯度离心法具有可靠的效果。
DR是糖尿病最常见的微血管并发症之一,早期即发生全身微血管的缺血缺氧反应,既往研究证明在机体处于缺血、缺氧的环境中时,EPCs可分泌VEGF、基质细胞衍生因子-1(SDF-1)等激活内皮型一氧化氮合酶(eNOS)通路,通过释放MMP-9来促进EPCs的动员、迁移[12]。Igato等[13]研究表明,糖尿病患者EPCs数量有明显变化,同时EPCs与糖尿病微血管并发症发生及进展密切相关。本研究结果显示,A组无糖尿病患者EPCs数量明显较B组、C组高,提示单纯糖尿病及NPDR时体内EPCs较无糖尿病患者明显减少,分析原因可能为:虽然高血糖状态下体内缺血缺氧会刺激EPCs激活eNOS通路促进骨髓中的EPCs向血液内迁移,但EPCs凋亡速度仍远远大于迁移速度,这可能与高血糖状态下机体氧化应激能力明显增强,氧化应激促进细胞凋亡速度有关,同时原血液中的EPCs早期积极发挥对缺血组织血管内皮修复功能,加快了EPCs自身消耗及衰竭[14]。
PDR是DR进展后期较为严重的阶段,主要以形成病理性新生血管为标志,进而引起玻璃体积血、纤维增生膜生成、牵拉性视网膜脱离等严重后果。NPDR中EPCs的血管内皮修复能力只能发挥局限性积极作用,后期随着缺血缺氧进一步加剧,大量微血管内皮功能障碍,血-视网膜内屏障被破坏,宏观表现为视网膜血管不断出血、渗出、闭塞甚至脱离,微观表现为内皮细胞边界断裂,从而刺激病理性新生血管代偿性增生,进而进入PDR。探讨PDR病理性新生血管的发生机制以阻止其发生发展已成为目前眼科研究的前沿与焦点。本研究发现D组患者EPCs数量较B组、C组明显增多,与A组患者相比略有升高但差异无统计学意义,这提示我们DR进入PDR后氧化应激反应逐渐增强,视网膜血管EPCs更加积极被迁移至血管内,并参与了病理性新生血管生成。
VEGF是一种可特异性作用于血管内皮细胞的自分泌性生长因子,在体内可增加血管的通透性及促进新生血管的形成[15]。VEGF在PDR中表达明显升高,但VEGF参与PDR视网膜新生血管的形成机制尚未完全清楚。有研究表明,VEGF可诱导细胞胶原酶的合成及释放,促进内皮细胞的迁移和增殖,改变内皮细胞基因的激活状态[16]。本研究发现,D组患者玻璃体内MMP-9、VEGF蛋白表达水平明显高于A组,两组间差异有统计学意义,这说明在PDR中MMP-9及VEGF均有异常高表达[17],我们猜测可能是因为EPCs迁移到缺血缺氧的视网膜后刺激eNOS通路,大量释放MMP-9及VEGF,VEGF反作用于EPCs表面受体VEGFR,进一步诱导EPCs增生、调节细胞间黏附分子的表达,MMP-9本身可降解细胞外基质中的蛋白成分,在高糖状态下可激发促进氧化应激反应[18]。此外,MMP-9可通过释放VEGF以参与血管生成,MMP-9结合CD44可释放储存的转化生长因子-β(TGF-β),TGF-β是已被证明的血管形成促进因子[19],这些都提示MMP-9及VEGF可能与EPCs互相影响,在PDR新生血管形成中发挥作用。
综上, EPCs的发现成为突破糖尿病长期慢性血管并发症的窗口,这使逆转和改善微血管障碍及影响糖尿病并发症成为可能。EPCs在DR不同时期的变化均有重要意义,尤其参与了PDR病理性新生血管的形成,在DR早期积极上调EPCs数量并改善其功能,对预防新生血管的发生发展有重要意义,应用EPCs作为预防及治疗DR新生血管的靶点,联合VEGF等相关因子干预,或将成为新的治疗思路。本研究仍有不足之处,因B组、C组患者均不需要手术治疗,无法无创性获取患者玻璃体,故对B组、C组患者MMP-9、VEGF蛋白无法测定,后期计划开展动物实验进一步研究。同时EPCs在DR不同时期发挥作用时,自身迁移、黏附及修复功能是否有变化也暂未进行深层次探讨,后期可加大样本量进行研究。
