基于miR-224-5P调控的IL6ST/JAK/STAT信号通路在糖尿病视网膜病变发生发展中的作用△
2023-05-18辛向阳
赵 鑫 杨 静 辛向阳
糖尿病视网膜病变(DR)是工作年龄人群失明的主要原因[1]。DR发生机制被认为是高血糖通过多种生化机制促进血管功能障碍和神经炎症,这些生化机制包括增加细胞因子和生长因子表达、激活氧化应激、激活多元醇途径、增加晚期的糖基化和脂氧化终产物、导致血流动力学变化及白细胞停滞等[2-3]。微小核糖核酸(miRNA)是一类广泛存在于动物界的转录后基因抑制因子家族,广泛参与各种环境中基因表达的调控[4]。miRNA在DR中具有明显的分化表达,对DR的发生发展具有重要作用[5-7]。miR-224-5P在正常人体组织中多处表达,其异常表达与许多疾病相关。前期的多项研究表明,miR-224-5P是肝细胞癌[8]、胰腺导管腺癌[9]及非小细胞肺癌[10]等肿瘤性疾病发生和发展的关键因素。在眼部疾病中,miR-224-5P通过靶向葡萄膜黑色素瘤中PIK3R3/AKT3 抑制细胞的增殖、迁移和侵袭[11];LncRNA PLCD3-OT1可以作为CeRNA通过海绵miR-224-5P和调节PLCD3的表达来预防年龄相关性白内障[12]。而对miR-224-5P在DR中的表达变化及在DR发生发展中发挥的作用研究较少。因此,本研究聚焦miR-224-5P在DR中的作用,探讨miR-224-5P对DR发生发展的影响,分析该作用是否与JAK/STAT信号通路有关,为DR的诊断和治疗提供新的途径和思路。
1 材料与方法
1.1 材料
1.1.1 实验标本选取2021年6月至2022年3月在内蒙古包钢医院眼科确诊为DR的患者及同期来我院体检中心体检的健康人群各6例,采集纳入研究者的空腹肘静脉血各5 mL,放入-80 ℃低温冰箱中保存备用。DR患者年龄55~80(66.0±8.4)岁,其中男2例,女4例,糖尿病病程为6~30(16.2±8.8)年;健康人群年龄42~76(63.0±11.8)岁,其中男3例,女3例。DR患者与健康人群的年龄及性别构成差异均无统计学意义(P=0.623、0.083)。DR患者纳入标准:(1)所有研究对象长期居住于本地;(2)年龄为55~80岁。排除标准:(1)伴有除糖尿病外的其他严重的全身性疾病者;(2)合并有青光眼、葡萄膜炎、黄斑变性等其他眼部疾病者。本研究符合《赫尔辛基宣言》原则,并经内蒙古包钢医院伦理委员会批准(批号:2021MER-041)。纳入研究者均知情同意,并已签署知情同意书。
1.1.2 细胞与主要实验试剂人视网膜色素上皮细胞(ARPE-19)购自上海雅吉公司;RNA抽提试剂盒、反转录试剂盒及反转录引物均由上海生工生物工程有限公司提供;慢病毒、质粒及siRNA的构建均由上海华大公司提供;LipofectamineTM3000试剂盒由美国Invitrogen公司提供;CCK-8试剂盒及Transwell试剂盒由美国Corning公司提供;Promega Dual-Luciferase system试剂盒由美国Promega公司提供;一抗、二抗试剂由英国Abcam公司提供;ELISA试剂盒由上海联迈公司提供。
1.2 方法
1.2.1 RT-qPCR检测血液中miR-224-5P表达情况DR患者和健康人群空腹外周血解冻后,Trizol法抽提总RNA,将miRNA逆转录成cDNA,按照 95 ℃ 10 min、95 ℃ 10 s、60 ℃ 60 s,40个循环进行PCR扩增,通过2-△△CT法对外周血中miR-224-5P的表达情况进行分析。引物序列:miR-224-5P上游引物为5’-GGT CCT AAG TCA CTA GTG GTT CCG T T-3’,下游引物为5’-CCA GTG CAG GGT CCG AGG T-3’;内参基因U6上游引物为5’-CGC ACT TTA CGG CTA CCT CT-3’;下游引物为5’-CGC CCC AGA CTG AAA AAG AC-3’。
1.2.2 细胞培养及分组处理ARPE-19细胞使用含体积分数10%FBS和10 g·L-1青链霉素的专用完全培养基,于37 ℃、含体积分数5% CO2培养箱中培养,取对数生长期细胞用于实验。将细胞随机分组为高糖组、高糖+miR-224-5P mimics组和高糖+miR-224-5P inhibitor组。其中,高糖组:细胞用含30 mmol·L-1高糖培养基培养48 h;高糖+miR-224-5P mimics组和高糖+miR-224-5P inhibitor组细胞使用100 nmol·L-1LipofectamineTM3000 分别将100 nmol·L-1miR-224-5P mimics或100 nmol·L-1miR-224-5P inhibitor转染至细胞中,6 h后置于含30 mmol·L-1的高糖培养基中培养48 h。
另外,将正常培养的ARPE-19细胞随机分成高糖组、高糖+miR-224-5P mimics组、高糖+OE-IL6ST组和高糖+miR-224-5P mimics+OE-IL6ST组来验证miR-224-5P mimics是否通过IL6ST/JAK/STAT通路发挥作用。其中,高糖+OE-IL6ST组和高糖+ miR-224-5P mimics+OE-IL6ST组使用100 nmol·L-1LipofectamineTM3000 分别将100 nmol·L-1OE-IL6ST或100 nmol·L-1miR-224-5P mimics和100 nmol·L-1OE-IL6ST转染至细胞中,6 h后置于含30 mmol·L-1的高糖培养基中培养48 h。
1.2.3 CCK-8检测细胞活力将ARPE-19细胞按照每孔2×103个接种到96孔板中,培养箱中培养4 h,分组处理后向每孔中加10 μL CCK-8溶液,培养箱中孵育5 d,分别于孵育1 d、2 d、3 d、4 d及5 d的同一时间点用酶标仪测定在450 nm处的吸光度。每组设置2个复孔,实验重复3次,取平均值统计。
1.2.4 Transwell细胞迁移实验在24孔板中放入小室,加100 μL无血清培养基到小室内,培养箱放置2 h后移去培养基。加600 μL含体积分数20% FBS培养基到下室内。胰蛋白酶消化处于对数生长期的各组细胞,用含体积分数2% FBS的低血清培养基重悬,用无血清培养基稀释细胞悬液,使每孔接种细胞数为50×103个,每个小室中加细胞悬液100 μL。在细胞培养箱中培养 24 h。棉拭子轻轻移去未转移细胞,室温下40 g·L-1多聚甲醛固定20 min。用400 μL吉姆萨染色 5 min,去离子水适度漂洗,倒置显微镜下观察并拍照。
1.2.5 双荧光素酶实验验证miR-224-5P与IL6ST的靶向关系通过Targetscan(http://www.targetscan.org)及MiRWALK网站(http://mirwalk.umm.uni-heidelberg.de)预测miR-224-5P可能的靶基因,并从中挑选IL6ST为候选靶基因进行实验验证。构建IL6ST基因野生型(wt)及突变型(mut)质粒载体,使用pcDNA3.1编码萤火虫荧光素酶,phRG编码海肾荧光素酶为阴性对照。将HEK-293T细胞和目的质粒分别加入96孔板,在细胞密度达到 50%~70%时使用0.3 μL LipofectamineTM3000进行细胞转染。实验分为阴性对照+IL6ST wt组(转染1 pmoL阴性对照及0.1 μg IL6ST-3’UTR-wt)、miR-224-5P mimics+ IL6ST wt组(转染1 pmoL miR-224-5P mimics及0.1 μg IL6ST-3’UTR-wt)、 阴性对照+IL6ST mut组(转染1 pmoL阴性对照及0.1 μg IL6ST-3’UTR-mut)、miR-224-5P mimics+IL6ST mut(转染1 pmoL miR-224-5P mimics及0.1 μg IL6ST-3’UTR-mut)4组。转染48 h后,各组细胞分别取出25 μL置于96孔板中(每孔1×105个细胞),加入Dual-Glo®Reagent 75 μL室温静置10 min,测定Firefly luciferase值为报告基因发光值;加入75 μL Stop &Glo®Reagent,室温静置10 min后测定Renilla luciferase值为内参值。统计分析相对荧光值变化,明确miR-224-5P 对 IL6ST的调控作用。
1.2.6 RT-qPCR检测各组细胞IL6ST基因的内源性表达各组细胞用Trizol法抽提总RNA,质控后将miRNA逆转录为cDNA,检测各组细胞中IL6ST相对表达量。引物序列:IL6ST上游引物为5’-ACG AAT GGC AGC ATA CAC-3’,下游引物为5’-AGC AAA CAG GCA CGA CTA-3’;GAPDH上游引物为5’-TGA CTT CAA CAG CGA CAC CCA-3’,下游引物为5’-CAC CCT GTT GCT GTA GCC AAA-3’。
1.2.7 Western blot检测各组细胞IL6ST、P-JAK及P-STAT蛋白相对表达高糖组、高糖+miR-224-5P mimics组、高糖+miR-224-5P inhibitor组、高糖+OE-IL6ST组和高糖+miR-224-5P mimics+OE-IL6ST组细胞加160 μL细胞裂解液进行总蛋白的抽提,BCA法进行总蛋白定量。采用Western blot法以GAPDH为内参,检测各组细胞IL6ST、P-JAK及P-STAT蛋白表达水平,使用ImageJ行定量计算。
1.2.8 ELISA检测各组细胞IL-1β、IL-6及TNF-α蛋白表达水平将100 μL标准品及高糖组、高糖+miR-224-5P mimics组和高糖+miR-224-5P inhibitor组细胞加入反应孔中,封板后于37 ℃孵箱孵育90 min,分别加入100 μL生物素化抗体工作液、100 μL酶结合物工作液封板孵育60 min及30 min,再加入100 μL显色底物至反应孔中,封板后于37 ℃避光显色15 min,加入50 μL终止液后即刻用酶标仪在450 nm波长下测定吸光度(OD),通过标准曲线计算样品中IL-1β、IL-6 及TNF-α含量。

2 结果
2.1 DR患者及健康人群外周血中miR-224-5P的相对表达量比较RT-qPCR检测结果显示,DR患者外周血中miR-224-5P mRNA相对表达量为0.421±0.079,显著低于健康人群(0.973±0.249),差异有统计学意义(P<0.001)。
2.2 miR-224-5P对细胞活力及迁移的影响CCK-8检测结果显示,与高糖组相比,高糖+miR-224-5P mimics组细胞活力增高,高糖+miR-224-5P inhibitor组细胞活力降低(P<0.001)(图1)。Transwell实验结果显示,高糖组、高糖+miR-224-5P mimics组、高糖+miR-224-5P inhibitor组细胞迁移率分别为1.000%±0.080%、2.480%±0.059%、0.590%±0.053%,高糖+miR-224-5P mimics组细胞迁移率较高糖组明显升高(P<0.001),高糖+miR-224-5P inhibitor组细胞迁移率较高糖组明显降低(P<0.001)。
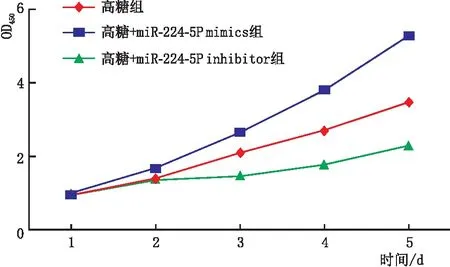
图1 各组ARPE-19细胞活力
2.3 miR-224-5P与IL6ST的靶向关系验证通过软件预测miR-224-5P与IL6ST之间有结合位点(图2)。双荧光素酶实验结果显示,miR-224-5P mimics+ IL6ST wt组细胞相对荧光素酶活性(0.006±0.000)低于阴性对照+IL6ST wt组(0.011±0.000)(P<0.001),miR-224-5P显著下调野生型荧光素酶活性的表达,提示两者间存在结合作用。突变后, miR-224-5P mimics+IL6ST mut组细胞相对荧光素酶活性(0.009±0.000)与阴性对照+IL6ST mut组(0.011±0.000)相比,差异无统计学意义(P>0.05),提示miR-224-5P不能下调突变型荧光素酶活性的表达,突变成功后两者间不存在结合作用。RT-qPCR检测结果显示,与阴性对照+IL6ST wt组(1.003±0.093)相比,miR-224-5P mimics+IL6ST wt组细胞的IL6ST mRNA表达水平(0.408±0.070)显著降低(P<0.001),进一步验证miR-224-5P 与IL6ST 的相互作用关系。
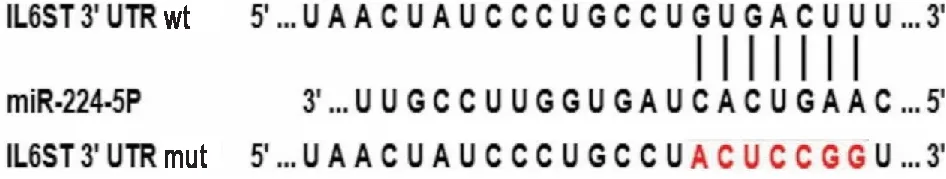
图2 miR-224-5P在IL6ST mRNA 3’UTR的结合位点及突变位点示意图
2.4 miR-224-5P对IL6ST、P-JAK及P-STAT蛋白表达水平的影响Western blot检测结果显示,与高糖组相比,高糖+miR-224-5P mimics组细胞的IL6ST蛋白表达水平降低,P-JAK和P-STAT蛋白表达水平升高(均为P<0.05);高糖+miR-224-5P inhibitor组细胞的IL6ST蛋白表达水平升高,P-JAK和P-STAT蛋白表达水平降低(均为P<0.05)(图3)。

图3 各组ARPE-19细胞的IL6ST、P-JAK和P-STAT蛋白表达 与高糖组相比,*P<0.05,**P<0.01。
2.5 miR-224-5P对IL-1β、IL-6及TNF-α蛋白表达水平的影响ELISA检测结果显示,与高糖组相比,高糖+miR-224-5P mimics组细胞的IL-1β、IL-6 及TNF-α蛋白表达水平均显著降低,而高糖+miR-224-5P inhibitor组细胞的IL-1β、IL-6 及TNF-α蛋白表达水平均显著上升(均为P<0.01)(图4)。

图4 各组ARPE-19细胞炎症因子的表达情况 与高糖组相比,**P<0.01,***P<0.001。
2.6 过表达IL6ST可以逆转miR-224-5P对高糖诱导ARPE-19细胞的影响CCK-8和Transwell检测结果显示:高糖组、高糖+miR-224-5P mimics组、高糖+OE-IL6ST组和高糖+miR-224-5P mimics+OE-IL6ST组ARPE-19细胞活力分别为2.634%±1.142%、3.186%±1.525%、1.938%±0.629%、2.699%±1.198%,细胞迁移率分别为0.990%±0.020%、1.390%±0.024%、0.440%±0.016%、0.480%±0.020%。与高糖组相比,高糖+miR-224-5P mimics组细胞活力和细胞迁移率均显著升高,高糖+OE-IL6ST组细胞活力和细胞迁移率均显著降低(均为P<0.001);与高糖组相比,高糖+miR-224-5P mimics+OE-IL6ST组细胞活力升高,细胞迁移率降低(均为P<0.001);高糖+miR-224-5P mimics+OE-IL6ST组细胞活力和迁移率均较高糖+miR-224-5P mimics组显著降低(均为P<0.001)。Western blot检测结果显示,与高糖组相比,高糖+miR-224-5P mimics组细胞的P-JAK和P-STAT蛋白表达水平均升高(均为P<0.05);高糖+OE-IL6ST组细胞的P-JAK和P-STAT蛋白表达水平均显著降低(均为P<0.001);与高糖组相比,高糖+miR-224-5P mimics+OE-IL6ST组细胞的P-JAK和P-STAT蛋白表达水平均降低(均为P<0.001);与高糖+OE-IL6ST组相比,高糖+miR-224-5P mimics+OE-IL6ST组细胞的P-JAK和P-STAT蛋白表达水平均升高(均为P<0.001);与高糖+miR-224-5P mimics组相比,高糖+miR-224-5P mimics+OE-IL6ST组细胞的P-JAK和P-STAT蛋白表达水平均降低(均为P<0.001)(图5)。
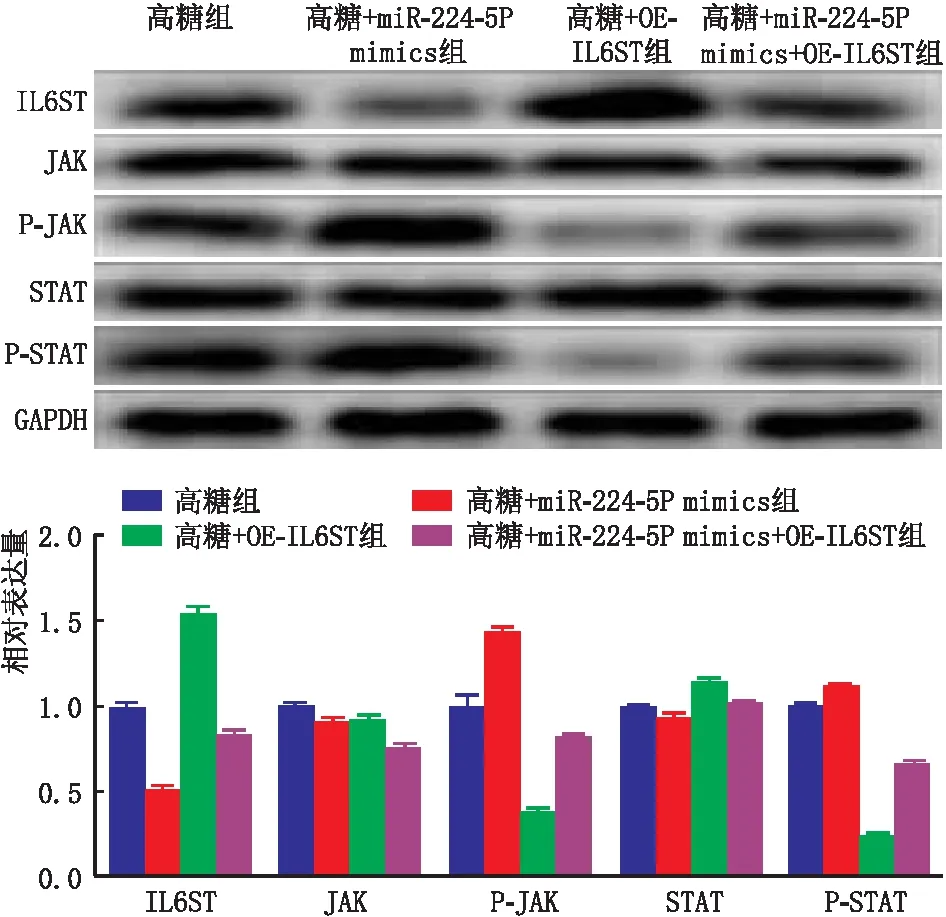
图5 过表达IL6ST对各组ARPE-19细胞的IL6ST、P-JAK和P-STAT蛋白表达的影响
3 讨论
DR是与持续高血糖相关的一种慢性、进行性、潜在危害视力的视网膜微血管疾病,其发生的分子机制错综复杂,涉及氧化应激、炎症、新生血管、视网膜神经节细胞死亡和胶质细胞活性的改变等[13]。有研究发现,microRNA在DR中可以调节炎症、氧化应激及神经变性这几种病理过程的分子相互作用和信号通路[14]。Becker等[15]研究显示,miR-224-5P是与DR相关的重要RNA分子,在DR患者死后视网膜样本中富集并显著降低。本研究发现,miR-224-5P 在DR患者血液中表达显著低于健康对照人群,提示miR-224-5P可能参与调控DR的发生发展。
视网膜色素上皮(RPE)是神经视网膜和脉络膜区域之间的单层细胞屏障,可以调节视网膜营养物质代谢、分泌生长因子促进视网膜和脉络膜生长、吞噬衰老的感光细胞外膜[16]。有研究显示,在高糖诱导的ARPE-19细胞中,miR-455-5P可通过上调血管内皮生长因子及转化生长因子显著增强细胞活力[17]。本实验以miR-224-5P过表达/抑制质粒干预处理高糖诱导的ARPE-19细胞,结果发现,过表达miR-224-5P可增加细胞活力和迁移率,而抑制miR-224-5P后细胞活力和迁移率降低,提示miR-224-5P可以增加高糖诱导的ARPE-19细胞活力及迁移率,也许可以成为DR的治疗靶点。
DR的发生已经证实与炎症有关[18]。本研究结果显示,过表达miR-224-5P可降低高糖诱导的ARPE-19细胞中IL-1β、IL-6 及TNF-α的表达,而抑制miR-224-5P可增加上述炎症因子表达,表明miR-224-5P可以抑制DR的炎症反应。本研究进一步探究了miR-224-5P可能的作用机制。经典JAK/STAT信号通路是细胞功能的中心通讯节点之一,在视网膜的损伤和再生反应、神经胶质细胞的增殖以及星形胶质细胞的分化、视网膜微血管内皮细胞的损伤过程中是一个重要信号“枢纽”[19],在DR发病中也有重要作用。IL6ST是一种信号受体亚基,编码膜糖蛋白130 (GP130),作用于IL-6家族细胞因子[20]。IL6ST能通过JAK-STAT途径转导,其中受体相关JAK(即JAK1、JAK2和TYK2)激活潜在转录因子STAT1、STAT3和STAT5的募集和活化[21]。研究发现,IL-6/JAK/STAT3信号通路与许多炎症性疾病和癌症有关[22]。同时,部分研究已证明,IL-6/JAK/STAT信号转导途径也通过与细胞miRNA的复杂相互作用发挥作用[23]。本研究通过双荧光素酶实验证实了IL6ST是miR-224-5P调控的靶基因,并且与阴性对照组相比,过表达miR-224-5P后IL6ST的mRNA表达水平显著降低,两者呈负相关,说明miR-224-5P可以通过负调控IL6ST影响DR进程。我们进一步探究了miR-224-5P是否通过IL6ST/JAK/STAT信号通路在高糖诱导的ARPE-19细胞中发挥作用。结果显示,过表达miR-224-5P降低IL6ST的蛋白水平,而增加了下游分子P-JAK和P-STAT蛋白水平。抑制miR-224-5P使IL6ST的蛋白表达水平升高,P-JAK和P-STAT的蛋白水平下降。通过过表达IL6ST进一步验证发现,与高糖+miR-224-5P mimics组相比,高糖+miR-224-5P mimics+OE-IL6ST组ARPE-19细胞活力和细胞迁移率均显著降低,且P-JAK和P-STAT的蛋白表达水平降低。这表明miR-224-5P在高糖诱导的ARPE-19细胞中是通过活化IL6ST/JAK/STAT信号通路发挥作用的。本研究结果中P-JAK和P-STAT的蛋白表达水平变化,与Fiebelkow等[24]研究认为的IL-6受体激活JAK/STAT信号通路引起的P-JAK和P-STAT的蛋白表达水平变化不同。Darnell等[25]研究显示,50多种细胞因子和生长因子可以作用于JAK/STAT信号通路引起P-JAK和P-STAT的蛋白表达水平发生变化,本实验研究结果可能是由于多种细胞因子综合作用表现出的结果,详细机制有待后续进一步研究。
综上所述,本研究发现,miR-224-5P在DR患者血液中表达降低,过表达miR-224-5P可降低高糖引起的炎症因子表达,并可通过IL6ST/JAK/STAT信号通路增加高糖诱导的ARPE-19细胞活力及迁移率,从而调控DR的发生和发展。后续我们将进一步研究miR-224-5P增加RPE细胞活力及迁移率对DR的可能作用,并验证其他miRNA在DR发生发展中的具体表达机制,为DR的分子标记物研究提供新的思路和依据。
