NaCl 与NaHCO3单盐胁迫下秋萍红树莓的光合及生理指标响应*
2023-05-18王柏茗聂江力钱滢宇
王柏茗,聂江力,裴 毅,苏 雅,钱滢宇
(天津农学院 园艺园林学院,天津 300392)
红树莓(Rubus idaeusL.)为蔷薇科(Rosaceae)悬钩子属(Rubus)多年生灌木,其果实具有独特浓郁的香气,酸甜可口,含有多种维生素、丰富的酚类和黄酮类物质等,具有较高的营养价值。其鞣花酸含量高于大多数水果,该物质具有较强的抗氧化性以及抗肿瘤活性[1],其特征性香气成分树莓酮还具有加速脂肪代谢、控制食欲和抑制增重的功效[2]。红树莓不仅作为鲜食果品供应市场,其果实、植株和种子的深加工产品还被用于食品工业和医疗保健等领域。截至2015 年,世界红树莓果实年产量已达42.52 万t,中国的红树莓产业处于快速增长期,年产量已达到7.9 万t[3]。京津冀地区消费水平高,日益注重生活品质的提高,对新、特水果需求逐渐加大,红树莓产业在该地区发展前景广阔。天津位于红树莓适生的气候带,引入和发展红树莓产业有利于调整天津周边地区的农业种植结构,增加生态效益,丰富农产品品类,有助于农民增收和培育壮大特色精品农业。天津曾有红树莓的引种记录,部分品种如Tulameen、Reveille 和Heritage 具有一定适应性[4],但现代红树莓品种间遗传背景复杂,习性差异大。秋萍是中国自主选育的红树莓品种,前期经过2 年的引种地栽培观察[5],其在天津地区生育良好,但天津地区面临突出的土壤盐渍化问题,该品种的耐盐碱性未见报道。对秋萍红树莓的耐盐浓度范围进行研究,可为其推广和开发提供依据。
土壤盐渍化是制约农业发展的重要非生物因素之一。天津属于典型的土壤盐渍化区域,并伴有不同程度的次生碱化,盐渍化土壤面积占全市土地面积的65.7%,其敏感区主要分布于除北部山区和洪积冲积平原区以外的广大海积平原和洼地[6-7]。土壤盐渍化虽然危害农业生产,但合理利用盐碱地对一些特定的农业生产反而有利,在一定的范围内,盐碱胁迫有助于改善产品风味[8]。本研究以秋萍红树莓的组培苗为试验材料,探讨其在盐碱胁迫过程中光合特性与生理指标的变化规律,以期为秋萍红树莓在盐渍化地区的建园选址和推广生产提供参考。
1 材料与方法
1.1 秋萍红树莓的栽培
试验地位于天津农学院东校区试验田内(N39°05',E117°06',海拔4 m)。将秋萍红树莓组培苗(高约10 cm)栽入双色育苗杯(上直径19 cm,下直径17 cm)中,将基质(V泥炭∶V珍珠岩∶V蛭石=2∶1∶1)装入盆中,每盆加入有机肥30 g,每盆1 株组培苗,共计50 盆,浇透水。每周浇水1 次;每月追肥(1 000 倍水溶肥液) 2 次,每次500 mL;培养3 个月,待苗高80~100 cm 时进行单盐胁迫试验。
1.2 盐胁迫试验
分别用NaCl 和NaHCO3对试验材料进行单盐胁迫。选取生长良好且整齐的秋萍红树莓39 株,设置1 个对照组(CK)和2 个盐胁迫组,其中CK 组浇灌蒸馏水,盐胁迫组各设置6 个浓度梯度(30、60、90、120、150 和180 mmol/L)的盐溶液。每处理设3 次重复,每5 d 浇灌对应溶液1 次,每次500 mL,共计3 次。
1.3 形态观测和指标测定
(1) 表观形态的观测
肉眼观察植株生长情况、叶片颜色变化及症状表现,统计落叶数。
(2) 光合特性测定
于10:00 前后,每个处理随机选取植株中上部等位健康叶片3 枚,采用GFS-3000 便携式光合仪测定净光合速率、蒸腾速率、气孔导度和胞间二氧化碳浓度,每5 d 测定1 轮。测定时采用光合仪控制光强和温度:叶片温度依照环境温度设定为28 ℃;光源采用补充光源,光强设置为900 μmol/(m2·s)[9]。
(3) 生理指标测定
胁迫处理15 d 后,遵循等位取样的原则取每株中上部等位功能叶若干备用,测定时去除叶柄和中脉[10]。采用磺基水杨酸提取和酸性茚三酮染色法测定游离脯氨酸含量;采用硫代巴比妥酸法测定丙二醛含量;采用蒽酮比色法测定可溶性糖含量;采用SOD 抑制氮蓝四唑(NBT)光化学还原法测定SOD 活性;采用愈创木酚显色法测定POD 活性;采用紫外吸收法测定CAT 活性[11-12];采用日立UH5300 紫外分光光度计测定叶片叶绿素和类胡萝卜素含量。每个指标重复测定3 次。
1.4 数据分析
数据均采用WPS 软件统计并制图;采用SPSS 17.0 统计分析软件对不同处理下的各项指标进行差异显著性分析;采用Duncan 氏新复极差法评估处理效果。
2 结果与分析
2.1 表观形态变化
单盐胁迫处理6 d 后,部分秋萍红树莓叶色出现变化,下部叶干枯脱落,但不同盐处理的表现有所差异。NaCl 胁迫后,植株下部叶发黄并脱落,中上部叶颜色无明显变化;90~180 mmol/L NaCl 处理下,随着溶液浓度的升高,落叶数增加(表1),且高浓度处理组的嫩叶边缘出现不规则且边界不清晰的坏死现象,部分叶片的中部坏死;180 mmol/L NaCl 处理下,秋萍植株死亡2 株,占该组的66.7%。此外,随着NaHCO3浓度的升高,秋萍植株叶片颜色先变绿再变黄,落叶数先减后增;其中,30 mmol/L NaHCO3处理组生长旺盛,叶色较对照处理深,落叶数最少;当NaHCO3浓度大于90 mmol/L 时,随着NaHCO3浓度的升高,全株叶片逐渐黄化,落叶数增加,中下部叶产生由支脉围合、边界明显的褐色斑点;180 mmol/L NaHCO3处理下植株完全停止生长。
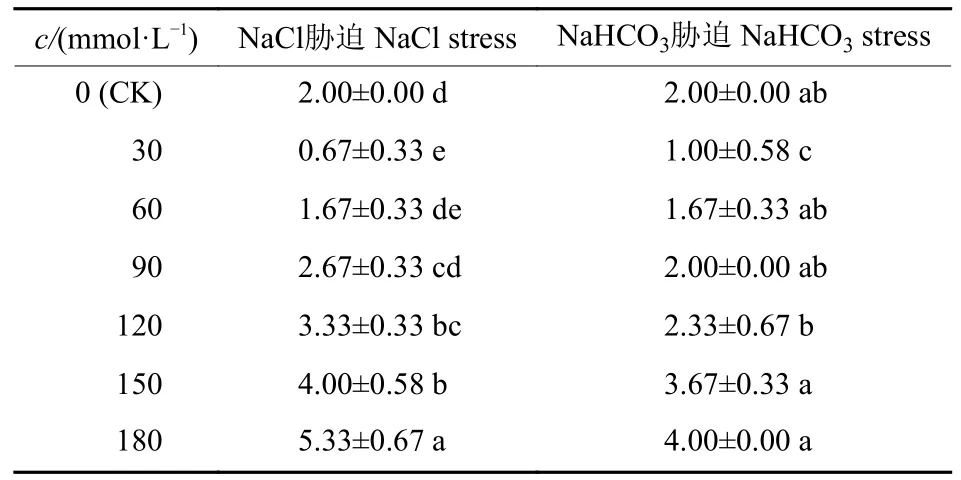
表1 2 种钠盐胁迫下秋萍的落叶数Tab.1 Numbers of fallen leaves of Qiuping under two kinds of sodium salt stress
2.2 光合特性分析
2.2.1 NaCl 胁迫下光合特性的变化
由图1 可知:NaCl 胁迫下,随着溶液浓度的升高,第5 和10 天各组间蒸腾速率呈升—降—升—降的变化趋势,30 和120 mmol/L NaCl 胁迫的蒸腾速率较高;随着胁迫时间的延长,第15 天各组间蒸腾速率呈降—升—降的变化趋势。NaCl 胁迫对气孔导度有明显影响,随着溶液浓度的升高,胁迫第10~15 天气孔导度逐渐降低,表现为严重的生理干旱现象。处理5 d 时,净光合速率呈低浓度NaCl 胁迫下降低而高浓度NaCl 胁迫下升高的变化趋势,且在150~180 mmol/L NaCl处理时最高;处理10 d 时,净光合速率呈先升高后降低的变化趋势,且各组间差异不显著;处理15 d 时,90~180 mmol/L NaCl 胁迫组的净光合速率极显著降低,表明持续的高浓度NaCl 胁迫已对净光合速率造成了抑制。胞间二氧化碳浓度几乎不受胁迫浓度和时间影响,各组间无显著差异。
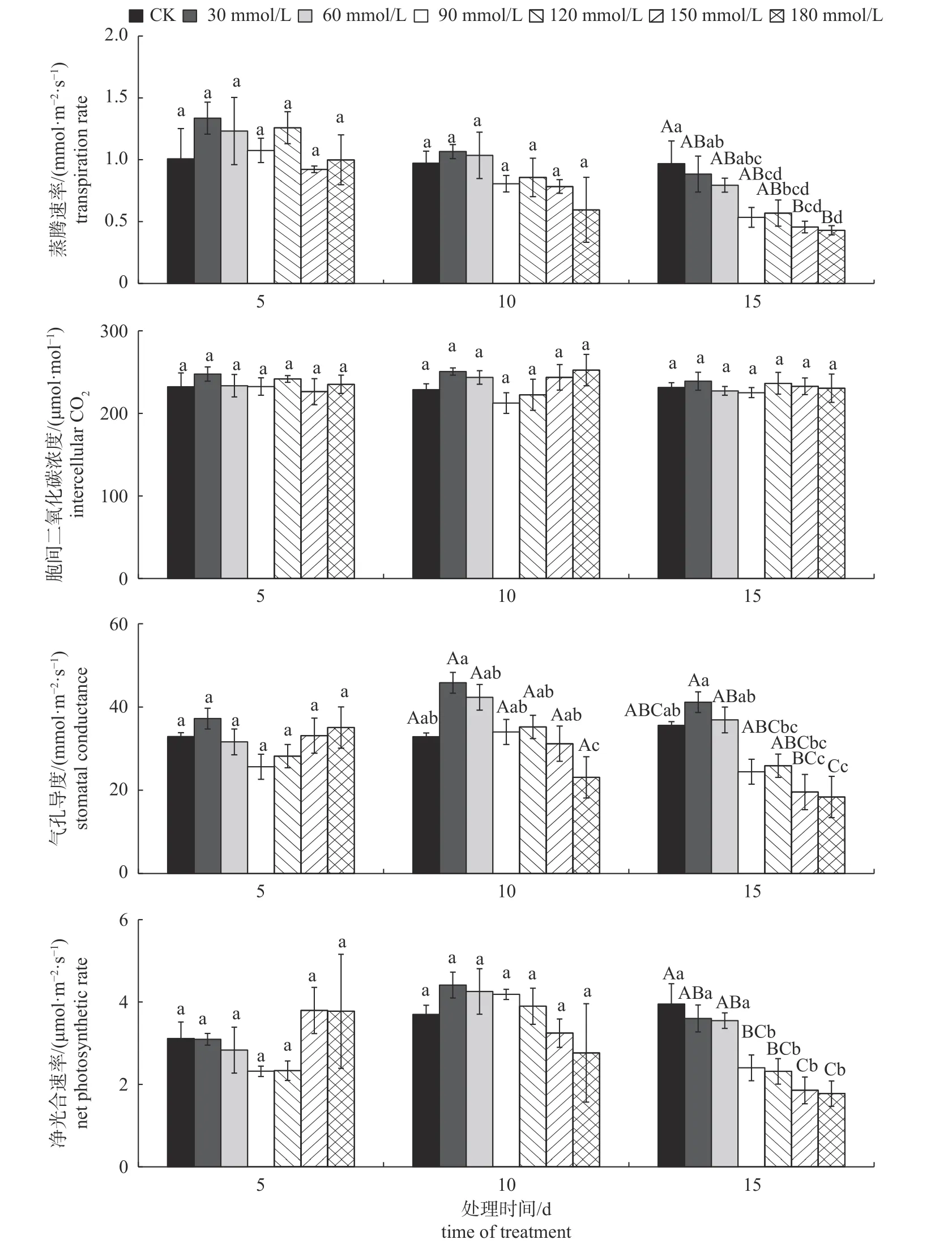
图1 不同浓度NaCl 胁迫对秋萍植株光合特性的影响Fig.1 Effects of different concentrations of NaCl stress on the photosynthetic characteristics of Qiuping
2.2.2 NaHCO3胁迫下光合特性的变化
由图2 可知:处理5 d 时,随着NaHCO3浓度的升高,蒸腾速率、气孔导度和净光合速率总体均呈先增高后降低的变化趋势;120 mmol/L~180 mmol/L NaHCO3胁迫下,随着胁迫时间的延长,胞间二氧化碳浓度先减小后增大,气孔导度降低,净光合速率减弱。
2.3 光合色素的变化
由图3 可知:叶绿素含量随NaCl 浓度的升高呈升高—降低—升高的变化趋势,120 mmol/L NaCl 胁迫时叶绿素含量最低,叶片均为青绿色;此外,叶绿素含量随NaHCO3浓度的升高呈先升后降的单峰曲线变化,但各处理组间的总叶绿素、叶绿素a 和叶绿素b 含量均无显著差异,60 mmol/L 组的总叶绿素和叶绿素a 含量最高,90 mmol/L 组的叶绿素b 含量最高。结果印证了表观叶色的变化趋势,即随着盐浓度的升高,叶片颜色先变深再变浅。
由图3 还可知:2 种盐胁迫下类胡萝卜素含量呈先升高后降低的变化趋势。NaCl 胁迫下,30 mmol/L 组的类胡萝卜素含量最高,约为CK的1.5 倍;NaHCO3胁迫下,类胡萝卜素含量随NaHCO3浓度的升高而先升高后降低,且 90 mmol/L组的类胡萝卜素含量显著高于CK,极显著高于180 mmol/L 组。

图3 不同浓度NaCl 和NaHCO3胁迫对秋萍叶片光合色素含量的影响Fig.3 Effects of different concentrations of NaCl and NaHCO3stress on the photosynthetic pigments of Qiuping
2.4 保护酶活性的变化
由图4 可知:NaCl 胁迫下,150 mmol/L NaCl处理的秋萍叶片SOD 活性最高,较CK 高17%,且显著高于120 和180 mmol/L 组,30 mmol/L 组活性最弱;NaHCO3胁迫下,秋萍叶片SOD 活性随NaHCO3浓度的升高呈先降后升再降的变化趋势,30 mmol/L 组显著低于CK 处理,且各处理组的SOD 活性均小于CK 处理,组间差异未达到极显著水平。NaCl 胁迫下,POD 活性随NaCl 浓度的升高(0~150 mmol/L)逐渐降低,但180 mmol/L NaCl 处理时其活性显著增高;NaHCO3胁迫下,各处理组的POD 活性均低于对照组,呈微弱的先增高后降低的趋势,30~180 mmol/L 各处理组间差异均不显著。NaCl 胁迫下,CAT 活性呈单峰变化曲线,且60 mmol/L NaCl 处理时最高,约为CK 和180 mmol/L 组 的3.70 倍;NaHCO3胁迫下,随着NaHCO3浓度的升高,CAT 活性呈降低—升高—降低的变化趋势,且90 mmol/L NaHCO3组极显著高于其他组,约为对照组的2.47 倍。
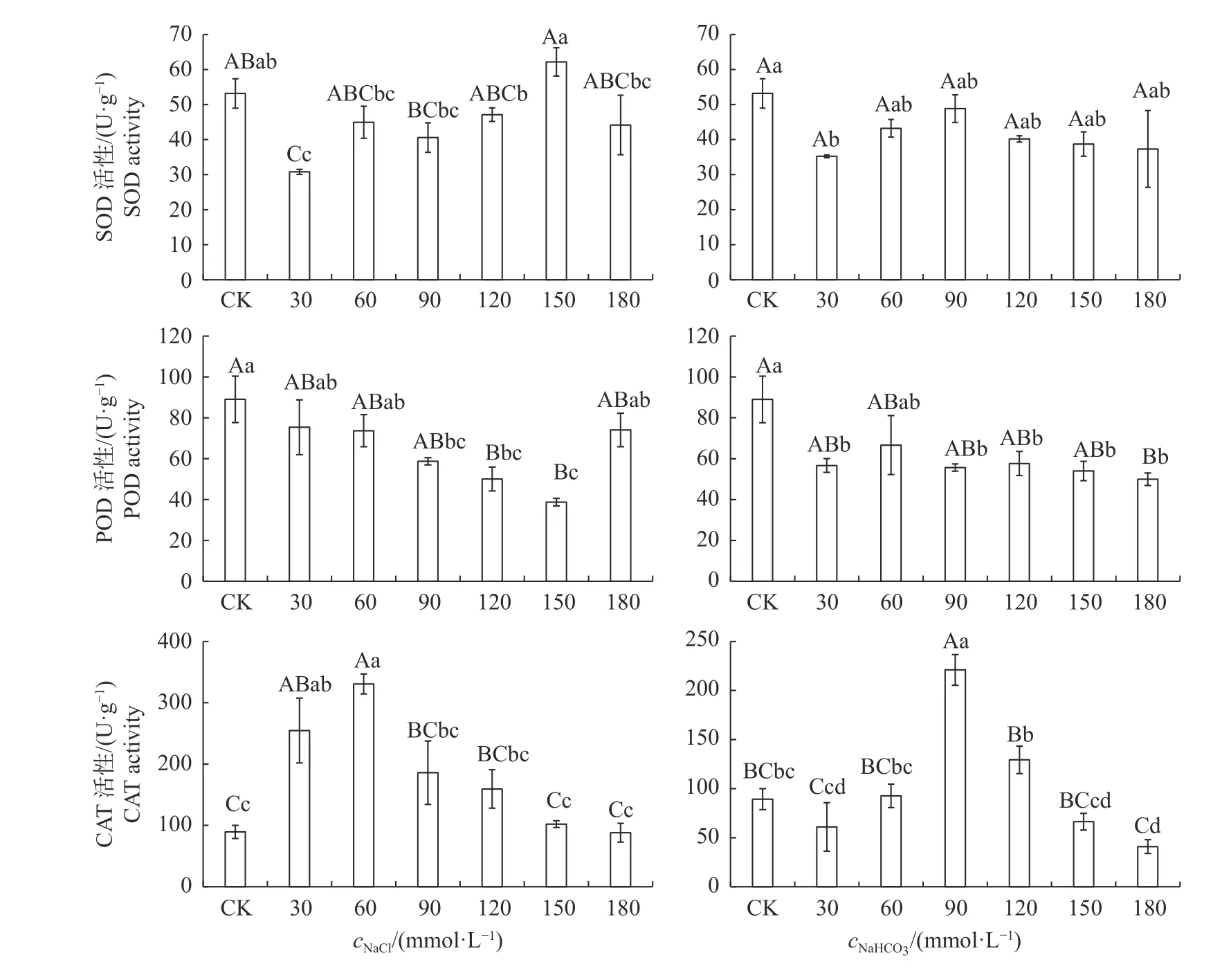
图4 不同浓度NaCl 和NaHCO3胁迫对秋萍叶片保护酶活性的影响Fig.4 Effects of different concentrations of NaCl and NaHCO3stress on the leave protective enzyme activity of Qiuping
2.5 渗透调节物质的变化
由图5 可知:NaCl 胁迫下,可溶性糖含量先增加后减少,各处理组间无显著差异;NaHCO3胁迫下,随着NaHCO3浓度的升高,可溶性糖含量呈先缓慢上升后下降的趋势,30~90 mmol/L NaHCO3范围内平缓上升,在120 mmol/L NaHCO3处理达到最大值,且极显著高于CK 组,约为CK 组的3 倍。NaCl 胁迫下,秋萍的可溶性蛋白含量在120 mmo/L 组最高,且极显著高于CK组,约为CK 组的 1.86 倍;NaHCO3胁迫下,秋萍的可溶性蛋白含量呈先升高后降低的变化趋势,60~120 mmo/L NaHCO3处理时其含量极显著高于CK 组。秋萍受到NaCl 胁迫后,其脯氨酸含量呈降低—升高—降低的变化趋势,且30 mmol/L NaCl 处理时最低,120 mmol/L NaCl处理时最高;当秋萍受到NaHCO3胁迫后,其脯氨酸含量呈先降后升的变化趋势,30、60 和90 mmol/L 处理组的脯氨酸含量分别为CK 组的53.07%、64.76%和68.38%。
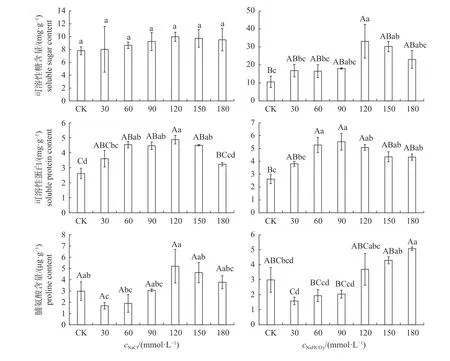
图5 不同浓度NaCl 和NaHCO3胁迫对秋萍叶片渗透调节物质含量的影响Fig.5 Effects of different concentrations of NaCl and NaHCO3stress on the leave osmotic adjustment substances of Qiuping
2.6 丙二醛含量的变化
由图6 可知:NaCl 胁迫下,随着溶液浓度的升高,丙二醛含量呈波动变化的趋势,且 90 mmol/L NaCl 处理的丙二醛含量极显著高于其他处理;NaHCO3胁迫下,随着溶液浓度的升高,丙二醛含量也呈波动变化的趋势,120~180 mmol/L NaHCO3处理的丙二醛含量均显著低于CK。此外,NaCl胁迫下丙二醛含量的最大值高于NaHCO3胁迫下的最大值。
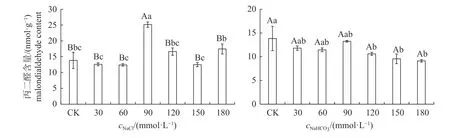
图6 不同浓度NaCl 和NaHCO3胁迫对秋萍叶片丙二醛含量的影响Fig.6 Effects of different concentrations of NaCl and NaHCO3stress on the leave malondialdehyde content of Qiuping
3 讨论
红树莓组培苗具有栽后生长整齐、旺盛的特点,明显优于根蘖苗,为建园生产首选苗木类型。该特性有助于减轻非试验因素的影响,故本研究选择组培苗作为试验材料,盆栽培养到合适大小后进行试验。
本研究表明:低浓度NaCl 和NaHCO3胁迫对秋萍生长具有促进作用,表现为叶色较深,光合色素含量增加,积累渗透调节物质,SOD 和POD 活性降低,CAT 活性升高,下部叶脱落少;中、高浓度盐胁迫的抑制作用体现在既可直接影响植物生长,也可通过抑制净光合速率和气孔导度影响物质合成,从而间接影响生长,且盐度越大、作用时间越长越明显[13]。处理组植株在应对较高浓度(>120 mmol/L)盐胁迫时,叶片脱落增加,可能以此排出盐分,这与同属蔷薇科的紫穗槐表现[14]相似。盐碱胁迫导致生理干旱,引发离子胁迫和渗透胁迫,碱性盐还会造成高pH 胁迫。本研究中,NaCl 组有较明显的叶片症状,如发黄、边界不明、产生不规则斑点以及由下向上干枯脱落,高浓度组上部叶边缘枯死,有失绿斑点;而NaHCO3组则表现为全株叶片逐渐偏黄,这些现象与光合作用受到抑制、叶片气体交换量大幅降低有关[15]。
在光合作用和光合色素含量方面,除胞间二氧化碳浓度外,2 种盐胁迫下光合指标均随盐浓度的升高整体呈下降的趋势,随着处理时间的延长,碱性盐胁迫条件下的降低幅度大于中性盐胁迫,这与苦楝[16]和油莎豆[17]受到中性盐和碱性盐胁迫的反应规律相似,也与盐碱胁迫下砂糖橘叶片相对含水量、叶绿素含量、光合速率、蒸腾速率和气孔导度明显降低的情况[18]相似。净光合速率和气孔导度的变化规律与鄞红葡萄受NaCl胁迫的变化[19]一致,但胞间二氧化碳浓度的变化规律与鄞红葡萄[19]不完全相同;NaHCO3胁迫15 d,各处理组秋萍红树莓的蒸腾速率均为递降,这与速生白榆[20]的表现相似,也与苦楝幼苗的净光合速率和蒸腾速率随中性盐和碱性盐浓度的提高显著降低[16]的表现相似。低浓度(30~60 mmol/L)的2 种单盐胁迫至10 d 时,均能促进秋萍增加气体交换,提高光合速率;中等浓度(90~120 mmol/L)胁迫下气孔导度相持平,说明气孔因素在此时不是光合速率的限制因子;而达到较高浓度(150~180 mmol/L)时,非气孔因素成为抑制的主导因素。中、高浓度胁迫时净光合速率下降的原因主要与气孔导度、蒸腾速率和叶绿素含量下降有关,与Heritage 和Meek 红树莓受到干旱胁迫时净光合速率和气体交换量的变化规律以及大量积累可溶性糖和脯氨酸的现象[21]相吻合。结合叶绿素含量和净光合速率持续降低以及180 mmol/L NaCl 组2 株秋萍死亡的现象,说明秋萍植株已达到耐盐的极限。随着盐浓度的升高,胞间二氧化碳浓度的变化规律与其亲本Autumn Bliss[22]相同,无显著差异;其他指标则与玉米[13]和棉花[23]受到盐胁迫时的变化相近。秋萍的总叶绿素和类胡萝卜素含量均随着盐胁迫浓度的增加呈先升高后降低的变化,但在150~180 mmol/L NaCl 胁迫时总叶绿素含量出现反常的增高,推测其原因可能与以下因素相关:叶片细胞结构遭破坏,失水造成其相对含量增加;加速合成叶绿素以应对RuBP 羧化酶活性的降低;加速合成叶绿素以抵抗活性氧的漂白作用。高浓度NaHCO3胁迫虽无秋萍植株死亡,但达到中等浓度后,总叶绿素含量降低,植株叶片逐渐整体偏黄绿色,有缺素症状(缺铁黄化),生长缓慢至停止,这可能与碱胁迫使PSⅡ反应中心被破坏以致同化能力下降[24]有关。
胁迫条件下,植物体内产生大量具有高活性和毒性的活性氧,对植物生长发育产生不利影响。当植物受到胁迫后,其体内会启动清除活性氧的酶系统,它们相互协调,共同作用,保护膜结构稳定[25-26]。2 种单盐胁迫条件下,秋萍SOD活性呈降低—升高—降低的变化趋势,这与对石榴[27]和文冠果[28]的研究结果相同。30~150 mmol/L NaCl 胁迫下,POD 活性受到抑制并逐渐降低,180 mmol/L NaCl 时POD 活性骤升;而CAT 活性随NaCl 浓度的增加呈先升后降的变化趋势,180 mmol/L NaCl 时最低,结合植株出现死亡的现象,说明180 mmol/L NaCl 的胁迫已严重导致其生理紊乱。NaHCO3胁迫下,各胁迫组SOD和POD 活性均不及CK 处理,说明SOD 和POD活性不可单独作为衡量胁迫程度的指标;而CAT 活性发生了极显著的变化,是主要调节酶。30~60 mmol/L NaHCO3胁迫下,CAT 活性均低于对照,结合其他指标的变化,说明秋萍可以适应一定程度的碱性盐胁迫,且能促进生长,这与“黄秋葵种子低浓度碱胁迫促进萌发,CAT 活性变化幅度大”的研究结果[29]相同。
胁迫会打破原有的活性氧产生与清除的动态平衡,导致细胞膜脂过氧化作用加强,膜系统受损。丙二醛的变化可反映膜系统的受损程度,2 种单盐胁迫下秋萍的丙二醛含量变化规律与同属植物牛叠肚[30]一致,故推测丙二醛呈现间断积累的现象是此类植物的特性。胁迫对植物渗透调节物质的积累也有显著影响。可溶性糖是植物光合作用的主要产物之一,具有存贮能量的功能,是重要的渗透调节物质[31-32]。本研究中,NaCl 胁迫下秋萍的可溶性糖含量变化趋势并不显著,而可溶性蛋白和脯氨酸含量均有显著的变化,尤其是脯氨酸含量差异达到数倍,说明NaCl 胁迫下可溶性糖并非是主要的渗透调节物质,而是以脯氨酸与可溶性蛋白调节为主;NaHCO3胁迫下,可溶性糖和脯氨酸含量均在120 mmol/L 处理时升高,说明30~90 mmol/L NaHCO3时主要由可溶性蛋白进行调节,120 mmol/L NaHCO3时由三者共同发挥调节作用。郭书奎等[13]认为脯氨酸积累与叶绿素含量正相关,但本研究2 种盐胁迫下脯氨酸的变化趋势不同,具体机制还有待进一步研究。碱性盐胁迫还会造成高pH 胁迫,高pH 胁迫会显著抑制Mg、Fe 和Cu 元素的吸收,同时抑制糖类和氨基酸的合成与积累[33],导致高浓度组渗透调节物质含量降低。试验期间还发现夜蛾类首选90~120 mmol/L 盐胁迫的植株产卵,说明盐碱胁迫还会对昆虫的行为存在互作关系,如不同浓度的盐胁迫影响褐飞虱的取食偏好、寄主偏好和繁殖率,呈现盐度依赖效应[34],秋萍作为寄主植物对昆虫寄主选择的调控作用还需要进一步研究。
4 结论
低浓度NaCl 和NaHCO3胁迫可促进秋萍生长;中等浓度下,秋萍表观症状轻,可正常生长,生理干旱现象较轻;高浓度胁迫下,秋萍表观特性和多个生理指标受到严重影响,并出现死亡现象。秋萍对NaHCO3的耐性较NaCl 强,对NaCl 胁迫的适应极限为150~180 mmol/L,而对NaHCO3胁迫的耐性可达180 mmol/L 以上。秋萍对盐碱胁迫适应性较强,适应范围较宽,适宜在盐碱地区推广,具有良好的经济和生态价值。
